鳕鱼骨低苦味多肽酶解制备及其特性研究
2021-07-17赵起越鞠馨瑶徐献兵
赵起越,鞠馨瑶,吴 超,徐献兵,*,杜 明,*
(1.海洋食品深加工省部共建协同创新中心,辽宁大连 116034;2.大连工业大学食品学院,国家海洋食品工程技术研究中心,辽宁大连 116034)
鳕鱼加工后,大约占鱼重15%的鱼骨作为废弃物处理,带来了重大经济损失和环境污染等问题[1]。有研究表明,鳕鱼骨中富含35.8%的蛋白质,而脂肪含量仅有1%,说明鳕鱼骨是一种优质的蛋白源加工原材料[2]。近年来,通过酶制剂进行蛋白质的回收利用技术愈发成熟,相比于其他水解方法,酶水解具有高效、安全、便捷等特点[3]。一些研究针对不同蛋白原料提出了各种酶解配方和技术,但酶解不当会导致苦味的产生从而影响食品的口感和品质,该问题一直困扰着蛋白酶解技术在食品产品开发中的普遍推广应用[4]。理论上苦味的产生与疏水氨基酸的暴露程度有关,控制蛋白酶解过程中疏水性氨基酸的暴露有望减少酶解液苦味的产生[5−6]。许多文献报道了酶解动物骨生产酶解肽的研究[7],而对于鳕鱼骨酶解的研究,范巍巍等[8]在同等条件下使用中性蛋白酶、碱性蛋白酶、木瓜蛋白酶、风味蛋白酶、动物蛋白酶分别对鳕鱼骨进行水解,木瓜蛋白酶获得的水解物产生的苦味最低。但是针对酶解技术的特异性,直接应用相关酶解技术参数和配方酶解鳕鱼骨无法得到满意产品,本研究主要针对鳕鱼骨这一特有蛋白原料开发低苦味酶解肽,目前没有相关技术报道。
本文以鳕鱼骨为原料,通过适度水解和深度水解的方法,以电子舌测定的苦味值为指标,监测酶解物苦味的产生。同时采用纳升液相串联四级杆飞行时间质谱(Nano-LC-Q-TOF-MS/MS)技术对不同酶解多肽进行分子结构鉴定,建立多肽结构与苦味形成的关系,为低苦鳕鱼骨多肽产品的开发提供技术指导和理论支撑。
1 材料与方法
1.1 材料与仪器
冰冻鳕鱼骨 青岛益和兴食品有限公司;木瓜蛋白酶(1×104U/g) 南宁庞博生物工程有限公司;碱性蛋白酶(2×105U/g) 北京索莱宝科技有限公司;风味蛋白酶(5×104U/g) 诺维信中国生物技术有限公司;胰蛋白酶(5×104U/g) 美国Sigma 公司;2,4,6-三硝基苯磺酸(TNBS) 上海吉至生化科技有限公司。
CF16RXⅡ高速离心机、LA8080 氨基酸自动分析仪、SU8010 冷冻扫描电镜 日本Hitachi 公司;YXQ-LS-50G 自动电压力灭菌锅 上海博讯有限公司;RLPHR1-4 真空冷冻干燥机 德国Marin Christ公司;UDK129 自动凯氏定氮仪 北京盈盛泰科技有限公司;TS-5000Z 电子舌 日本Insent 公司;ImpactⅡQ-TOF 质谱仪 布鲁克科技有限公司;EASY-Nlc 1200 纳升液相 赛默飞世尔科技公司。
1.2 实验方法
1.2.1 鳕鱼骨蛋白的水解 鳕鱼骨水解的工艺流程见图1。
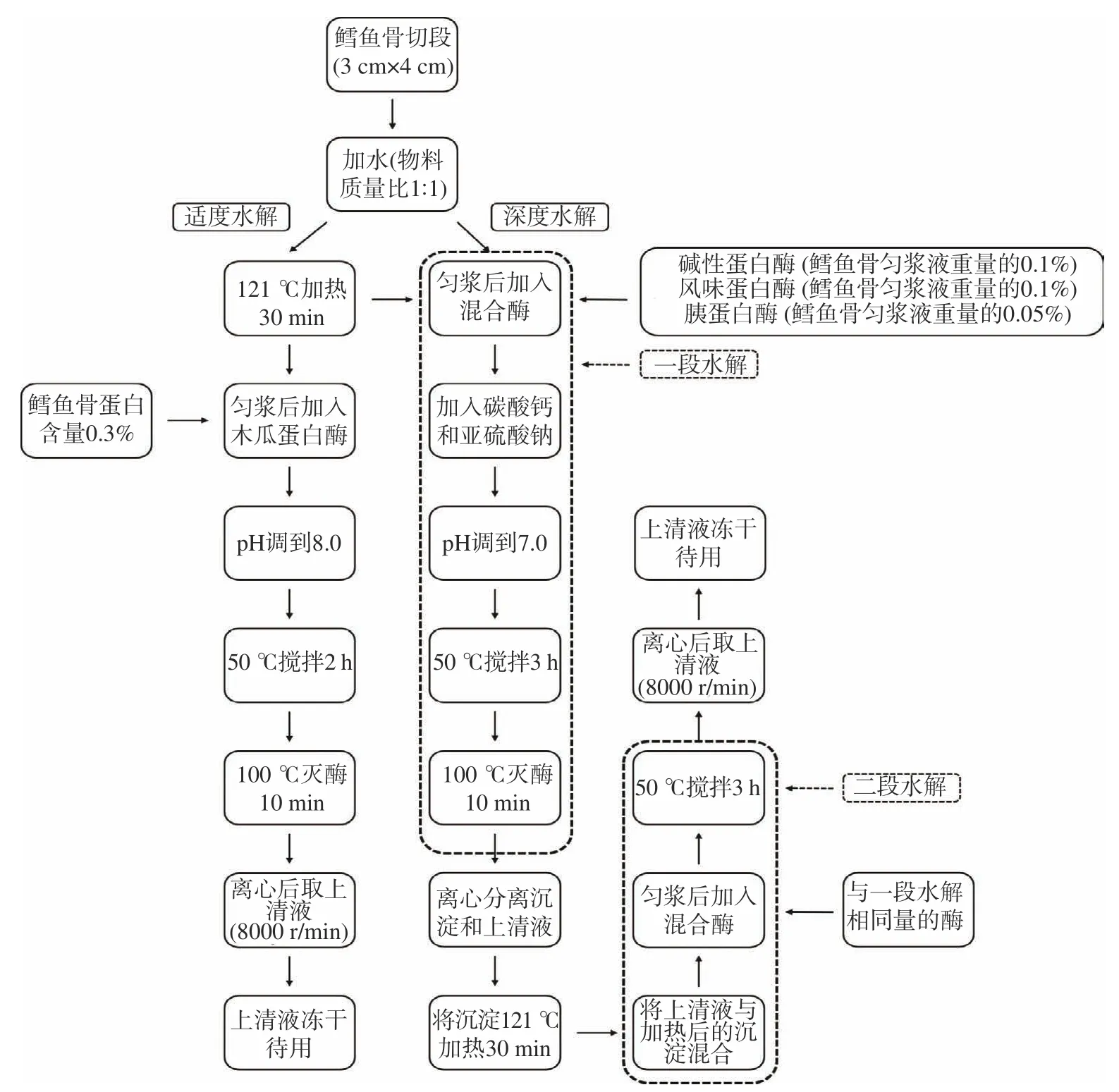
图1 鳕鱼骨水解的工艺流程Fig.1 The process flow diagram of cod bone hydrolysis
1.2.2 水解度的测定 参考周慧江等[9]的方法,将水解上清液稀释100 倍,取100 μL 稀释液加入试管中,添加900 μL 的磷酸盐缓冲液(pH8.2)补充至1 mL,加入2 mL 的TNBS(0.05%)溶液,振荡混匀后避光在50 ℃下反应60 min,加入4 mL 的0.1 mol/L HCl 终止反应后,在340 nm 波长下测定吸光度。以L-亮氨酸作为标准品绘制标准曲线,在0~60 mmol/L范围内绘制标准曲线。拟合的线性方程为:y=0.0112x+0.0892,R²=0.9991。x 为氨基质量浓度(mmol/L),y 为吸光值。
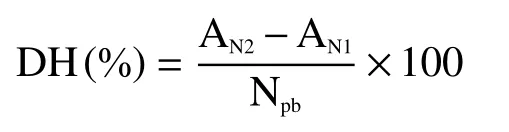
式中:DH 为水解度(%);AN1为蛋白水解前氨基氮含量(mmoL/g);AN2为蛋白水解后氨基氮含量(mmol/g);Npb为蛋白底物中肽键氮含量(mmol/g)。
1.2.3 蛋白质含量的测定 根据GB5009.5-2010[10]方法进行蛋白质含量的测定。
1.2.4 冷场扫描电镜 将5 μg 酶解后的鳕鱼骨冻干粉末均匀涂抹在胶条上,并贴在样品台上,喷金后在真空下通过气锁传送装置转移到舱室中心,并在观察前以80 kV 的电压进行传导,在5 kV 的电压下获得扫描电子显微镜图像。
1.2.5 电子舌的测定 取30 mL 水解上清液放置在样品杯中,电子舌开始测定前,对鲜味(AAE)、咸味(CTO)、酸味(CAO)、苦味(COO)和涩味(AE1)这五种电极传感器进行24 h 的活化,然后将传感器完全浸入到样品杯中进行测定,每个样品测定三次取平均值。
1.2.6 游离氨基酸的测定 将水解上清液以10000×g离心10 min 除去不溶物,然后加入等体积的丙酮,并以10000×g 再次离心除去大蛋白,干燥后加入同等体积的0.02 mol/L HCl,通过0.20 μm 的滤膜进行过滤。处理过的样品通过Hitachi 高性能阳离子交换柱(柱温57 ℃)进行分析,衍生温度135 ℃,流动相流速为1 mL/min。
1.2.7 多肽序列的测定 水解产物用Cleanert S C18-SPE 色谱柱进行脱盐处理[11],将脱盐的水解物干燥后溶解在0.1%的甲酸水中。载有4 μL 的样品通过纳升液相上的PepMap C18柱(2 μm,50 μm×15 cm)进行分离,流速为20 μL/min。流动相A 为超纯水,流动相B 为80%的乙腈,分别向A 相和B 相中添加0.1%甲酸。0~82 min 时,流动相B 从9%增加至90%;82~90 min 时,流动相B 从90%降至2%;90~95 min 时,流动相B 从2%增加至9%。洗脱后,通过Q-TOF-MS/MS 质谱鉴定分离出的化合物。峰的标记和肽段的鉴定通过Mascot v1.4.0.38软件进行。分析质荷比范围为50~2200。每个样品进行三次重复分析。蛋白质数据库来自https://www.ncbi.nlm.nih.gov/。
1.3 数据处理
本研究采用SPSS 16.0 软件进行显著性分析,各组数据均取平均值,P<0.05 表示差异显著。所有数据均使用Origin 8.5 软件分析数据并作图。每组数据重复3 次。
2 结果与分析
2.1 鳕鱼骨蛋白水解对苦味的影响
2.1.1 适度水解不同时间下水解度以及苦味和涩味的变化 如图2可知,鳕鱼骨水解度在0~180 min增加较快,180~240 min 时基本趋于稳定。如图3A可知,在120 min 之前,水解度的增加没有引起苦味的显著变化,直到180 min 时,酶解物中的苦味具有显著性提高(P<0.05),并且之后苦味也随着时间的增加而增加。如图3所示,对照组(0 min)与第60 min和第120 min 时的苦味值无显著性差异,苦味值分别为6.1、5.9 和5.8,这可能由于水解时间过短,水解不完全导致一些具有苦味特征的短肽没有暴露,苦味值没有显著性的变化。同时,60 min 时电子舌测定的涩味值为13.27,120 min 时涩味值为11.67(图3B),因此在120 min 时,酶解液具有很低的苦味强度,并且涩味相比于对照组(0 min)也有了显著性的降低,所以在120 min 时鳕鱼骨酶解液具有较好的风味特征。综上所述,当水解时间达到120 min,水解度达到7.48%时,酶解物无明显的苦味特征。
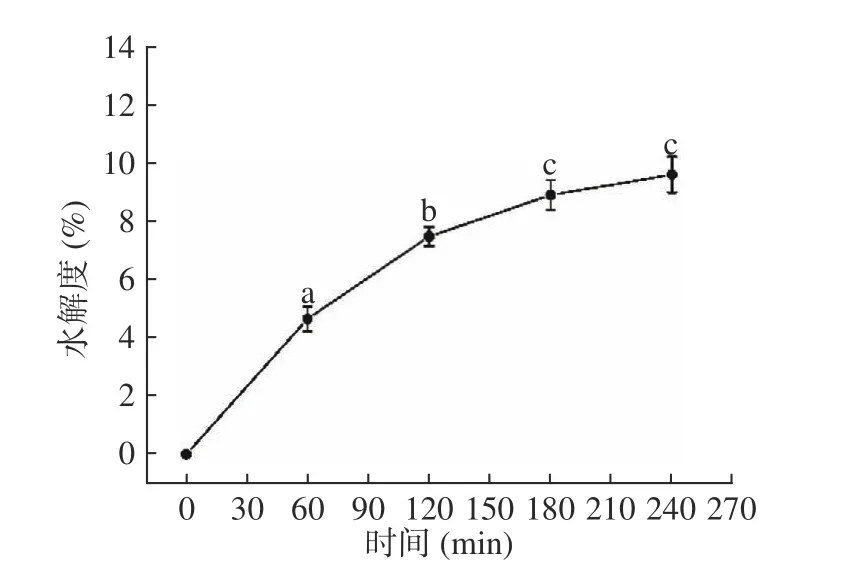
图2 适度水解不同时间下水解度的变化Fig.2 The change of the degree of hydrolysis under different time of mild hydrolysis
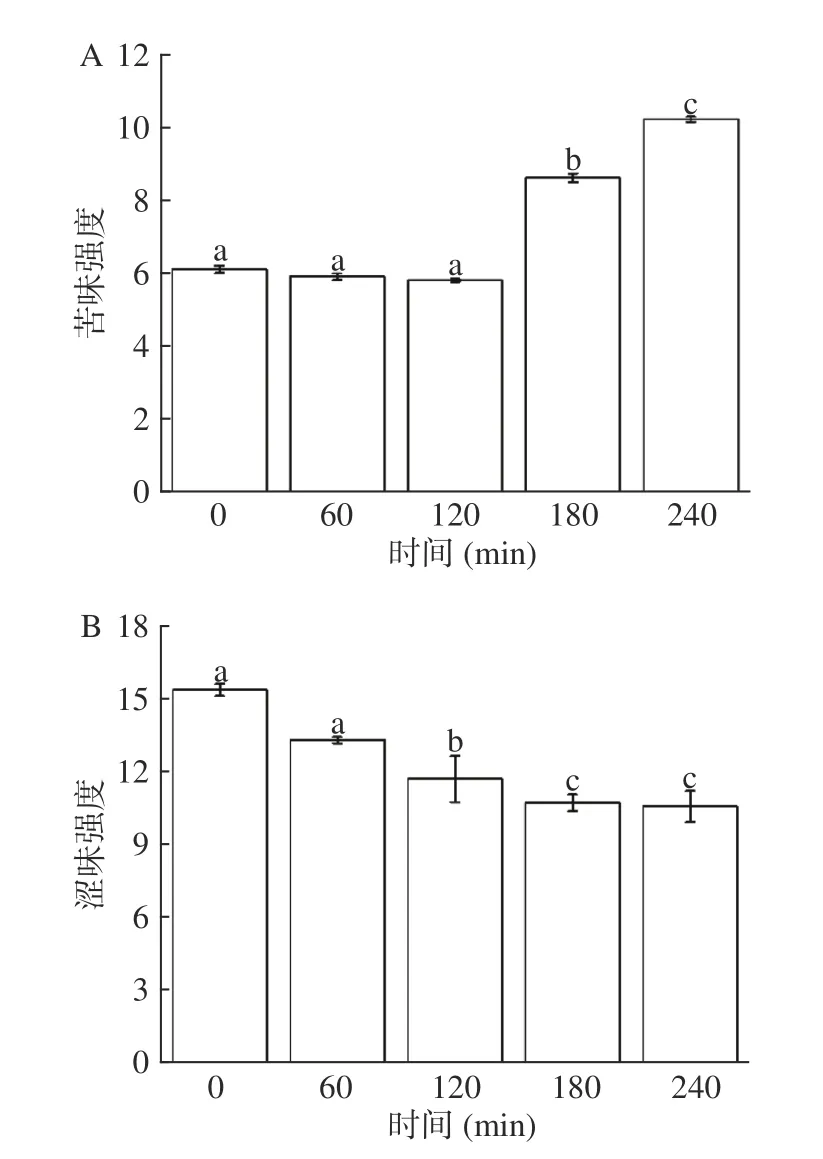
图3 适度水解不同时间下苦味强度和涩味强度的变化Fig.3 The change of bitterness intensity and astringency intensity under different time of mild hydrolysis
2.1.2 深度水解不同时间下水解度以及味道值的变化 通过碱性蛋白酶、风味蛋白酶和胰蛋白酶对鳕鱼骨进行深度水解,但由于骨类物质特殊的刚性结构,水解效率会受到限制,如猪骨在中性蛋白酶、胰蛋白酶和木瓜蛋白酶的作用下水解度仅能达到约14%[12],本实验通过两步水解解决了鳕鱼骨水解效率低的缺点。如图4所示,加入混合酶后2 h 水解度趋于平稳,在第2~3 h 虽然水解度有显著性的提升(P<0.05),但从趋势上看,水解度趋于平稳,已经达到了平衡的状态(一段水解)。将第一段水解的鳕鱼骨沉淀高压蒸煮30 min 后,继续加混合酶进行水解,发现水解度有较为显著的增加,直至第6 h 趋于平衡,此时水解度高达49.24%(二段水解)。
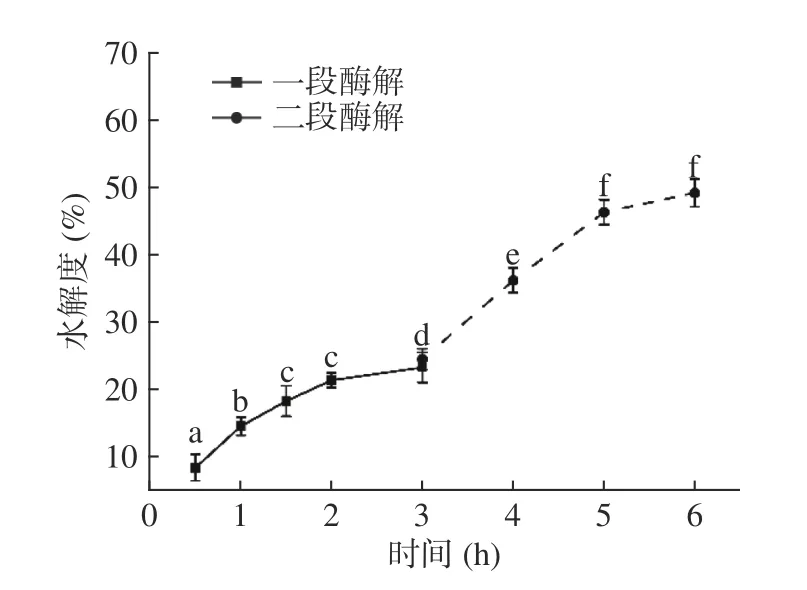
图4 深度水解不同时间下水解度的变化Fig.4 The change of degree of hydrolysis under different time of extensive hydrolysis
如图5所示,将一段水解与二段水解后的鳕鱼骨沉淀进行对比,发现一段水解后鳕鱼骨表面呈现约100 nm 的长条纹路,二段水解后鳕鱼骨表面呈现约20 nm 的圆形颗粒。这表明高压蒸煮有效地软化了鳕鱼骨的刚性结构,使混合酶能够更深入地对底物进行水解,促进水解度的增加。同时测定鳕鱼骨及其一段水解与二段水解后沉淀中的蛋白含量,鳕鱼骨原料(干重)中的蛋白质含量为59.65%,第一阶段水解后,沉淀物中(干重)蛋白质的含量减少到14.26%,而二段水解后蛋白质含量减少到9.36%,说明深度水解的方式可以提高鳕鱼骨蛋白质的水解效率,从而提高水解度,达到深度水解的效果。

图5 一段酶解后(A)与二段酶解后(B)鳕鱼骨表面的扫描电镜图(150000×)Fig.5 The scanning electron micrograph of cod bone surface after the first (A) and second (B) enzymolysis(150000×)
如表1所示,对一段水解与二段水解后的上清液进行了味道值的电子舌测定,二段水解后的综合味道值要优于一段水解后,尤其苦味显著降低(P<0.05),这可能由于长链肽的进一步水解使多肽中的疏水性氨基酸残基水解成游离氨基酸,而游离氨基酸对苦味无明显影响[13−14],导致苦味的降低。游离氨基酸的产生对鲜味的变化具有较大的影响,如谷氨酸、苯丙氨酸、天冬氨酸、丙氨酸、甘氨酸、酪氨酸这些呈味氨基酸的增加会导致鲜味上升[15]。随着水解度的增加,大量的盐类物质也会随之产生,这些物质促使着水解物咸味的增加[16]。深度水解后的味道变化有利于其在食品中进行应用,通过水解达到增鲜、减咸、减苦的效果,并且避免了其他物质的添加,更有利于健康以及现代食品的加工理念[17]。

表1 两段式酶解后鳕鱼骨酶解上清液电子舌味道值Table 1 The taste value of enzymatic supernatant electronic tongue after the second enzymolysis
2.2 深度水解对鳕鱼骨水解物游离氨基酸的影响
深度水解是通过游离氨基酸的无苦特性降低蛋白水解物中的苦味,当鳕鱼骨水解度达到49.24%时,大量的疏水性氨基酸残基会转化为游离氨基酸,如表2所示,在一段水解中,丙氨酸、缬氨酸、蛋氨酸、异亮氨酸、亮氨酸、苯丙氨酸这六种疏水性游离氨基酸占总游离氨基酸含量的36.09%,进行深度水解后,六种疏水性氨基酸的含量相比于一段水解时上升幅度分别为39.51%、92.25%、67.45%、48.78%、41.31%、21.43%,并且疏水性游离氨基酸占总游离氨基酸含量的37.09%。这表明多肽中的一些疏水性氨基酸残基被水解成游离氨基酸,导致酶解液中疏水性多肽的降低,从而抑制了苦味的产生。
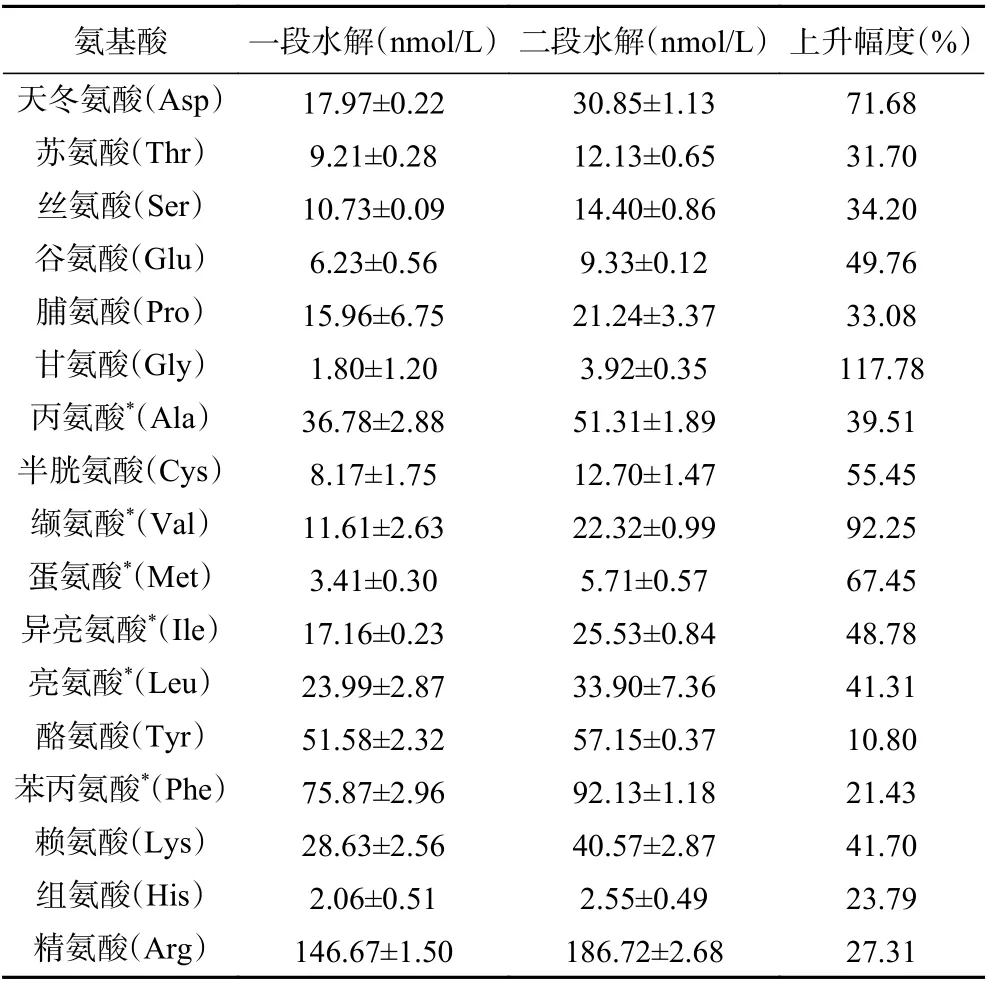
表2 两段式酶解后鳕鱼骨酶解上清液游离氨基酸的含量Table 2 The free amino acid content of cod bone hydrolysate supernatant after the second enzymolysis
2.3 适度水解与深度水解的鳕鱼骨多肽对苦味的影响
通过Nano-LC-Q-TOF-MS/MS 对多肽分子量的分布进行研究,如图6所示,对适度水解和深度水解的多肽分子量进行排布,发现无论适度水解还是深度水解,多肽的分子量主要都在500~3000 Da 的范围内。木瓜蛋白酶进行适度水解时,多肽主要集中在1000~2000 Da 的范围内,并且在1800~1900 Da 的范围内多肽含量最高,大于2000 Da 的多肽数量较少。在混合酶作用下的深度水解中,多肽数量主要集中在500~1500 Da 的范围内,并在600~700 Da 的范围内出现了峰值。综上所述,适度水解后的多肽总体分子量要大于深度水解,并且木瓜蛋白酶的作用位点位于赖氨酸残基和精氨酸残基[18−19],赖氨酸和精氨酸并不是疏水性氨基酸,这会促使一些疏水性氨基酸残基位于肽链内部,并且多肽的卷曲也可能使一些疏水性氨基酸隐藏在肽链内部,促使苦味降低。在深度水解时,由于酶切作用点的增加和两段式水解的技术手段,深度水解的多肽分布基本上以短肽为主,更导致了疏水性氨基酸残基转化成游离氨基酸,这是促使深度水解苦味较低的主要因素[5,20]。通过不同技术手段进行苦味控制,这种简便、安全的技术可以应用于食品加工中,适度水解液的多肽分子量较大,具有良好的乳化性和起泡性,可以用于乳液方面的研究[21−22];深度水解液的多肽分子量较小,游离氨基酸含量较高,拥有较好的活性和鲜味,可以广泛应用于调味料、保健食品等方面的开发[23]。
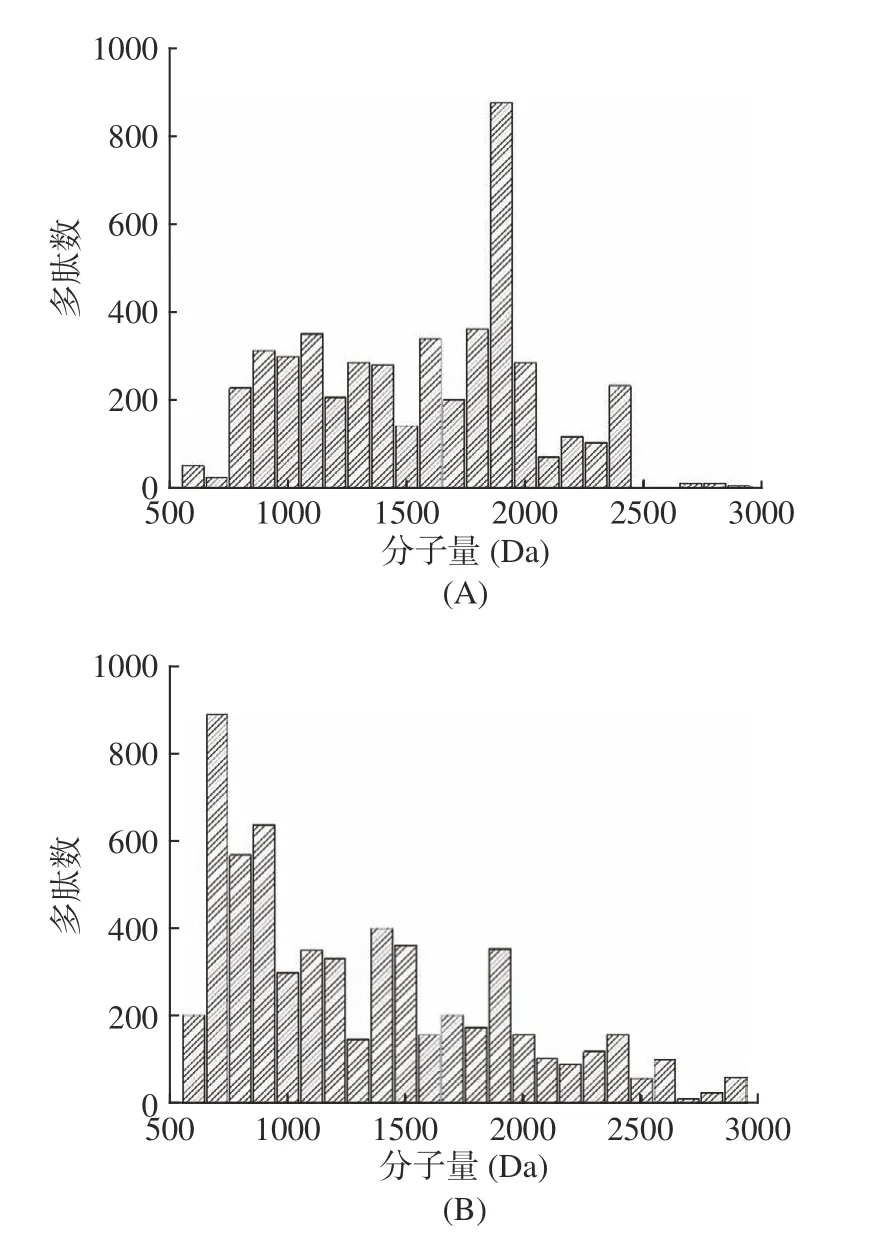
图6 适度水解(A)与深度水解(B)后鳕鱼骨酶解液中多肽分子量的分布Fig.6 The molecular weight distribution of cod bone hydrolysates after mild (A) and extensive (B) hydrolysis
由表3、表4可知,将适度水解和深度水解后鳕鱼骨酶解物中数量较多的30 种肽段进行研究。总体上,无论适度水解还是深度水解,多肽主要都来自胶原蛋白、肌球蛋白和肌动蛋白,尤其是胶原蛋白居多,这也间接证明了鳕鱼骨中含有大量的胶原蛋白,并且适度水解中多肽的分子量偏大,多肽主要集中在大于1000 Da 的区域;深度水解多中多肽的分子量偏小,多肽主要集中在1000 Da 以下。
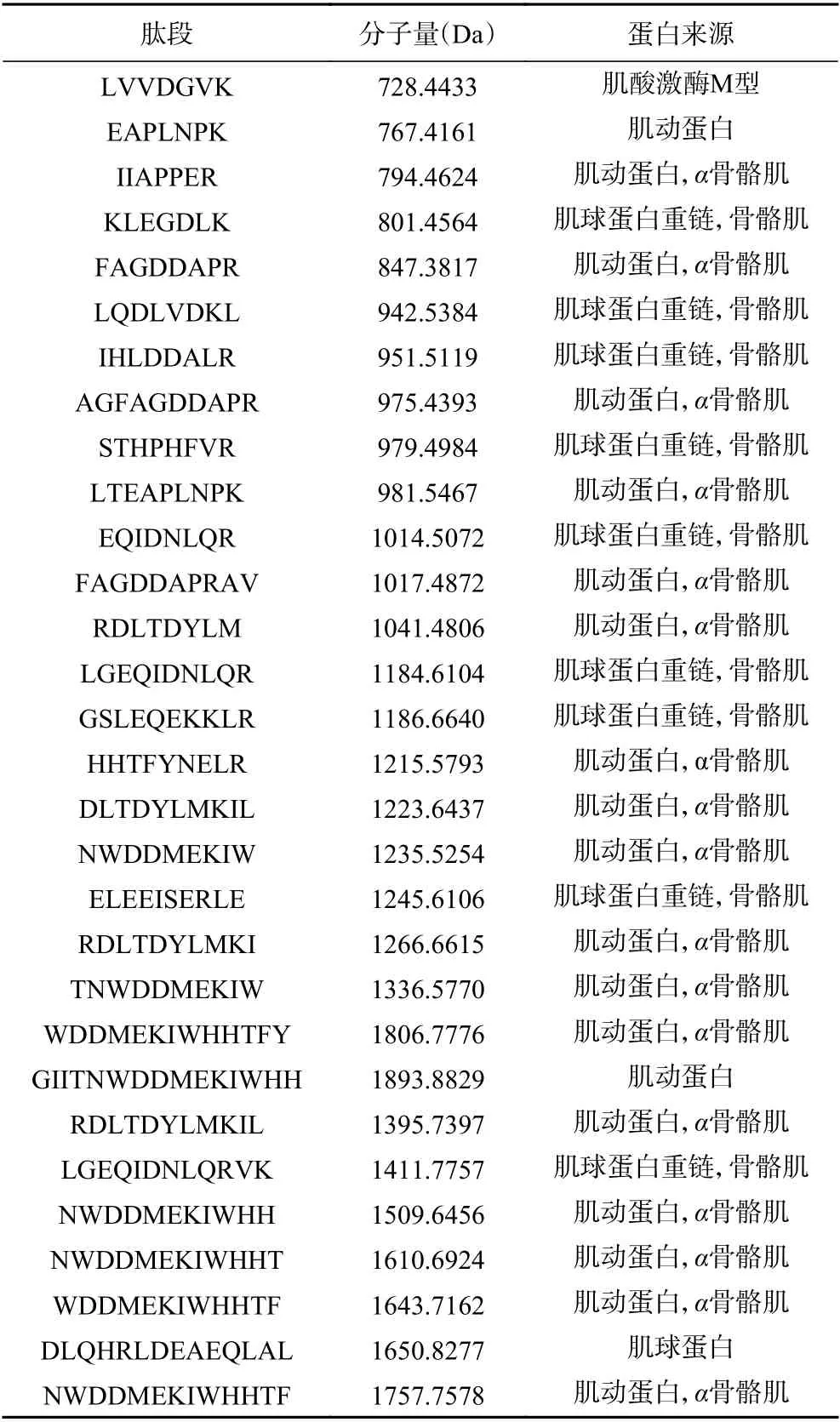
表3 适度水解后鳕鱼骨酶解物的多肽序列Table 3 The polypeptide sequence of cod bone hydrolysates after mild hydrolysis
如表3所示,在适度水解中六种疏水性氨基酸(Ala、Val、Met、Leu、Ile、Phe)占氨基酸总量的31.17%,并且氨基酸多数位于多肽的中间位置。有研究表明疏水性氨基酸位于肽的C-末端或N-末端时,苦味会更重[24−25]。在表4中,多数的多肽氨基酸数量少于10 个,六种疏水性氨基酸占总氨基酸的30.13%,在C-末端或N-末端的多肽主要是甘氨酸,由于甘氨酸不属于疏水性氨基酸,所以产生的苦味值较低。
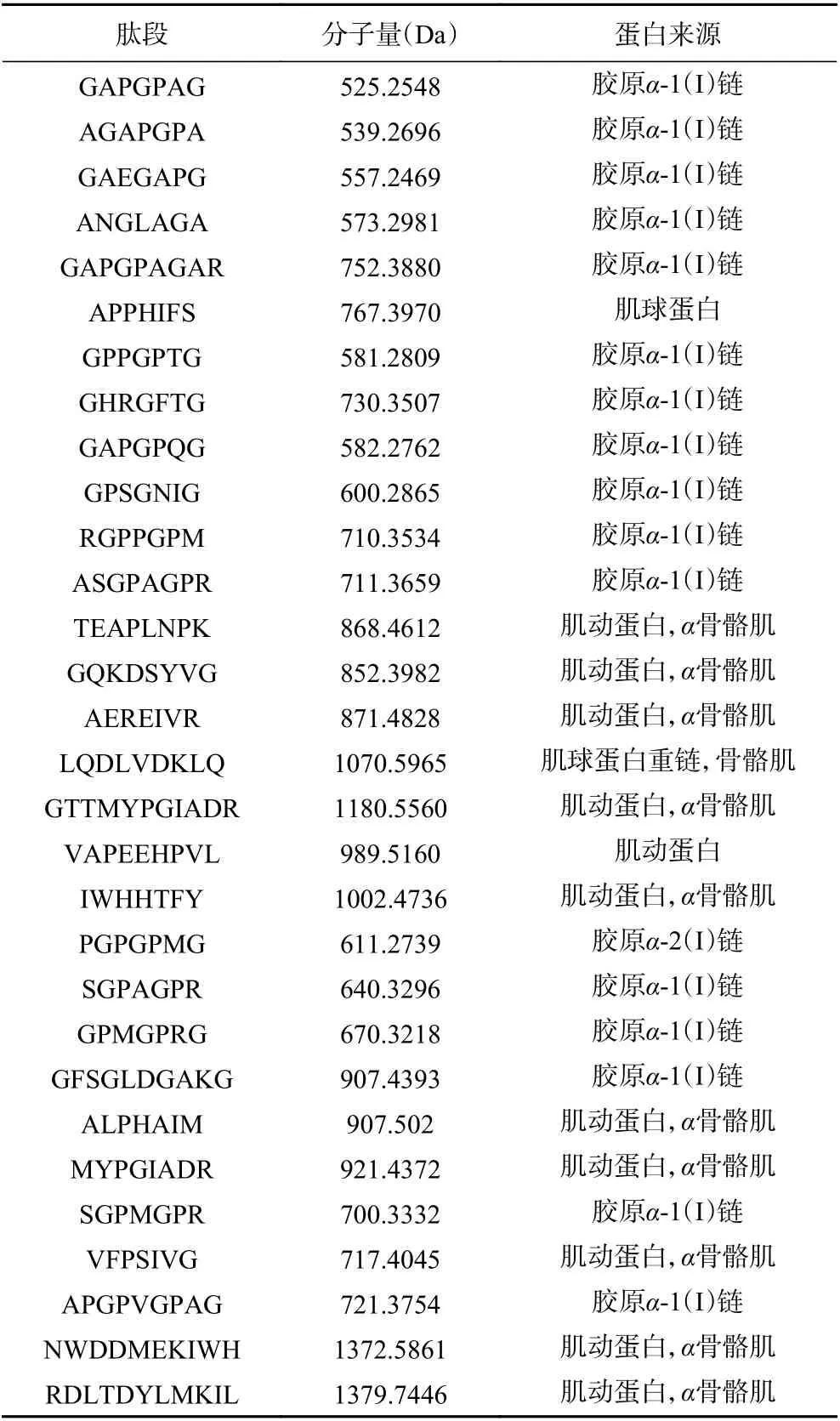
表4 深度水解后鳕鱼骨酶解物的多肽序列Table 4 The polypeptide sequence of cod bone hydrolysates after extensive hydrolysis
3 结论
本研究以鳕鱼骨为原料,通过蛋白酶水解技术将鳕鱼骨中的蛋白质进行回收利用,通过控制水解度的方法控制水解物苦味的产生,并探究水解物中多肽和游离氨基酸对于苦味的产生机制。结果表明,适度水解时,添加蛋白含量0.3%的木瓜蛋白酶酶解2 h,此时酶解物的苦味值在水解度达到平衡前最低;通过两段式酶解,添加底物质量0.1%的碱性蛋白酶、0.1%的风味蛋白酶和0.05%的胰蛋白酶,在高压蒸煮技术的辅助下水解6 h 的酶解物无明显的苦味特征,通过控制水解度的方法抑制了酶解过程中大量苦味的产生,这种低苦的酶解液可以作为天然乳化剂用于各种饮料、调味品等食品中。但酶解液中苦味肽的种类以及作用机制仍需进一步的探索。
