茶树精油对耐甲氧西林金黄色葡萄球菌生物被膜的影响
2021-07-17莫亚男尚若锋郝宝成王学红梁剑平
程 峰,刘 宇,杨 珍,莫亚男,尚若锋,郝宝成,王学红,梁剑平
(中国农业科学院兰州畜牧与兽药研究所,农业农村部兽用药物创制重点实验室,甘肃省新兽药工程重点实验室,甘肃兰州 730050)
由于在人类疾病治疗中抗生素的不合理使用,细菌耐药性问题变得越来越严重,特别是耐甲氧西林的金黄色葡萄球菌(Methicillin-resistantStaphylococcus aureus,MRSA)的大流行,更是引起了人们对细菌耐药性问题的广泛关注[1]。MRSA 可以引起多种疾病,例如医院获得性感染、社区获得性感染、肺炎、败血症和皮肤感染[2]。MRSA 还特别容易形成由生物被膜(biofilm,BF),生物被膜是指细菌黏附于接触表面所形成的大量细菌聚集膜状物[3],是细菌为了适应自然环境有利于生存的一种特殊结构。研究表明,生物被膜形成后细菌的数量会显著增加,并且可以逃避免疫系统的识别[4]。同时,生物被膜可以显著增加细菌对药物的抵抗能力,导致细菌耐药性问题愈发严重,有研究表明游离细菌对药物的敏感性是生物膜态细菌的10~1000 倍左右[5−6]。但是在临床上只有很少的药物对MRSA 生物被膜有很好的抑制或者清除作用[7−8]。因此开发一种新的可以有效控制MRSA 生物被膜的药物迫在眉睫。
茶树精油(tea tree oil,TTO)是从澳大利亚的桃金娘科互叶白千层的新鲜枝叶中以水蒸汽蒸馏的方式提取出来的一种无色至淡黄色液体,有尖锐的樟脑气味和薄荷醇的清凉感[9]。茶树精油具有广谱抗细菌[10]、真菌[11]、病毒[12]以及寄生虫[13]等生物活性,因而在香料、农业、食品工业以及化妆品等行业都具有广泛的应用。研究发现,茶树精油对金黄色葡萄球菌[10]和白色念珠菌[14]等多种细菌和真菌生物被膜的形成也有一定的抑制作用,可以破坏它们的生物被膜,但其机制尚不完全明确。因此本文选取MRSA的标准菌株ATCC43300 作为实验菌株,来研究茶树精油对于MRSA 生物被膜的抑制机制,为茶树精油作为新型抗菌天然药物的开发提供理论基础。
1 材料与方法
1.1 材料与仪器
MRSA 标准菌株ATCC43300 美国标准菌种库;茶树精油 澳大利亚Maincamp 公司;BHI 培养基、TSB 培养基 英国Oxoid(Fisher)公司;MHA/B培养基 北京奥博星公司;RNA 提取试剂盒 杭州博日生物科技公司;q-RT-PCR 试剂盒、反转录试剂盒 日本Takara 公司;LIVE/DEAD™ BacLight™试剂盒 美国ThermoFisher Scientific公司。
多功能酶标仪 美国GENE 公司;激光共聚焦显微镜 德国ZEISS 公司;超微量紫外分光光度计 美国Plextech 公司;荧光定量PCR 仪 美国Thermo Fisher Scientific 公司。
1.2 实验方法
1.2.1 茶树精油对MRSA 悬浮细菌的抑制作用 根据CLSI(Clinical and Laboratory Standards Institute)药敏实验指导标准,使用微量稀释法测定了茶树精油对1 株标准菌株(MRSA,ATCC43300)以及12 株临床分离菌株(金黄色葡萄球菌)的最小抑菌浓度(MIC)以及最小杀菌浓度(MBC)。MIC 指能抑制细菌生长的最小药物浓度,MBC 指能杀灭99.9%的细菌的最小药物浓度。
1.2.2 茶树精油对MRSA 生物被膜形成的抑制作用参照Srdjan 等[15]的方法培养生物被膜并进行染色。首先在TSB 培养中将MRSA 静置培养24 h 以活化MRSA,然后将活化好的MRSA 用TSB-g(添加了1%葡萄糖的TSB 培养基)培养基稀释100 倍,同不同浓度的茶树精油(使茶树精油的终浓度为0.64%、0.32%、0.16%、0.08%、0.04%和0)一起加到平底的96 孔板中,静置培养,在6、12、24、36、48 h时弃去培养基,用无菌PBS 清洗3 遍,加入10%的甲醛固定过夜,弃去甲醛晾干,加入0.1%的结晶紫溶液染色30 min 后弃去结晶紫,然后用流水冲洗干净残余的结晶紫,至烘箱中烘干,加入95%的乙醇重悬结晶紫,静置30 min 后在酶标仪上测定OD590。
1.2.3 茶树精油对成熟生物被膜的清除作用 参照Srdjan 等[15]的方法制备成熟的生物被膜,制备好成熟的生物被膜之后,弃去培养基,用无菌PBS 清洗2~3 次,然后加入用TSB-g 培养基稀释好的茶树精油,使茶树精油的浓度分别为0.16%、0.08%、0.04%、0.02%、0.01%和0。在24 h 时弃去培养基,用无菌PBS 清洗3 遍,加入10%甲醛固定过夜,弃去甲醛,加入结晶紫染色后用流水冲洗干净,加入95%乙醇重悬结晶紫,静置30 min 后测定OD590,然后计算不同浓度的茶树精油对MRSA 生物被膜的清除率,计算公式为清除率(%)=(OD0−OD1)×100/OD0,式中,OD0为茶树精油浓度为0 时测得的吸光度,OD1为使用不同茶树精油浓度作用后生物被膜后所测得的吸光度。
1.2.4 激光共聚焦显微镜观察茶树精油对MRSA 生物被膜的影响 在6 孔板中使用细胞爬片培养生物被膜,并且加入不同浓度的茶树精油并使茶树精油的浓度分别为0.16%、0.08%、0.04%和0。使用赛默飞LIVE/DEAD™ BacLight™试剂盒进行染色,然后使用蔡司LSM800 激光共聚焦显微镜进行拍照,荧光选择FITC 和Texas Red,用ZEN 2.3 软件进行图像处理。
1.2.5 茶树精油对MRSA 生物被膜形成过程中多糖黏附素(PIA)合成和胞外(eDNA)释放的影响 参照官妍等[16]的方法,将用TSB 培养基静置培养活化后的MRSA 接种在含有不同浓度茶树精油(0.08%、0.04%、0.02%和0)的刚果红平板上。37 ℃静置培养24 h 观察平板变黑的程度,实验重复3 次。eDNA 的提取参照Kelly 等[17]的方法,将用TSB 培养基活化后的MRSA 用TSB-g 培养基稀释后加到24 孔板中,然后加入不同浓度的茶树精油并使茶树精油的浓度分别为0.16%、0.08%、0.04%、0.02%和0。静置培养24 h,加入10 μL 的EDTA,置4 ℃冰箱静置1 h,弃去培养基,加入700 μL 的TEN 缓冲液混匀,测定OD600并记录,然后将菌悬液移至新的EP 管中,12000 r/min 离心后将上清转入新的离心管中,用苯酚/氯仿/异戊醇(25:24:1)和氯仿/异戊醇(24:1)分别萃取一次,将上层水相加入3 倍体积的100%乙醇与1/10 体积的乙酸钠中,−20 ℃冰箱过夜后18000×g 离心20 min,弃去上清并加入预冷的70%乙醇洗涤,风干,并溶于20 μL TE 中,用超微量紫外分光光度计测定DNA 浓度。eDNA 的相对表达量用单位生物被膜的eDNA 含量来表示。
1.2.6 茶树精油对MRSA 生物被膜形成相关基因的影响 MRSA 细菌生物被膜形成有多种相关的基因,采用Primer 5 软件设计MRSA 生物被膜形成基因cidA,agrA的上下游引物(表1)。将含有0.08%茶树精油的菌悬液(使用TSB-g 培养基)在6 孔板中静置培养24 h,使用Simply P Total RNA Extraction Kit (Bioflux)试剂盒提取其总RNA。通过琼脂糖凝胶电泳验证提取RNA 的完整性;使用分光光度计测定RNA 的浓度,使用Taraka 反转录试剂盒进行反转录反应,最后使用Taraka 荧光定量试剂盒进行q-RT-PCR 扩增,试验重复3 次。

表1 PCR 引物Table 1 PCR primer
PCR 反应体系(20 μL):2×Taq PCR MasterMix 10 μL,DNase/RNase-Free Water 6 μL,上、下游引物(10 μmoL/L)各0.8 μL,ROX 0.4 μL,DNA 模板2 μL。PCR 反应条件:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,40 个循环;95 ℃ 15 s;60 ℃ 1 min;95 ℃ 15 s;60 ℃60 s;95 ℃ 15 s。
1.3 数据处理
每组实验做3 个平行对照,所有实验数据均以平均值±标准误差(SE)的形式表示。使用SPSS 23.0 进行t检验确定所有数据的统计差异,P<0.05的值被认为具有统计学意义。
2 结果与分析
2.1 茶树精油对悬浮菌的抑制作用
茶树精油对悬浮菌具有良好的抗菌效果,本研究测定了茶树精油对MRSA 以及12 株临床分离得到的金黄色葡萄球菌的MIC 值与MBC 值,如表2所示,茶树精油对13 株金黄色葡萄球菌的MIC 值在0.08%~0.32%之间,MBC 值在0.16%~0.32%之间。当一个药物对细菌的MBC/MIC≤4 时被认为是杀菌剂[18]。对于本研究中的大多数菌株来说,茶树精油对其的MBC 值是MIC 值的2 倍,因此,茶树精油对本研究中的细菌具有杀菌作用。

表2 茶树精油对金黄葡萄球菌的MIC 值Table 2 MIC of tea tree oil against Staphylococcus aureus
2.2 茶树精油对MRSA 生物被膜的影响
如图1所示,0.64%和0.32%浓度的茶树精油对MRSA 生物被膜形成的抑制效果最明显,基本没有形成生物被膜;0.16%的茶树精油对MRSA 生物被膜形成的抑制也有显著效果,在24 和48 h 时的抑制率分别达到65.74%±0.97%(P<0.01)和51.35%±2.13%(P<0.01);0.04%和0.02%的茶树精油对MRSA 生物被膜的形成也有一定的抑制效果,24 h 时抑制率分别达到53.44%±0.47%(P<0.01)和41.96%±1.81%(P<0.05)。从图1中可以看出,茶树精油对MRSA 生物被膜的形成有较强的抑制效果,并呈现浓度依赖性。
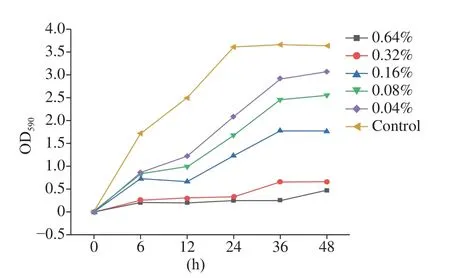
图1 茶树精油对MRSA 生物被膜生长的抑制效果Fig.1 Inhibition effect of tea essential oil on MRSA biofilm growth
2.3 茶树精油对MRSA 成熟生物被膜的清除作用
如图2所示,茶树精油对MRSA 成熟的生物被膜具有极显著的清除作用(P<0.01),与对照组相比,0.02%的茶树精油即可对MRSA 的生物被膜产生一定的清除作用,随着浓度的增高,清除率也逐渐增高,当茶树精油浓度达到0.16%时,清除率达到92.55%±1.15%,接近100%。如图3所示,激光共聚焦显微镜照片也显示出了茶树精油对MRSA 成熟生物被膜的强大的清除作用,随着茶树精油浓度的升高,活细菌逐渐减少,死细菌逐渐增多,生物被膜逐渐稀疏。通常,去除成熟的生物被膜比抑制其形成更加困难。因此,茶树精油可以被认为是一种潜在的抗生物被膜剂,因为它不仅可以抑制生物被膜的形成,而且可以破坏成熟的生物被膜。所以有必要进一步研究茶树精油的抗生物被膜活性并阐明其作用机理。

图2 茶树精油对MRSA 成熟生物被膜的清除作用Fig.2 Clearance of tea tree oil against MRSA mature biofilm
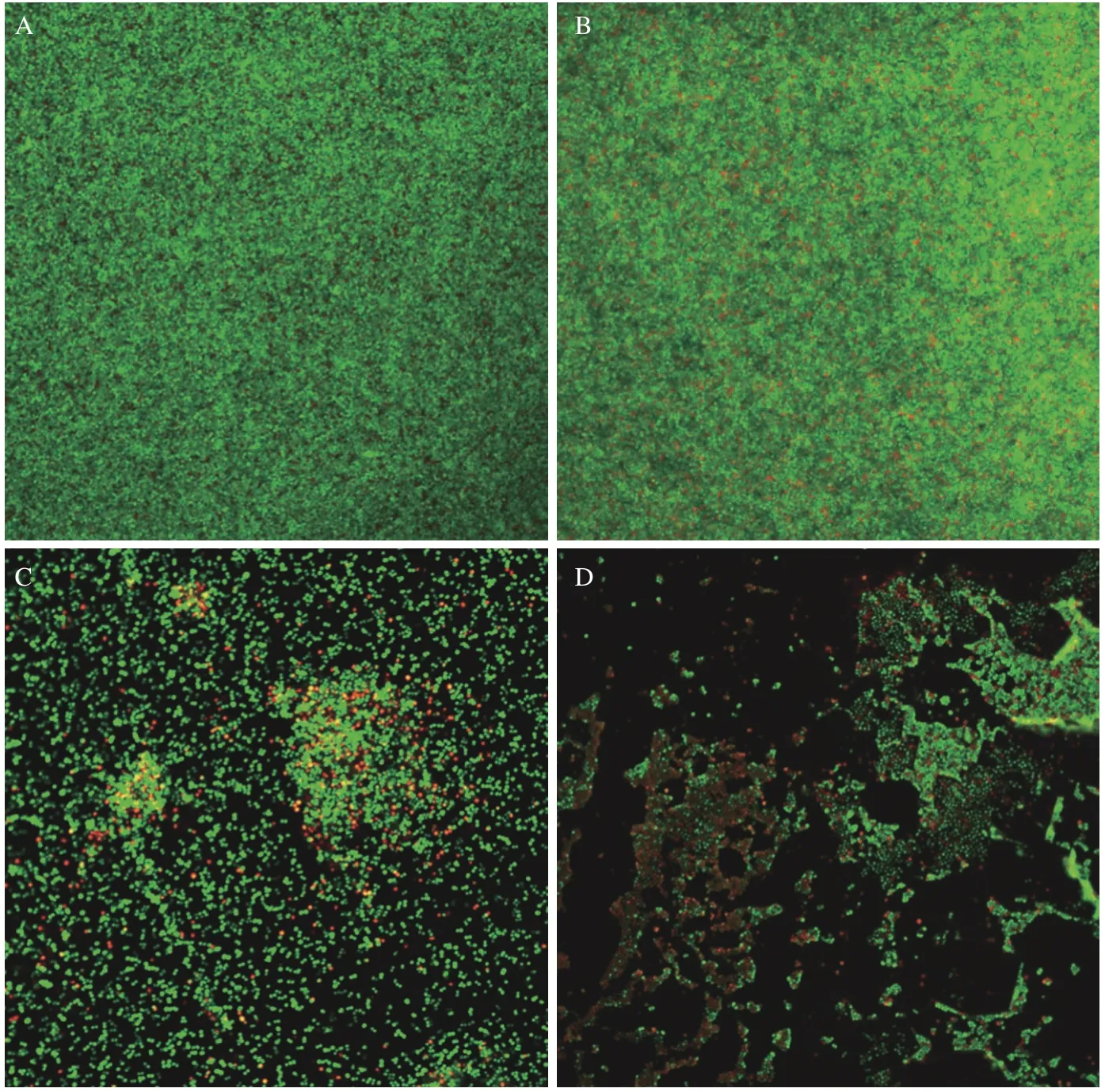
图3 激光共聚焦显微镜细下MRSA 生物被膜图像Fig.3 CLSM image of LIVE/DEAD stained MRSA biofilms grown on cell slide
2.4 茶树精油对MRSA 生物被膜影响的初步机制探究
PIA 对于生物被膜形成的黏附阶段和聚集阶段具有重要的意义[19]。PIA 与刚果红特异性反应变黑,根据平板变黑的程度可以判断PIA 产生量的多少。由图4可知,随着药物浓度的增加,黑色逐渐变浅,表明PIA 的合成量逐渐减少,说明茶树精油可以抑制MRSA 生物被膜中PIA 的合成。
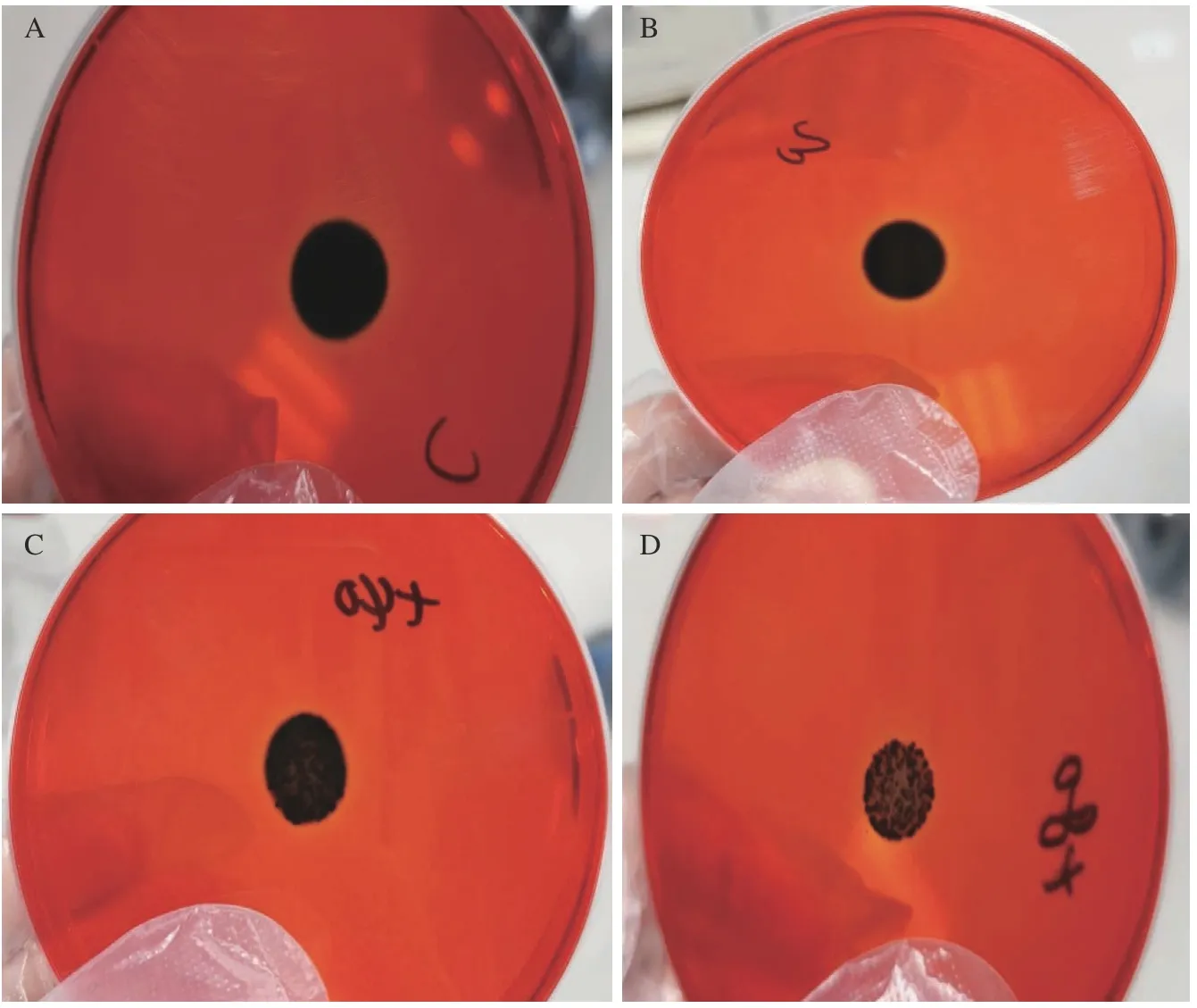
图4 茶树精油对MRSA 生物被膜中PIA 的影响Fig.4 Effect of tea tree oil on PIA in MRSA biofilm
eDNA 是细菌在形成生物被膜过程中部分细菌裂解释放的生物被膜基质(EPS)重要组成成分[20],在生物膜形成的各个阶段都起着至关重要的作用,包括初始细菌粘附、聚集、微菌落形成以及生物膜结构的确认[21]。如图5所示,茶树精油即可对MRSA 生物被膜形成过程eDNA 的释放有一定的抑制效果,在茶树精油浓度为0.16%时,eDNA 的含量减少了91.25%±2.46%(P<0.01)。并且抑制效果呈现浓度依赖性,随着茶树精油浓度的增加,抑制效果也变得更加明显。eDNA 以及PIA 含量的降低说明细菌之间的黏附能力下降,导致其生物被膜的完整性被破坏,表现出抗生物被膜活性。因此,茶树精油可能通过eDNA 的释放以及PIA 的合成抑制MRSA 生物被膜的形成。

图5 茶树精油对eDNA 分泌的影响Fig.5 Influence of tea tree oil effect on the secretion of eDNA
生物被膜形成过程中关键的调控基因有agr、ica、cid、sar等。agr主要调控细菌的群体感应系统,有研究证明agr是细菌群体感应系统(QS)的主要调控分子,对生物被膜的成熟阶段至关重要[22]。ica基因主要调控PIA 的合成,同时也可以调节细菌之间的黏附和聚集[23]。cid主要调控细菌的程序性死亡与溶解,可以间接地参与调控eDNA 的释放[24]。sarA是金黄色葡萄球菌的全局调控因子,主要调控金黄色葡萄球菌毒力基因的表达调控系统;sarA可以和ica操纵子的启动子结合促进ica的表达,进而影响PIA 的合成[25]。采用荧光定量PCR 对茶树精油对MRSA 生物被膜形成过程中这些基因的表达的影响进行研究,使用2−ΔΔt对基因的表达进行相对定量,荧光定量PCR 结果如表3所示。茶树精油作用后的MRSA 细胞内agrA、cidA、sarA、icaA等基因的表达水平均下调,茶树精油对以上4 种基因的表达均有显著的抑制作用,因此,茶树精油可能通过抑制agrA、icaA、cidA 及sarA等基因的表达从而抑制的MRSA 生物被膜中eDNA 的释放以及PIA 的合成,进一步表现出抗MRSA 生物被膜活性。

表3 茶树精油作用后MRSA 部分基因表达量的变化Table 3 Changes in the expression of some genes in MRSA treatment by tea tree essential oil
3 结论
综上所述,茶树精油可以有效杀灭MRSA 的悬浮菌,并具有强大的抗生物被膜作用,结晶紫半定量和激光共聚焦实验说明茶树精油不仅可以抑制生物被膜的形成,也可以有效地清除成熟的生物被膜。其可能的机理是茶树精油通过抑制agrA、icaA、cidA及sarA4 种基因的表达,从而抑制MRSA 细菌生物被膜形成过程中eDNA 的释放以及PIA 的合成,由此降低生物被膜的粘附性,表现出抗生物被膜活性。同时,茶树精油本身也是一种良好的杀菌剂,对脱离了生物被膜的MRSA 细菌也具有强大的杀灭作用。而关于茶树精油如何抑制生物被膜形成相关基因的表达仍需要进一步的深入研究。
