3种食品天然植物包材的抗氧化活性成分对比研究
2021-07-17翟佳敏葛晓峰邱从平
汤 晓,翟佳敏,葛晓峰,邱从平
(宁波职业技术学院化工学院,浙江宁波 315800)
箬叶、芦苇叶、荷叶是我国与其他东南亚国家在食品制作过程中广泛使用的天然包装材料,我国很早就有用芦苇叶、箬叶包粽子的习俗,荷叶饭则是广东等地著名的传统点心,也是东南亚居民喜爱的食物。除了用作食品天然包材,箬叶、芦苇叶、荷叶还可被加工成箬竹酒、芦苇叶啤酒、荷叶茶饮料等食品[1]。
箬叶、芦苇叶、荷叶不仅可赋予食物清香的风味,它们还含有黄酮类化合物、生物活性多糖、萜类内酯、挥发油、生物碱等活性成分[1−5],具有抑制食物中的脂质过氧化物酶等酶活性、延缓食品氧化程度,以及清除各类自由基等抗氧化作用[3−4,6],而黄酮类等抗氧化成分还对细菌(大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌、假单胞菌等)、霉菌及酵母菌等具有较强的抑菌作用[6−8],可延长食品的贮存期,是潜在的食品天然保鲜剂。利用植物提取物制备的天然保鲜剂,近年来因其保鲜效果显著、安全环保、操作简单等优点而备受人们关注,也正成为国内外鱼类、虾类等水产品,以及其他各类食品保鲜中的热点[9−10]。
植物提取物具有可食用性,其在食品贮藏保鲜中的应用研究逐年增加[11]。箬叶、芦苇叶、荷叶不仅是天然的食品包装材料,更是具有悠久的药用历史[12],并且取材广,成本低。已有研究报道了箬叶、芦苇叶、荷叶的活性成分[1−5],但是对于这些植物的抗氧化活性成分的分析对比,以及抗氧化活性成分含量与活性成分结构对抗氧化功能的影响尚缺乏相关探讨。本文研究这3 种用于食品包装材料的天然植物的抗氧化活性成分差异,并分析它们的自由基清除能力、还原能力等抗氧化功能与活性成分的关系,以期为进一步开发这3 种天然植物在鱼类、虾类等水产品保鲜及其他食品保鲜中的应用奠定前期工作基础。
1 材料与方法
1.1 材料与仪器
箬叶 安徽黄山;芦苇叶 江苏骆马湖;荷叶山东微山湖,室温自然干燥;加厚塑料样品袋 16 cm×24 cm,金华华丽包装有限公司;;80 目标准筛 浙江上虞市水仙纱筛厂;甲醇、乙醇、没食子酸、福林酚试剂、碳酸钠、亚硝酸钠、硝酸铝、氢氧化钠、硫酸亚铁、双氧水、水杨酸钠、浓硫酸、磷酸钠、钼酸铵,磷酸氢二钠、磷酸二氢钠、铁氰化钾、三氯乙酸、三氯化铁、三羟甲基氨基甲烷(Tris)、浓盐酸、邻苯三酚、2 ,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)、过硫酸钾 以上试剂为分析纯,国药集团化学试剂有限公司;1,1-二苯基-2-三硝基苯肼(DPPH) (纯度>97%),东京化成工业株式会社;山奈酚-3-O-α-L-芸香苷、槲皮素-3,4'-二-O-葡萄糖苷、芦丁、橙皮苷、木犀草素-6-C-葡萄糖苷、异槲皮苷、槲皮素、芹菜素、木犀草素、咖啡酸标准品 色谱纯(纯度>98%),上海融禾医药科技发展有限公司。
XL-60C 中药粉碎机 广州市旭朗机械设备有限公司;SB-80 超声波清洗机 宁波新芝生物科技股份有限公司;KH30R-II 台式通用高速冷冻离心机广州越特科学仪器有限公司;旋转蒸发仪 上海亚荣生化仪器厂;LGJ-10C 型冷冻干燥机 北京四环科学仪器厂有限公司;UV759 紫外可见分光光度计上海精密科学仪器有限公司;HH-6 恒温水浴锅 金坛市朗博仪器制造有限公司;HY45s 恒温双层摇床
武汉汇诚生物科技有限公司。
1.2 实验方法
1.2.1 样品处理 箬叶、芦苇叶、荷叶分别用粉碎机粉碎,过80 目标准筛。
1.2.2 有效成分提取 称取10 g 干燥的植物粉末,加入80%乙醇,料液比为1:20。分别使用锥形瓶、样品袋作为提取容器,超声提取50 min,超声功率80 W,超声温度45 ℃,提取2 次,合并提取液。4 ℃下离心20 min(转速10000 r/min),收集上清液。旋转蒸发浓缩提取液,再用0.45 μm 的微孔滤膜过滤。冷冻干燥提取液,−20 ℃冰箱保存[13]。
1.2.3 总黄酮含量测定 取一定体积的植物提取液于10 mL 具塞试管中,加10%亚硝酸钠溶液0.3 mL,摇匀,反应6 min,再加10%硝酸铝溶液0.3 mL,反应6 min,最后加4%氢氧化钠溶液4.0 mL,用30%乙醇定容,摇匀,反应10 min 后,测定510 nm 的吸光度值。以不加提取液作为空白对照,以芦丁标准品溶液做标准曲线(0.02~0.10 mg/mL)[14],标准曲线方程为y=13.076x−0.0104(x 为总黄酮含量,y 为吸光度值),R2=0.9926。总黄酮含量以mg/g 干燥粉末进行计算。
1.2.4 总酚含量测定 取0.4 mL 植物提取液于试管中,加2 mL 福林-酚试剂进行氧化,再加1.6 mL 7.5%碳酸钠溶液进行中和,室温下轻轻振荡反应30 min,测定765 nm 的吸光度值[15]。以没食子酸溶液做标准曲线(50~250 μg/mL),标准曲线方程为y=0.0103x+0.0516(x 为总酚含量,y 为吸光度值),R2=0.9903。总酚含量以μg/g 干燥粉末进行计算。
1.2.5 抗氧化活性成分的鉴定 用高效液相色谱法进行检测,进样前,取2 mg 冻干样品,用2 mL 50%乙醇重新溶解,再用0.22 μm 微滤膜过滤[16]。准确称取各标准品60 mg,用甲醇溶解,定容至100 mL,用0.45 μm 微滤膜过滤后,制备成贮备液,制作标准曲线(30~300 μg/mL)。各取1.0 mL 各标准品贮备液,混合,制成混合贮备液[16]。采用ODS C18色谱柱(150 mm×6.0 mm,5 μm);柱温30 ℃;流速1.0 mL/min。按照Crupi[17]的方法进行修改,以已腈为流动相A,以水-甲酸(99:1,v/v)为流动相B。梯度洗脱程序为:0~1 min,5%流动相A-95%流动相B;1~10 min,13%流动相A-87%流动相B;10~20 min,15%流动相A-85%流动相B;20~45 min,22%流动相A-78%流动相B;45~50 min,95%流动相A-5%流动相B;50~51 min;5%流动相A-95%流动相B。检测波长为360 nm。
1.2.6 抗氧化功能的测定
1.2.6.1 ·OH 清除能力 取10 mg 冻干样品,用50%乙醇重新溶解,浓度为1.0 mg/mL,其他抗氧化功能测定用同法制备样品。取1 mL 植物提取液于试管中,加1 mL 1.5 mmol/L 硫酸亚铁溶液,0.7 mL 6 mmol/L 双氧水溶液以及0.3 mL 20 mmol/L 水杨酸钠溶液。在37 ℃下反应1 h,再测定562 nm 的吸光度值[18]。·OH清除能力计算如下式:
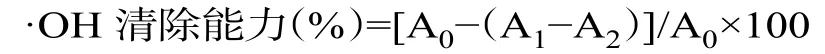
式中,A0为不加提取液的吸光度值,A1为提取液的吸光度值,A2为不加水杨酸钠的吸光度值。
1.2.6.2 O−2·清除能力 取4.5 mL 50 mmol/L Tris-HCl 缓冲液(pH8.2),在25 ℃下保温20 min,分别加入1 mL 提取液、0.4 mL 25 mmol/L 邻苯三酚溶液,混匀,在25 ℃下反应5 min,再加入1 mL 8mmol/L HCl 终止反应,测定299 nm 的吸光度值。O−2·清除能力计算如下式[19]:
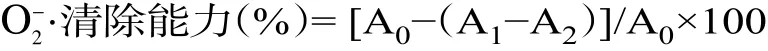
式中,A0为不加提取液的吸光度值,A1为提取液的吸光度值,A2为不加邻苯三酚溶液的吸光度值。
1.2.6.3 DPPH 自由基清除能力 取0.5 mL 提取液于试管中,加4 mL DPPH 甲醇溶液(0.5 mmol/L),在37 ℃下置于暗处剧烈振荡反应30 min,再测定517 nm 的吸光度值,以不加提取液作为空白对照[20]。DPPH 自由基清除率计算如下式:
DPPH 自由基清除率(%)=(1−A植物提取液/A空白)×100
1.2.6.4 ABTS+自由基清除能力 将88 μL 140 mmol/L过硫酸钾、5 mL 7 mmol/L ABTS 混合,制备成ABTS自由基储备液,室温避光条件下静置过夜,在无水乙醇中稀释至吸光度在734 nm 处测量为 0.70±0.02,制备成工作液,将40 μL 提取液加到4 mL ABTS+工作液中,在30 ℃下反应30 min,测定734 nm 的吸光度值。ABTS+自由基清除能力计算如下式[21]:

式中,A0为不加提取液的吸光度值,A1为提取液的吸光度值,A2为不加ABTS+工作液的吸光度值。
1.2.6.5 总抗氧化性 取0.3 mL 提取液于试管中,加3 mL 混合试剂(4 mmol/L 钼酸,28 mmol/L 磷酸钠铵,0.6 mol/L 硫酸),在95 ℃下反应90 min。冷却至25 ℃,测定695 nm 的吸光度值,以不加提取液为空白对照[22]。
1.2.6.6 还原能力 取0.1 mL 提取液,加入2.5 mL 0.2 mol/L 磷酸缓冲液(pH6.6)以及2.5 mL 10 mg/mL铁氰化钾溶液,充分混匀。在50 °C 下反应20 min 后,再加入2.5 mL 100 mg/mL 三氯乙酸溶液,离心10 min(转速3000 r/min)。取上清液,加入2.5 mL 去离子水以及0.5 mL 1.0 mg/mL 三氯化铁溶液,测定700 nm的吸光度值,以不加提取液为空白对照。以吸光度值大小衡量还原能力[23]。
1.2.7 抗氧化功能与活性成分的相关性分析 采用IBM SPSS21.0 进行数据分析,利用Pearson 法进行植物活性成分含量与抗氧化功能的相关性分析[24]。
1.3 数据分析
所有试验均重复三次,结果采用单因素方差分析(ANOVA)。使用 IBM SPSS 21.0 软件进行差异显著性分析,P<0.05 为差异显著。
2 结果与分析
2.1 3 种植物的抗氧化活性成分含量
在超声提取时,分别使用锥形瓶与样品袋,提取箬叶、芦苇叶、荷叶中的抗氧化活性成分,结果如表1所示。由表1可见,使用样品袋提取的3 种植物,其总酚浸出量、总黄酮浸出量与锥形瓶提取相比,均有显著提高(P<0.05),且在使用80%乙醇提取时,所用加厚样品袋在提取时间内并未破损。在使用样品袋提取时,箬叶、芦苇叶、荷叶的总酚浸出量分别提高了63.6%、48.3%、34.4%;箬叶、芦苇叶、荷叶的总黄酮浸出量分别提高了17.6%、43.8%、24.3%。样品袋提取对箬叶总酚、芦苇叶总酚、芦苇叶总黄酮的提取效果的改善较佳,增幅可达40%以上。由于锥形瓶与样品袋相比存在厚度差异,因此可能在一定程度上影响了超声波提取法的机械振动效应与击碎效应对植物细胞的破碎效果。

表1 超声提取容器对抗氧化活性成分浸出量的影响Table 1 Effect of ultrasonic extraction container on leaching amount of antioxidant active components
无论使用哪种提取容器,箬叶中的总酚含量(锥形瓶413.97 μg/g,样品袋677.19 μg/g)低于其他两种植物,存在显著差异(P<0.05),芦苇叶中的总酚含量约为箬叶的10 倍(锥形瓶3845.89 μg/g,样品袋5625.46 μg/g),荷叶中的总酚含量约为箬叶的20 倍(锥形瓶8720.00 μg/g,样品袋11717.78 μg/g)。而芦苇叶总黄酮含量则显著低于另两种植物(P<0.05),荷叶总黄酮含量约为箬叶(锥形瓶15.49 mg/g,样品袋18.21 mg/g)、芦苇叶(锥形瓶9.92 mg/g,样品袋14.97 mg/g)的10 倍(锥形瓶100.11 mg/g,样品袋124.46 mg/g),有显著差异(P<0.05)。
利用超声波辅助提取法提取得到的3 种植物的黄酮类化合物,其含量与潘汇[21]、孙丽芳[25]、乐薇等[26]的研究结果相近,荷叶总酚含量与孙建[27]的研究结果相近。乐薇等[26]的研究显示,提取方法会影响植物总黄酮的抑菌效果,超声波提取法所得黄酮类化合物的抑菌效果最佳,这可能是由于超声波提取的温度较低,对抗氧化活性成分的结构破坏较小。因此,选择超声波辅助提取法提取箬叶、芦苇叶、荷叶中的抗氧化活性成分,以进一步研究这些植物提取物在食品保鲜中的应用。
2.2 3 种植物的抗氧化活性成分组成
各标准品的标准曲线方程如表2所示。x 为组分含量,y 为吸光度值。
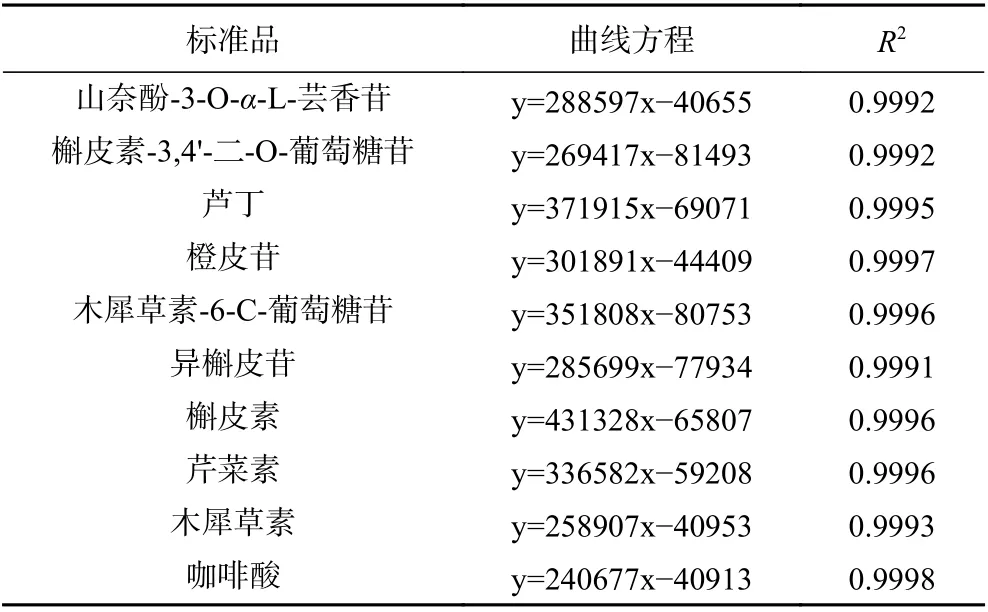
表2 HPLC 标准曲线Table 2 Standard curves of HPLC
标准品混合物的HPLC 图谱如图1所示,依次为咖啡酸、山奈酚-3-O-α-L-芸香苷、槲皮素-3,4'-二-O-葡萄糖苷、芦丁、橙皮苷、木犀草素-6-C-葡萄糖苷、异槲皮苷、木犀草素、槲皮素、芹菜素。
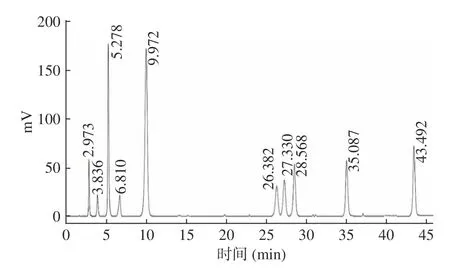
图1 标准品HPLC 图谱Fig.1 HPLC spectrum of the standards
箬叶、芦苇叶、荷叶的抗氧化活性成分组成分析如图2所示,各组分含量如表3所示。由图2可见,箬叶、芦苇叶、荷叶提取物中含有咖啡酸、山奈酚-3-O-α-L-芸香苷、槲皮素-3,4'-二-O-葡萄糖苷、芦丁、橙皮苷、木犀草素-6-C-葡萄糖苷、异槲皮苷、木犀草素、槲皮素、芹菜素等多酚类化合物。由表3可见,箬叶提取物中含量最高的三种黄酮类化合物依次为异槲皮苷、山奈酚-3-O-α-L-芸香苷、芦丁,芦苇叶提取物中含量最高的三种黄酮类化合物依次为橙皮苷、异槲皮苷、木犀草素-6-C-葡萄糖苷。荷叶提取物中的黄酮类化合物与箬叶、芦苇叶有所差异,荷叶提取物中未检测到异槲皮苷,芦苇叶中未检测到木犀草素,箬叶、芦苇叶提取物中未检测到槲皮素-3,4'-二-O-葡萄糖苷。荷叶提取物中含量最高的三种黄酮类化合物依次为芹菜素、木犀草素-6-C-葡萄糖苷、木犀草素。由此可见,异槲皮苷是箬叶、芦苇叶中含量较高的多酚类化合物,木犀草素-6-C-葡萄糖苷是芦苇叶、荷叶中含量较高的多酚类化合物。
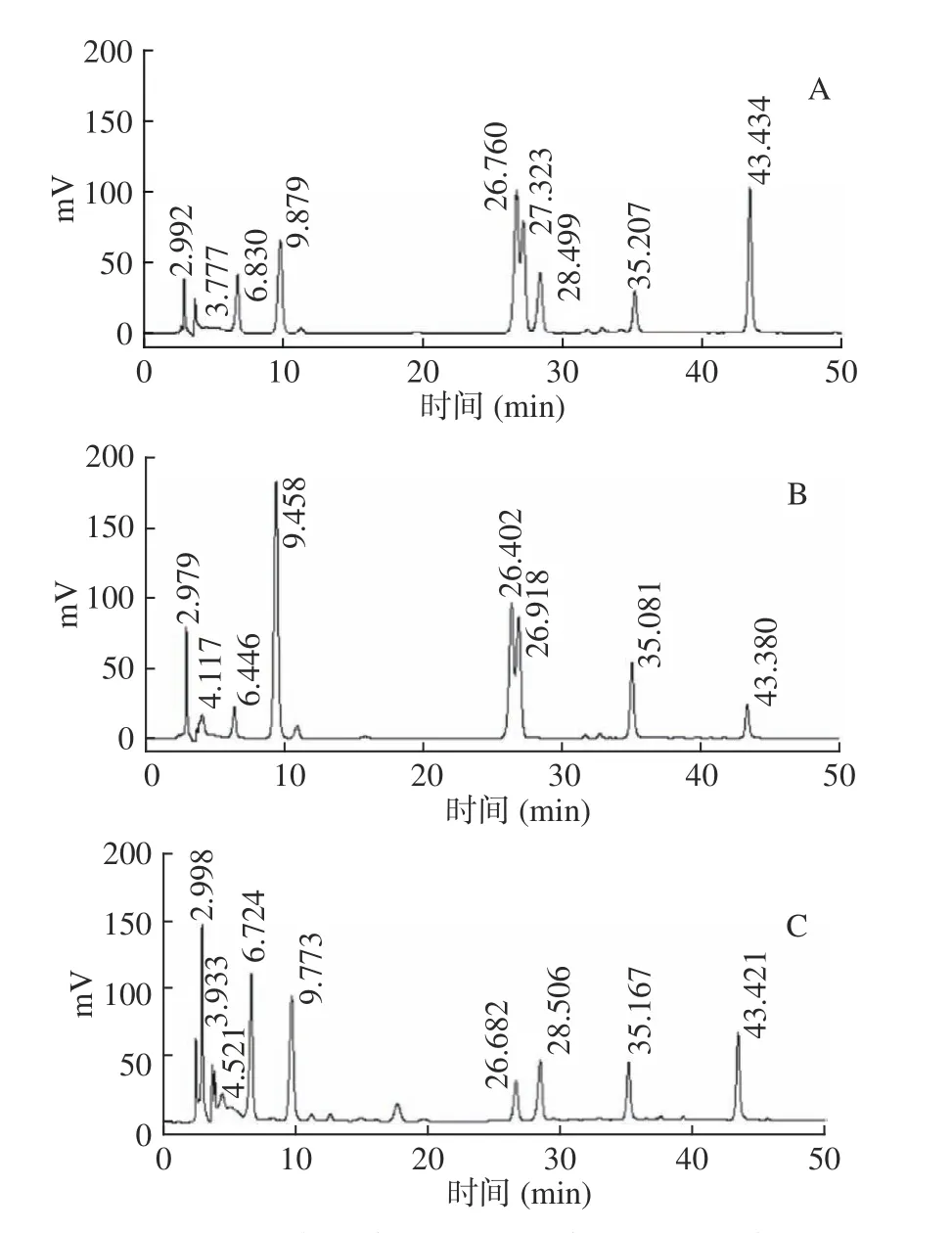
图2 3 种植物抗氧化活性成分的HPLC 分析Fig.2 HPLC analysis of antioxidant components of three plants
箬叶中含有的咖啡酸、木犀草素-6-C-葡萄糖苷、异槲皮苷等成分与李胜华等[28]的研究结果一致,异槲皮苷是箬叶中含量最高的成分(表3)。芦苇叶中含有的芦丁、橙皮苷、槲皮素、芹菜素等成分与孙丽芳等[29]的研究结果一致。橙皮苷是芦苇叶中含量最高的成分(表3),但孙丽芳等[29]的研究显示,芦苇叶中芹菜素的含量最高。这些抗氧化活性成分的差异,可能与植物产地、测定色谱条件等因素有关。荷叶中芹菜素的含量最高,但槲皮素并不是荷叶中的主要成分(表3),这与梁佳文等[30]的研究结果并不一致,可能是由于随着荷叶的生长发育,产生了槲皮素-3,4'-二-O-葡萄糖苷等槲皮素的衍生物,这些黄酮苷类在夏季可帮助植物抵御紫外线的侵袭。黄酮类等多酚类化合物由于具有弱酸性,能够使蛋白质凝固或者变性,因此具有抑菌、杀菌的效果,能抑制食物中的致病菌、致腐菌。对箬叶、芦苇叶、荷叶中的黄酮类化合物等活性成分的分析与比较,探索不同黄酮类成分的抑菌效果以进一步优化这些植物作为食品天然保鲜剂的使用浓度。

表3 3 种植物抗氧化活性成分的定量分析 (μg/mL)Table 3 Antioxidant components contents in three plants(μg/mL)
2.3 3 种植物的抗氧化功能
箬叶、芦苇叶、荷叶的·OH 清除率如图3所示。由图3可见,箬叶、芦苇叶、荷叶提取物均具有较强的·OH 清除能力。芦苇叶、荷叶提取物的·OH清除率分别为87.12%、90.18%,箬叶提取物的·OH清除率不及芦苇叶、荷叶,但亦有70%以上。
箬叶、芦苇叶、荷叶的 O−2·清除率如图4所示。由图4可见,箬叶、芦苇叶、荷叶提取物O−2·清除率均在60%以上。荷叶、芦苇叶提取物的O−2·清除率高于箬叶提取物,达到75%以上,这两种植物的O−2·清除率差异并不显著。
箬叶、芦苇叶、荷叶提取物的DPPH 自由基清除能力如图5所示。由图5可见,箬叶、芦苇叶、荷叶提取物的DPPH 自由基清除能力不及·OH 清除能力(图4)。与其他两种植物相比,箬叶提取物的DPPH 自由基清除能力最低(16.32%),芦苇叶、荷叶提取物的DPPH 自由基清除能力相近,分别为29.37%、31.91%,约是箬叶的两倍。
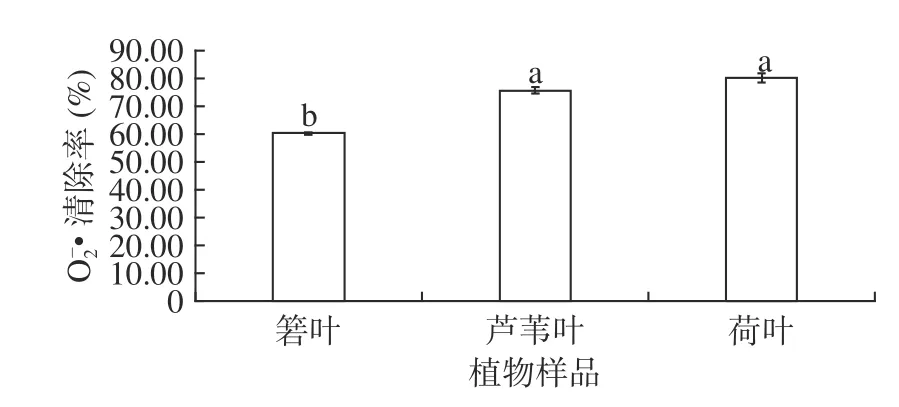
图4 3 种植物的 O−2·清除率Fig.4 O−2·scavenging activity of three plants
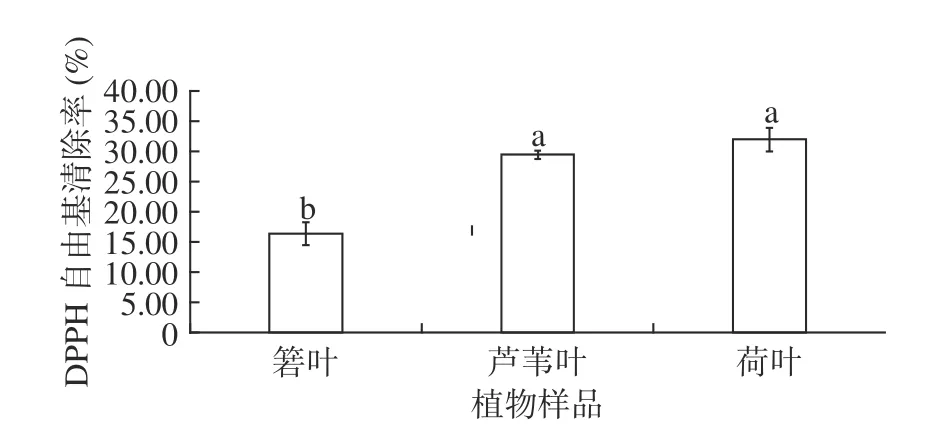
图5 3 种植物的DPPH 自由基清除率Fig.5 DPPH·scavenging activity of three plants
箬叶、芦苇叶、荷叶的ABTS+自由基清除能力如图6所示。由图6可见,箬叶、芦苇叶、荷叶提取物的ABTS+自由基清除率高于DPPH 自由基清除率。荷叶提取物的ABTS+自由基清除率最高,达62.37%,箬叶提取物的ABTS+自由基清除率亦有51.79%。
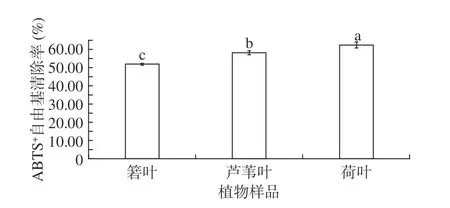
图6 3 种植物的ABTS+自由基清除率Fig.6 ABTS+·scavenging activity of three plants
箬叶、芦苇叶、荷叶提取物的总抗氧化性如图7所示。由图7可见,箬叶、芦苇叶提取物的总抗氧化性相近,吸光度值在0.6 左右。与箬叶、芦苇叶相比,荷叶提取物呈现了较高的总抗氧化性,吸光度值约为箬叶、芦苇叶的两倍。荷叶提取物的总抗氧化性显著高于另两种植物(P<0.05)。
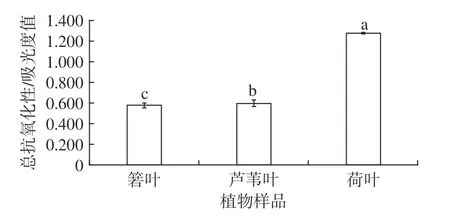
图7 3 种植物的总抗氧化性Fig.7 Total antioxidant activity of three plants
箬叶、芦苇叶、荷叶提取物的还原能力如图8所示。由图8可见,箬叶、芦苇叶、荷叶提取物的还原能力依次增强,芦苇叶提取物的还原能力略高于箬叶。与总抗氧化性的结果相似,荷叶提取物的还原能力与箬叶、芦苇叶相比有较大提升,吸光度值约为箬叶、芦苇叶的2~3 倍。荷叶提取物的还原能力显著高于另两种植物(P<0.05)。
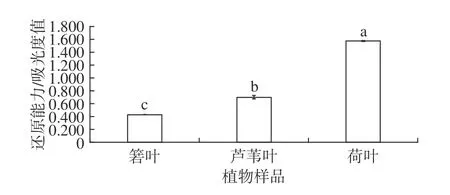
图8 3 种植物的还原能力Fig.8 Reducing activity of three plants
箬叶、芦苇叶、荷叶提取物具有较强的多种自由基清除能力、还原能力及总抗氧化性。荷叶提取物的·OH 清除能力、O−2·清除能力、DPPH 自由基清除能力、ABTS+自由基清除能力、还原能力、总抗氧化性均高于另两种植物,且其·OH 清除能力、ABTS+自由基清除能力、还原能力、总抗氧化性与箬叶、芦苇叶相比具有显著差异(P<0.05)。3 种植物提取物的·OH 清除能力、O−2·清除能力与乐薇[4]、李瑞光[19]、潘汇[21]、孙建等[27]的研究结果一致,但其DPPH自由基清除能力、ABTS+自由基清除能力低于乐薇[4]、李瑞光[19]、伍仪权等[31]的研究,总抗氧化性则高于孙丽芳[25]的结果。
2.4 抗氧化能力与活性成分的相关性
3 种植物的抗氧化功能与活性成分之间的相关性如表4所示。箬叶、芦苇叶、荷叶的总酚含量与·OH 清除能力、O−2·清除能力、DPPH 自由基清除能力、ABTS+自由基清除能力、总抗氧化性、还原能力存在极显著相关性(P<0.01);总黄酮含量与总抗氧化性、还原能力存在极显著相关性(P<0.01),与ABTS+自由基清除能力存在显著相关性(P<0.05),但与·OH 清除能力O−2·清除能力、DPPH 自由基清除能力的相关性不强,这表明植物中的总酚、总黄酮含量可在较大程度上影响它们的抗氧化功能。

表4 抗氧化功能与活性成分的相关性Table 4 Correlation between antioxidant function and antioxidant components
异槲皮苷、木犀草素-6-C-葡萄糖苷是3 种植物中含量较高的成分(表3),这两种黄酮类化合物的结构中都具有4-羰基、2,3-双键以及 B 环邻二羟基。这些结构是决定黄酮类物质抗氧化功能的重要因素,尤其是B 环上的邻二羟基[32]。此外,3 种植物中含量较高的芹菜素、槲皮素、芦丁等活性成分也含有一部分上述结构,因此,这3 种植物的提取液表现出了较好的·OH 清除能力、O−2·清除能力、ABTS+自由基清除能力、还原能力与总抗氧化性。由于槲皮素、异槲皮苷等含有较多B 环上羟基的黄酮类化合物混合时,较易发生拮抗作用[33],因此,推测3 种植物的DPPH 自由基清除能力较低可能与其所含黄酮类物质之间的拮抗作用有关。箬叶、芦苇叶、荷叶的天然抗氧化活性,可延缓水产品等食品的氧化进程,起到延长保鲜期的效果。由于抗氧化活性成分的纯度及其使用浓度均会影响食品的保鲜效果[22],因此,需进一步分离纯化这3 种植物的活性成分,并优化这些成分作为天然抗氧化剂的使用剂量。
3 讨论与结论
箬叶、芦苇叶、荷叶是常用于食品制作、烹饪中的天然包装材料,它们含有多酚、黄酮类化合物等抗氧化活性成分。在超声提取时,以加厚样品袋为提取容器,可提高这些抗氧化活性成分的浸出量。在相同色谱条件下,从箬叶、芦苇叶、荷叶中分离出10 种多酚类抗氧化活性成分,主要为黄酮类化合物。3 种植物的乙醇超声提取物具有较好的·OH、O−2·、ABTS+自由基等多种自由基清除能力、还原能力及总抗氧化性,这些抗氧化功能与植物中的总酚、总黄酮含量之间呈现一定的相关性,表明植物中的总酚、总黄酮含量可影响它们的抗氧化功能。荷叶中的总酚、总黄酮含量高于箬叶、芦苇叶,且其抗氧化功能最佳。异槲皮苷是箬叶、芦苇叶中含量较高的多酚类化合物,木犀草素-6-C-葡萄糖苷是芦苇叶、荷叶中含量较高的多酚类化合物,具有4-羰基、2,3-双键、B 环邻二羟基等结构,具备这些结构的黄酮等多酚类物质可能是影响箬叶、芦苇叶、荷叶抗氧化功能的重要因素。
