马铃薯优良杂种株系细胞遗传学特性及SRAP分析
2021-07-17李景伟于肖夏李佳奇卢倩倩吴国芳
李景伟,于 卓,于肖夏,李佳奇,卢倩倩,吴国芳,李 靓
(内蒙古农业大学农学院,内蒙古 呼和浩特 010019)
马铃薯是世界上重要的粮食作物[1-2],其块茎中含有丰富的淀粉、维生素、膳食纤维、矿物质、蛋白质和花青素等营养成分,可满足人体需要的各种营养需求[3-5].近年来,我国逐渐意识到马铃薯在粮食安全、国民经济、生态安全等方面的重要作用,于2016年由国务院批准实施马铃薯主粮化战略[6].在国家政策的引导下,我国马铃薯种植面积及其总产量明显增加.但与美国、荷兰、加拿大等马铃薯产业链发展良好的国家相比,我国多以鲜食型马铃薯品种为主,而淀粉、全粉、薯条薯片等加工专用型马铃薯新品种严重缺乏,远不能满足当前消费市场的需求[7].随着马铃薯产业的快速发展,亟待引进和拓宽加工专用型的马铃薯的种质资源,并在确保育成品种优质、高产、抗逆性强等优点的前提下,需充分改良现有品种的加工品质特性,提高其加工原料的品质.因此,开展优良加工专用型马铃薯新品种的选育研究工作十分必要.
SRAP(Sequence related amplified polymorphism)序列相关扩增多态性标记,是一种可直接进行PCR扩增且无须特定序列信息的新型分子标记,因其具有重复性和通用性好、多态性丰富、操作简单且成本低等特点,已被广泛应用在多种作物的遗传图谱构建、遗传多样性分析、种质资源研究等领域[8].
为培育出优质高产、抗逆性强、商品性好、生育期较短,适宜内蒙古地区推广种植的优良加工专用型马铃薯新品种,近年来本课题组以双亲遗传差异大、优缺点互补为亲本选配原则,用抗病性弱但块茎产量和商品薯率高、薯型好、芽眼浅、红皮白肉的‘美红-09’(MH-09)材料作母本,以抗病性强、高干物质和高淀粉含量、深红皮红肉的‘MIN-21’材料为父本,通过人工套袋去雄授粉杂交获得2 604个杂种F1代分离单株群体.经在温室和大田对杂种后代进行多次选择,从中选出了综合农艺性状表现突出的8个优良杂种株系:ZX-20、ZX-460、ZX-780、ZX-900、ZX-1120、ZX-1540、ZX-1960和ZX-2200.
本试验以这8个优良杂种株系及其亲本为材料,采用醋酸洋红花粉粒染色及卡宝品红染色体压片法,分别对其花粉育性及花粉母细胞减数分裂中期I(PMIM I)的染色体配对行为进行了观察分析,并对其基因组DNA进行了SRAP分析,以明确各杂种株系间花粉育性情况、染色体配对构型特征和DNA水平的遗传差异,以为下一步马铃薯新品系(品种)的育成、登记应用提供分子细胞学依据.
1 材料和方法
1.1 试验材料
供试材料为从马铃薯杂交组合‘MH-09×MIN-21’的杂种F1代群体中选育出的8个优良杂种无性株系ZX-20、ZX-460、ZX-780、ZX-900、ZX-1120、ZX-1540、ZX-1960和ZX-2200及其亲本.种薯级别为原种,由内蒙古农业大学马铃薯育种研究所保存、提供.各供试材料的块茎表型特征如图1所示.

a:ZX-20,b:ZX-460,c:ZX-780,d:ZX-900,e:ZX-1120,f:ZX-1540,g:ZX-1960,h:ZX-2200,i:♀MH-09,j:♂MIN-21
1.2 试验地概况及田间管理方法
2018年5月6日,将各供试材料种植在呼和浩特市托克托县古城镇马铃薯试验研究基地.试验区的地理位置为东经111°45′、北纬40°57′,海拔约1 061 m.试验区年平均降雨量为336.2~535.7 mm,无霜期约145 d,生育期日照时间约1 600 h;土壤为沙壤质土,肥力中等,pH呈弱碱性,具备良好的喷灌条件.各材料按随机区组排列设计,采用单垄穴播方式种植,株距30 cm,行距90 cm,播种深度10 cm左右,小区面积20 m2,设3次重复.播种前用完全腐熟的牛粪(2.25 kg/m2)作为基肥,马铃薯复合肥(0.07 kg/m2)作种肥.在生育期内适当追施氮肥(0.05 kg/m2),分3次施入.在株高约15 cm时,进行中耕培土.在整个生育期,注意防除病虫和杂草的危害,适时灌水满足植株生长发育对水分的需求.
1.3 花粉育性的观测
在开花期,取8个优良杂种株系及其亲本材料正在开放的花蕾,分别放在羊皮纸袋内带回实验室.用镊子将花粉均匀地抖落在载玻片上,醋酸洋红染液均匀染色后加盖玻片,用Olympus BX51的显微镜10倍下观察各材料的花粉育性情况.每个材料观察100个视野以上,统计出可育花粉与不可育花粉的数目并拍照[9].观察的标准为:花粉粒饱满、均匀着色的记为可育花粉粒,花粉粒空瘪、皱缩扁小畸形、不着色的记为不可育花粉[10].
花粉可育率=(可育花粉粒数/花粉粒统计总数)×100%.
1.4 PMCMⅠ染色体配对构型观测
马铃薯现蕾期间,在上午的8:00—10:00,随机取各杂种株系及其亲本的幼小花蕾(0.2 cm),将鲜样迅速放入装有卡诺液(V无水乙醇∶V冰醋酸=3∶1)的具塞试管中带回室内,置4℃冰箱内固定约24 h后,用清水冲掉卡诺液及杂质,加入70%的酒精于4℃冰箱内保存、备用[11].制片时,将花粉母细胞挤压到干净的载玻片上,去除花药壁,滴加卡宝品红染液染色约10 s后压片.用Olympus显微镜于100倍油镜下观察供试材料的染色体配对行为,挑选染色均匀、清晰稳定的细胞染色体进行照相,并统计染色体数目[12-13],每个材料观察细胞数在140个以上,参照李懋学等[14]提出的方法对各杂种株系的染色体构型进行观察统计.
1.5 供试材料的DNA提取与纯度检测
在苗期随机取各材料的幼嫩叶片,按照北京天根公司生产的DNA试剂盒说明书提取其基因组DNA.取2 μL 样本DNA溶液,用1.3%琼脂糖凝胶电泳检测其纯度后,稀释至50 ng/μL,置-40℃冰柜中保存、备用.
1.6 SRAP-PCR扩增体系及程序
PCR反应体系:总体积为20 μL,其中包含上、下游引物(0.5 μmol/L)各1.2 μL,2.5 μL的10×PCR buffer(含Mg2+),2.5 μL模板DNA(50 ng/μL),1.6 μL dNTPs(0.225 mmol/L),0.2 μL Taq DNA聚合酶(5 U)和10.8 μL ddH2O.实验所用的生化试剂均购自北京全式金生物工程有限公司.
PCR扩增程序:94℃预变性5 min;94℃变性1 min,35℃退火1 min,72℃延伸1 min,5个循环;94℃变性,50℃退火,72℃延伸1 min,40个循环;72℃延伸10 min后,将扩增产物置于4℃冰箱内低温保存.PCR反应在Bio-Rad Mycycler Thermal Cycler基因扩增仪上进行[15].
1.7 SRAP适宜引物的筛选
从Li等[16]、Pezzotti等[17]和Lin等[18]报道的SRAP引物中,随机选取正向12条、反向12条引物,自由组合成144对引物,委托南京金斯瑞生物科技有限公司进行合成.通过预实验从中筛选出10对多态性丰富、条带位点稳定、清晰的SRAP特异性引物(见表1),用于8个马铃薯优良杂种株系及其亲本遗传差异的SRAP分析.

表1 筛选出的SRAP适宜引物及其碱基序列
1.8 扩增产物的电泳检测及SRAP多态性位点条带
用6%的聚丙烯酰胺凝胶电泳对供试材料基因组DNA 的PCR扩增产物进行检测.依据Nei[19]提出的方法,统计各引物扩增出的SRAP等位基因多态性位点条带和总位点条带,计算出多态性位点条带百分率(Percentage of polymorphic bands,P).P=(M/N)×100%,式中:M为扩增出的多态性位点条带数,N为扩增出的总位点条带数.
1.9 数据的整理分析
用EXCEL2010和SPSS(Statistical product and service solutions)22.0软件对各杂种株系的花粉可育率观测数据进行差异显著性分析.采用DPS(Data processing system)V7.05软件进行SRAP遗传距离的聚类分析
2 结果与分析
2.1 马铃薯优良杂种株系间花粉育性的差异
8个优良杂种株系及其亲本的花粉育性观测结果见图2、表2.亲本间的花粉可育率在60%左右,二者差异不明显,各株系间的花粉可育率存在一定差异.株系ZX-900的花粉可育率最高,为77.3%;株系ZX-1120、ZX-460和ZX-20的花粉可育率相近,在68.0%~71.8%之间,三者差异不显著,但与亲本存在显著差异;株系ZX-780和ZX-2200分别为61.3%和64.4%,二者差异不显著,且与其双亲差异显著;株系ZX-1960和ZX-1540的花粉可育率均较低,分别为55.4%和48.1%,差异显著.以上结果表明,除株系ZX-1540外,其余7个杂种株系的花粉育性均超过50%,可作父本材料进一步用于杂交改良.
2.2 杂种株系间的PMCMⅠ染色体配对行为
各杂种株系及其亲本的染色体构型如表2和图3所示.母本‘MH-09’的染色体构型为2n=4x=48=5.38Ⅰ+8.98Ⅱ+4.63Ⅲ+2.69Ⅳ,父本‘MIN-21’的染色体构型为2n=4x=48=2.80Ⅰ+9.35Ⅱ+4.51Ⅲ+3.23Ⅳ.各株系间的单价体频率变幅在1.13~8.44之间,二价体频率变幅在7.08~15.54之间,三价体频率变幅在1.04~6.76之间,四价体频率变幅在1.33~5.09之间.8个杂种株系ZX-20、ZX-460、ZX-780、ZX-900、ZX-1120、ZX-1540、ZX-1960和ZX-2200的染色体构型有一定差别,依次分别为:2n=4x=48=3.82Ⅰ+13.05Ⅱ+2.31Ⅲ+2.79Ⅳ,2n=4x=48=6.52Ⅰ+13.04Ⅱ+2.24Ⅲ+2.17Ⅳ,2n=4x=48=4.37Ⅰ+9.97Ⅱ+3.19Ⅲ+3.53Ⅳ,2n=4x=48=4.05Ⅰ+15.54Ⅱ+2.12Ⅲ+1.63Ⅳ,2n=4x=48=2.71Ⅰ+13.85Ⅱ+2.35Ⅲ+2.64Ⅳ,2n=4x=48=8.44Ⅰ+7.08Ⅱ+5.92Ⅲ+1.91Ⅳ,2n=4x=48=5.20Ⅰ+8.61Ⅱ+6.76Ⅲ+1.33Ⅳ和2n=4x=48=1.13Ⅰ+11.69Ⅱ+1.04Ⅲ+5.09Ⅳ.
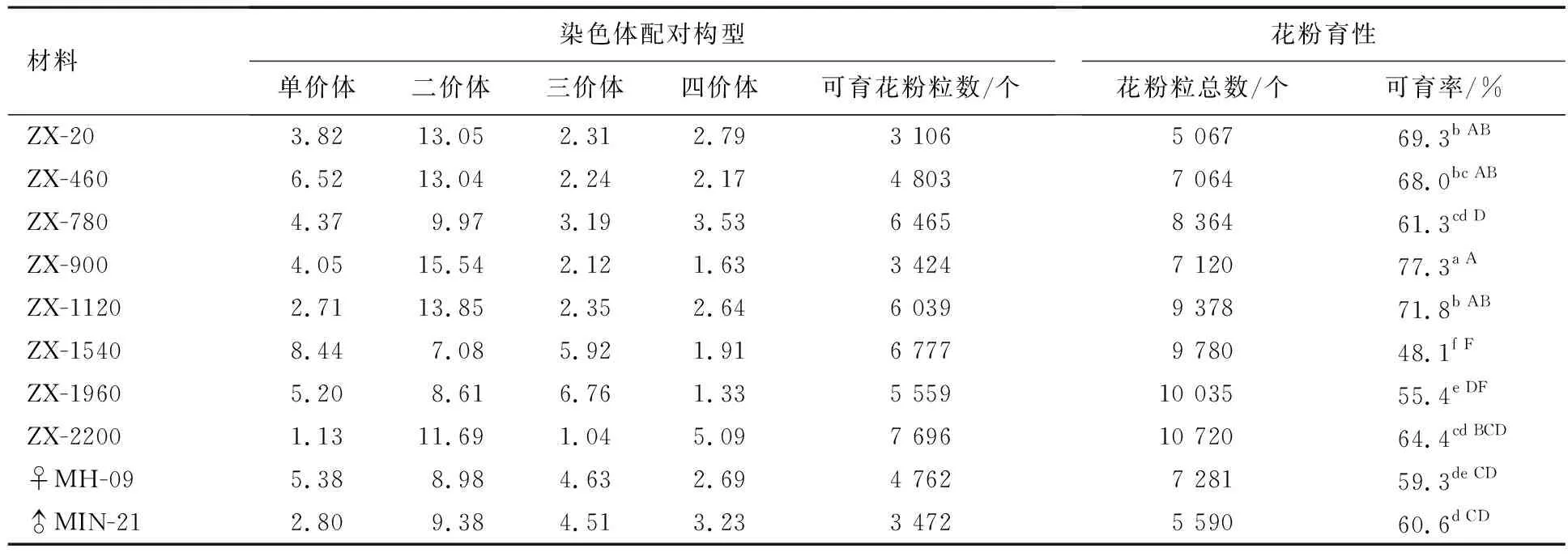
表2 8个优良杂种株系及其亲本的花粉育性
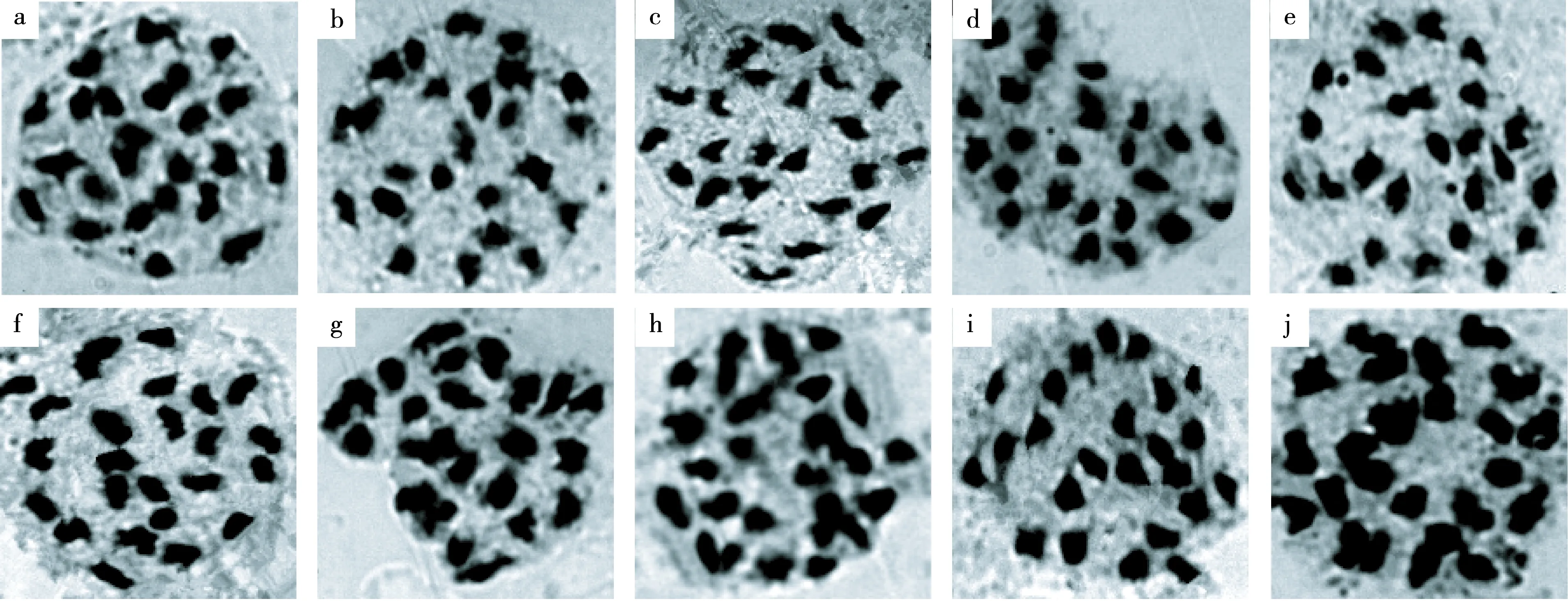
a:ZX-20,b:ZX-460,c:ZX-780,d:ZX-900,e:ZX-1120,f:ZX-1540,g:ZX-1960,h:ZX-2200,i:♀MH-09,j:♂MIN-21
2.3 优良杂种株系及亲本基因组DNA的SRAP分析
8个马铃薯杂种株系及其亲本的基因组DNA电泳条带明亮、稳定、均匀,无弥散现象产生,表明所提取的各材料DNA纯度很高,完全可满足SRAP分子标记电泳分析的质量要求.用筛选出的10对SRAP适宜引物,对8个杂种株系及其亲本基因组DNA的扩增结果显示,共有180个清晰稳定的SRAP位点条带,其中多态性位点条带122个,多态性平均比率为65.92%,表明各材料间在DNA水平上有明显的遗传差异(见表3、图4A).
实验还选出1对特异性SRAP引物M5BE7,经扩增建立的指纹图(见图4B)可清晰地将各杂种株系间及亲本区分开来.这表明SRAP引物M5BE7可从DNA分子水平上识别8个杂种株系的遗传差异,可为下一步杂种新品系及品种的育成、登记提供了分子依据.

表3 8个优良杂种株系及其亲本的SRAP扩增结果

A:DNA纯度检测;B:引物M5BE7扩增指纹.M1:DNA Marker DL100;M2:DNA Marker DL2000
2.4 杂种株系及亲本的遗传距离和聚类分析
由表4可见,10个材料的遗传距离(GD)变动在0.290~0.640之间,平均距离为0.442.其中株系ZX-1540与父本‘MIN-21’的遗传距离最大(GD值=0.640),说明二者的遗传差异较大.株系ZX-780与父本‘MIN-21’的遗传距离最小(GD值=0.290),其遗传差异相对较小.
以GD值0.40为基准,可将10个材料划分为5类:株系ZX-20、ZX-1960与母本‘MH-09’为一类,说明ZX-20、ZX-1960偏母本遗传;株系ZX-780、ZX-1120、ZX-2200与父本‘MIN-21’分为一类,这3个杂种株系偏父本遗传;株系ZX-460、ZX-900、ZX-1540单独为一类,表明这3个杂种株系间遗传差异相对较小(见图5)
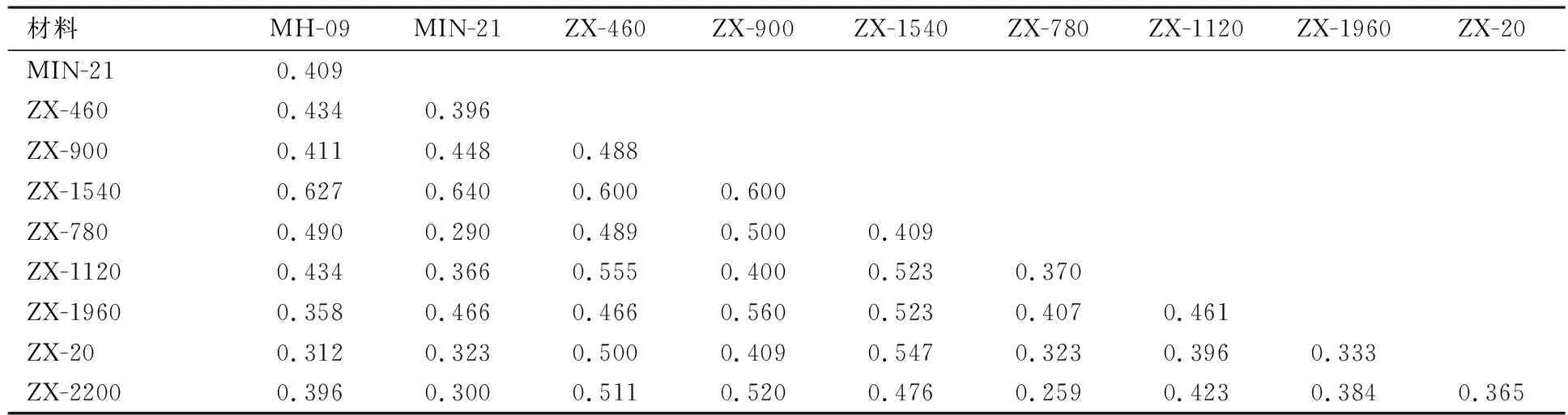
表4 各株系及其亲本的遗传距离矩阵
3 讨论
3.1 染色体配对行为与花粉育性的关系

图5 10个供试材料的SRAP聚类
染色体是DNA遗传物质的载体,观测杂种材料的染色体配对行为是从细胞学水平上了解不同植物材料遗传差异的基础,而明确杂种材料花粉育性的高低对其后续杂交改良、利用具有理论指导意义,染色体的正常分离是花粉可育的基础[20].染色体的配对行为是由多个基因精准调控的,任何基因的变异均会导致减数分裂异常,致使花粉败育,染色体联会时发生的不均等分离也会导致花粉不育.已有的研究表明,植物的染色体构型中二价体频率较高时,其花粉可育率较高,若单价体和多价体的频率较高,花粉可育率则较低[21].其原因是二价体频率高可使同源染色体正常联会,花粉育性高;而单价体和多价体频率高会引起联会的同源染色体分离不均衡,染色体配对异常,致使花粉育性降低[22].
本试验对8个马铃薯杂种株系的染色体构型进行的观测表明,株系ZX-900和ZX-1120的花粉可育率较高(分别为77.3%和71.8%),其二价体频率亦较高(分别为15.54和13.85),而单价体和多价体频率相对较低(分别为4.05和2.71);ZX-1540和ZX-1960的花粉可育率最低(分别为48.1%和55.4%),其二价体频率亦最低(分别为7.08和8.61),而单价体和多价体频率较高(分别为8.44和5.20).这表明不同杂种株系花粉可育率的高低与其二价体频率的高低呈正相关,与单价体及多价体频率呈负相关,这与已有的研究结果相吻合,可为后续8个优良杂种株系作为中间材料进一步杂交改良利用,提供可靠的细胞遗传学依据.
3.2 分子标记的有效性
分子标记是作物遗传育种研究的重要辅助工具,可明显缩短育种进程,因其是建立在基因组DNA水平上的一类新型技术,是植物基因的直接表现,且可排除环境因素的影响,因此备受育种者的重视.McGregor等[23]利用SSR标记对39个南美当地马铃薯栽培品种进行了分析,4对SSR引物有效区分了其中的24个材料;Norero等[24]利用SSR标记对来自德国等12个国家的37个马铃薯品种进行了分子鉴定,用3对引物可将其中的36个品种区分开来.与SSR标记相比,SRAP标记技术具有多态性位点多、引物通用性强、引物组合可以随机排列形成许多新的引物对、成本较低廉且操作简单等优势,故近几年来其应用研究较多.例如,张建成等[25]对10个国内花生栽培种的SRAP标记研究表明,SRAP标记技术可以很好地体现出花生栽培种的遗传差异性;程永芳等[26]利用SRAP标记技术对54份马铃薯种质资源的遗传多样性进行了分析,并对50个杂种F1单株进行了分子鉴定,证明马铃薯品种间具有丰富的遗传多样性且遗传差异较大.本试验利用自由组合成的144对SARP引物筛选出的10对适宜引物,对8个马铃薯优良杂种株系及亲本材料的基因组DNA进行PCR扩增,获得122个SRAP多态性位点条带,其多态性比率达65.92%,表明各供试材料间具有较大的遗传差异,可为后续杂种株系作为中间材料再利用及马铃薯新品系的培育提供分子依据.实验还利用筛选出的1对SRAP特异性引物M5BE7,经PCR扩增建立了能很好识别各优良杂种株系及亲本的SRAP指纹图.这也表明SRAP分子标记技术用于马铃薯杂种株系的鉴定是可靠的,可为下一步新品种的育成登记奠定基础.
4 结论
(1) 8个马铃薯优良杂种株系的花粉可育率变幅为48.1%~77.3%,株系间花粉育性存在一定差异.株系ZX-1540的花粉育性最低(<50%),适宜作母本中间材料杂交改良利用;其余7个株系的花粉育性均在55%以上,可作父本材料改良利用.
(2) 8个杂种株系ZX-20、ZX-460、ZX-780、ZX-900、ZX-1120、ZX-1540、ZX-1960和ZX-2200的染色体配对构型,依次分别为:3.82Ⅰ+13.05Ⅱ+2.31Ⅲ+2.79Ⅳ,6.52Ⅰ+13.04Ⅱ+2.24Ⅲ+2.17Ⅳ,4.37Ⅰ+9.97Ⅱ+3.19Ⅲ+3.53Ⅳ,4.05Ⅰ+15.54Ⅱ+2.12Ⅲ+1.63Ⅳ,2.71Ⅰ+13.85Ⅱ+2.35Ⅲ+2.64Ⅳ,8.44Ⅰ+7.08Ⅱ+5.92Ⅲ+1.91Ⅳ,5.20Ⅰ+8.61Ⅱ+6.76Ⅲ+1.33Ⅳ和1.13Ⅰ+11.69Ⅱ+1.04Ⅲ+5.09Ⅳ.
(3) 筛选出SRAP适宜引物10对,经PCR扩增获得了122个多态性位点条带,多态性比率占65.92%.利用SRAP特异性引物M5BE7,构建了能明确识别8个优良杂种株系及其亲本的SRAP指纹图.
(4) 8个杂种株系及其双亲的遗传距离(GD)变幅为0.290~0.640,平均为0.442.以GD值0.40为基准,将10个材料分为5类:第一类为株系ZX-20、ZX-1960和母本‘MH-09’;第二类为株系ZX-780、ZX-1120、ZX-2200和父本‘MIN-21’;株系ZX-460、ZX-900和ZX-1540各单独成一类.
