我国牛羊主产区小肠结肠炎耶尔森菌的病原特征研究
2021-07-16李焓笑任洪林李岩松柳增善卢士英
郑 宇,李焓笑,赵 强,王 菡,胡 盼,任洪林,李岩松,柳增善,卢士英
小肠结肠炎耶尔森菌是一种食源性肠道病原体,可引起耶尔森菌病——欧盟第三大常见的人兽共患病[1]。作为能够在0 ℃~45 ℃生存的细菌[2],它不仅存在于各类家养动物和野生牲畜中,还存在于各种冷藏食品中[3]。人食用了被小肠结肠炎耶尔森菌污染的生猪肉或新鲜牛奶等食物,会出现腹泻、发烧等症状,并且引起局部炎症和心血管疾病等[4]。耶尔森菌病在全球范围内流行,根据美国疾病控制与预防中心2016年的报道,美国每年有11.7万人受到耶尔森菌病的影响,其中有640例需要住院治疗,35人死亡[5];在20世纪80年代,我国发生过2次耶尔森菌病的暴发流行[6]。由此可见,对各地区各物种的小肠结肠炎耶尔森菌流行规律和病原特征的研究是非常有必要的。为此,本研究于2018-2020年从我国牛羊主产区的牛羊养殖屠宰加工场采集各类样本(粪、乳、饲草以及环境样本),采用冷增菌法处理样本后进行菌株分离培养鉴定、毒力基因鉴定、血清型鉴定以及耐药性鉴定,对结果进行分析,总结了近两年全国牛羊主产区该菌的流行规律和病原学特征,为预防和监测小肠结肠炎耶尔森菌的传播奠定基础。
1 材料与方法
1.1 参考菌株 小肠结肠炎耶尔森菌参考菌株CMCC52225购买自中国医学微生物菌种保藏中心;HZ菌株为华中农业大学赠予菌株。
1.2 样本采集 采集2018-2020年黑龙江省、吉林省、辽宁省、内蒙古自治区、陕西省和新疆自治区牛羊养殖屠宰加工厂的各类样本共2 291份,其中黑龙江省744份,吉林省937份,辽宁省426份,内蒙古自治区100份,新疆自治区58份,陕西省26份。在各类样本中,包含粪样1 968份,乳样152份,肉样116份,环境样本33份,饲草样本22份。
1.3 仪器与试剂 小肠结肠炎耶尔森菌选择性培养基CIN-1与增菌液改良磷酸盐缓冲液,购买自青岛海博生物技术有限公司;PCR仪与凝胶成相分析系统,购买自新加坡应用生物公司;2x M5 HiPer plus Taq HiFi PCR mix,购买自北京聚合美生物科技有限公司;立式双层恒温振荡培养箱,购买自哈尔滨市东联电子技术开发有限公司;引物由上海生工生物工程有限公司合成;血清分型所用的血清试剂为实验室保存试剂;耐药性鉴定所用的抗菌药物药敏纸片,购买自杭州微生物试剂有限公司。
1.4 样本分离鉴定 取适量样本置于10倍体积的改良磷酸盐缓冲液中,4 ℃放置7~14 d以达到增菌效果,沾取增菌液于CIN-1培养基25 ℃划线培养18~24 h后,挑取“公牛眼”状红色菌落于LB液体培养基中于25 ℃摇菌8 h,以foxA[7]为目的基因,直接取菌液作为模板进行PCR鉴定,将PCR结果为阳性的菌株进行生化反应鉴定,将确定为小肠结肠炎耶尔森菌的菌株于-80 ℃保存,并利用统计学方法将分离结果进行统计与分析。
1.5 毒力基因检测 对小肠结肠炎耶尔森菌的5个主要毒力基因(ail,ystB[8],ystA,yadA,virF[9])分别进行PCR检测,PCR反应总体系为20 μL,其中包括2x M5 HiPer plus Taq HiFi PCR mix 10 μL,上下游引物各0.8 μL,DNA模板2 μL,其余用ddH2O补足。PCR扩增程序包括94 ℃预变性5 min,95 ℃变性30 s,61 ℃退火30 s,72 ℃延伸30 min,共35个循环,72 ℃延伸4 min,产物与DL2 000 marker用2%凝胶电泳分离(120 V,20 min),引物序列见表1。

表1 基因检测的PCR引物序列Tab.1 Primer sequences for Yersinia enterocolitica genes detection
1.6 血清分型检测 利用多重PCR方法[10]与玻片凝集方法进行血清型检测。玻片凝集法是将分离的阳性菌株划线培养,挑出菌落与已稀释的血清试剂在载玻片上混匀后观察是否出现凝集现象,并设置生理盐水作为空白对照。
1.7 耐药性检测 本实验主要针对15种药物进行耐药性的检测(氨苄西林、头孢唑林、丁胺卡那、庆大霉素、红霉素、诺氟沙星、环丙沙星、多粘菌素B、磺胺异恶唑、复方新诺明、氯霉素、头孢噻吩、呋喃唑酮、恩诺沙星、氟苯尼考)。具体操作如下:取适量菌液于LB平板涂匀后贴药敏纸片,25 ℃培养18~24 h,通过测量抑菌圈直径大小来判断药物对该菌的抑制效果。耐药性结果判定标准见表2[11]。

表2 耐药性结果的判定标准Tab.2 Judgment criteria for drug resistance results
2 结 果
2.1 不同地区样本分离结果 对2 291份样本进行PCR鉴定以及生化鉴定结果见表3,共分离到109株小肠结肠炎耶尔森菌,总检出率为4.76%,其中辽宁检出率为20.42%,新疆为15.51%,黑龙江为0.81%,吉林为0.75%,内蒙古和陕西地区未分离出阳性菌株。利用卡方检验进行差异分析,结果显示各地区检出率差异有统计学意义(χ2=288.153,P<0.01),辽宁和新疆检出率远高于其他地区。

表3 各地区样本中小肠结肠炎耶尔森菌的分离结果Tab.3 Results of Yersinia enterocolitica in samples from various regions
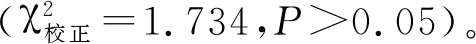

表4 各种类样本中小肠结肠炎耶尔森菌的分离结果Tab.4 Results of Yersinia enterocolitica in various samples
2.3 毒力基因检测结果 对109株阳性菌株进行毒力基因检测,结果显示(见表5)有71株菌株毒力基因携带情况为ail-、ystA-、ystB+、yadA-、virF-,并将其定义为I型毒力基因型(65.14%);其余的38株毒力基因携带情况为ail-、ystA-、ystB-、yadA-、virF-,并将其定义为II型毒力基因型(34.86%),而上述I、II型菌株通常被认为是非致病性菌株[12],因此,本次采样地区中的小肠结肠炎耶尔森菌致病概率很小,并且根据毒力基因所占百分比分析,ystB是本次采样地区小肠结肠炎耶尔森菌的优势毒力基因。
2.4 血清分型检测结果 对109株阳性分离菌株进行血清分型,结果见表5。共检测出3种血清型,包含O∶5,27血清型51株(46.79%),O∶6,30血清型3株(2.75%),O∶5血清型3株(2.75%),其余52株未分型(47.71%)。其中O∶6,30血清型只出现在辽宁地区(3.45%);O∶5血清型虽然在辽宁(2.30%)和黑龙江地区(16.67%)均有检出,但数量较少;O∶5,27血清型出现在黑龙江(66.67%)吉林(57.14%)和辽宁地区(49.43%),不仅覆盖范围广,而且所占比例高;新疆地区9株阳性菌株均未分型。综上可知,O∶5,27血清型被认为是本次采样地区小肠结肠炎耶尔森菌的优势血清型。

表5 小肠结肠炎耶尔森菌分离株的血清型与毒力基因检测结果Tab.5 Results of serotype and virulence genetypes of Yersinia enterocolitica isolates
2.5 耐药性检测结果 对15种抗菌药物的耐药性检测结果见表6,菌株对氨苄西林、红霉素、磺胺异恶唑和头孢噻吩100%耐药,对多粘菌素B和氟苯尼考100%敏感。除此之外,菌株对呋喃唑酮和复方新诺明的耐药率较高,均在75%以上,对氯霉素较敏感。

表6 小肠结肠炎耶尔森菌分离株的耐药性检测结果Tab.6 Results of durg resistence of Yersinia enterocolitica isolates
3 讨 论
对2018-2020年2 291份我国牛羊主产区牛羊源小肠结肠炎耶尔森菌的调查发现,这些地区的阳性样本总检出率为4.76%,与李旭等[13]在牛羊中的阳性总检出率(分别为2.78%和0.89%)相符,但与2018年六安市猪粪检出率(25%)[14]和江西省生猪源检出率(20.86%)[15]相差较大,这可能是因为生猪是小肠结肠炎耶尔森菌的主要宿主。利用SPSS进一步分析得知各地区检出率的差异有统计学意义,其中辽宁检出率最高,其次是新疆、黑龙江和吉林。从样本种类进行分析,环境样本检出率高达12.12%,其次是粪样检出率5.34%,而环境样本中分离到的阳性菌株均来自于屠宰使用的案板,这提示各养殖屠宰加工厂要注意屠宰加工环境,以免将细菌等微生物带入动物性食品中,影响人类健康。
毒力基因检测结果表明,本次分离到71株毒力基因I型菌株(只含ystB毒力基因)和38株毒力基因II型菌株(不含毒力基因)。虽然I、II型被认为是非致病性菌株,但在食源性暴发疾病样本中已经检测到含ystB基因的菌株[16],这说明携带ystB基因的菌株或许存在一定致病力,应该引起相应的重视。李旭[13]等在牛源样本分离菌株中的非致病性菌株检出率达到94.44%,与本研究中非致病性菌株检出率为100%的结果相符,也与本实验室所建立的多重PCR方法[8]结果一致,这说明近年来存在于牛羊源样本中非致病性小肠结肠炎耶尔森菌占绝大多数,而致病性菌株较少,但致病菌株的潜在影响力仍不可忽视。
目前,在世界上已知的60余个小肠结肠炎耶尔森菌血清型中,O∶3,O∶8,O∶9,O∶5,27,O∶13a等对人类具有致病力,而我国大多数致病菌株的血清型为O∶3和O∶9[17]。本次对109株阳性分离菌株进行常见的几种血清型检测,没有发现血清型为O∶3和O∶9的菌株,有少数菌株血清型为O∶5和O∶6,30,46.79%的菌株血清型为O∶5,27,其余菌株血清型待定。该地区血清型为O∶5,27的所有菌株均未被检测出致病基因,而Platt-Samoraj等[18]在5株分离的O∶5,27血清型菌株中检测到3株含有ail致病基因,这说明O∶5,27血清型菌株对于国内的养殖屠宰加工场所而言相对安全,但其对人类安全的威胁仍然不容小觑。
抗菌药物的过度使用已然成为全球细菌疾病治疗面临的重要挑战,为了减少小肠结肠炎耶尔森菌抗生素滥用的现象,本研究针对109株阳性分离株进行15种抗菌药物的药敏试验,结果显示所有分离菌株均具有耐药现象,并且对氨苄西林、红霉素、磺胺异恶唑和头孢噻吩4种药物耐药率达到100%,对呋喃唑酮和复方新诺明也有较强耐药性,对多粘菌素B、氟苯尼考和氯霉素敏感,这与Baumgartner等[19]的研究结果一致,说明多粘菌素B等3种药物可以作为临床治疗的首选药物。除此之外,本次分离菌株的多重耐药率(对2种及以上抗菌药物耐药)达到100%,其中有74.39%的菌株对5种抗菌药物耐药,这可能与养殖场的环境消毒和喂养牲畜时过量添加抗生素有关。因此,我国应对小肠结肠炎耶尔森菌的耐药状况进行监测,避免日常动物饲养与临床治疗中抗生素的滥用,最终为动物和人类的健康提供保障。
利益冲突:无
