多重PCR技术检测食品中鼠伤寒沙门氏菌3 种毒力基因
2021-07-15谭燕肖紫鸣李小林张洁宋文军魏纪平乔长晟
谭燕,肖紫鸣,李小林,张洁,宋文军,魏纪平,乔长晟
(天津商业大学生物技术与食品科学学院,天津 300134)
大肠杆菌O157:H7 和鼠伤寒沙门氏菌是食物中毒暴发的病原体,大多数新鲜农产品容易受到病原体的污染,从而导致食源性疾病的暴发[1-2]。 沙门氏菌是一种革兰氏阴性菌,属于肠杆菌科,是引起食源性疾病的主要原因[3-4]。 据统计分析,1996 年~2015 年的沙门氏菌食物中毒事件166 起,累计发病8 996 人[5]。 在沙门氏菌2 500 多种血清型中,少于100 种会导致大多数人感染,鼠伤寒沙门氏菌引发的污染常占前两位[6-7]。 感染鼠伤寒沙门氏菌轻至肠炎,临床表现为腹泻、恶心呕吐,重至败血症和全身系统性播散引起的内脏损害等症状[8-9]。 食源性致病菌的检测显得尤为重要。 近年来,随着现代分子生物学技术的不断发展和应用,研究者发现致病性细菌的致病力是大量细菌毒力相关基因相互作用的结果[10-13]。 近几年来基于分子生物学技术中的聚合酶链反应(polymerase chain reaction,PCR)检测[14]较于传统的微生物培养检测得到更多的应用。 聚合酶链反应检测方法不仅准确、灵敏,还能比传统的微生物检测更快速。 但是目前聚合酶链反应检测鼠伤寒沙门氏菌存在灵敏度不高,准确性不够等缺点。 为了提高检测鼠伤寒沙门氏菌的准确性和灵敏度,本研究用多重聚合酶链法对鼠伤寒沙门氏菌的多种毒力基因进行检测。
1 材料与方法
1.1 材料与仪器
1.1.1 试剂与菌种
Premix Tap(TaKaRa Tap Version 2.0 plus dye)、Ta-KaRa 试剂盒、TIANGEN D2000 Marker:天根生化科技(北京) 有限公司;Solarbio 50хTAE 缓冲液、Solarbio Goldview I 核酸染料、葡萄糖琼脂:北京索莱宝科技有限公司。 试验菌株信息见表1。

表1 菌株信息Table 1 Strain information
1.1.2 仪器
22331-Hambug 型PCR 仪: 苏州东胜兴业科学仪器有限公司;Tanon-1600 型凝胶成像仪:上海天能科技有限公司;DYY-6C 型电泳仪:Bio-Rad 公司;MiniSpin plus 型离心机:美国eppendorf 公司;Nano-600 型超微量紫外分光计:美国DeNovix 公司;HHS-6S 型恒温水浴锅:北京市长凤仪器仪表公司;HNY-211B 型恒温培养振荡器:天津市欧诺仪器仪表有限公司。
1.2 试验方法
1.2.1 DNA 模板的制备
取单菌落鼠伤寒沙门氏菌于无菌的液体(Laria-Bertain,LB) 培养基中36 ℃、180 r/min 培养12 h,取1 mL 菌液12 000 r/min 离心2 min,弃上清液。在沉淀中加入180 μL 的缓冲液GL、20 μL 的蛋白酶K 溶液(20 mg/mL)和10 μL 的核糖核酸酶A(10 mg/mL)充分振荡混匀,于56 ℃水浴温育10 min,加入200 μL的缓冲液GB 和200 μL 的无水乙醇, 充分吸打混匀,将核酸纯化柱安装在接收管上,溶液移至核酸纯化柱中,12 000 r/min 离心2 min,弃滤液。将500 μL 的缓冲液WA 加入至核酸纯化柱,12 000 r/min 离心1 min,弃滤液。 将700 μL 的缓冲液WB 加入至核酸纯化柱中,12 000 r/min 离心1 min, 弃滤液。 沿核酸纯化柱管壁四周加入缓冲液WB,将核酸纯化柱安置于接收管上,12 000 r/m 离心2 min。 将核酸纯化柱置于新的1.5 mL离心管上, 加入100 μL 加热至65 ℃的洗脱缓冲液,室温24 ℃静置5 min。 12 000 r/min 离心2 min 后洗脱DNA,得到100μL 沙门氏菌DNA 模板。 用超微量紫外分光计测提取的鼠伤寒沙门氏菌的核酸浓度。
1.2.2 引物设计与制备
通过查询资料选取鼠伤寒沙门氏菌的毒力岛基因mgtC、inva、mogA、sseL、araB 为本研究的目的基因, 其中mogA、sseL、araB、mgtC 是沙门氏菌的核心蛋白基因,毒力岛SPI-1 编码inva 基因, 毒力岛SPI-2 编码sseL 基因, 毒力岛SPI-3 编码mgtC 基因, 毒力岛SPI-5 编码araB 基因。 引物通过参考文献[15-16]和应用Primer6.0 设计获得,并由生工生物工程(上海)股份有限公司合成。引物序列见表2。

表2 引物序列Table 2 Primer sequence
1.2.3 单重PCR 反应体系的建立
参考文献[17],初步建立单重PCR 反应体系(25 μL)。样品DNA 模板1 μL、正向引物和反向引物各0.5 μL、Premix Tap 12.5 μL、ddH2O 补齐至25 μL。 PCR 扩增条件参数:94 ℃预变性5 min,之后开始扩增循环,每个循环的程序为:94 ℃变性30 s,分别在56.2、57.2、57.8、58.7 ℃下退火30 s、72 ℃延伸30 s、30 个循环,72 ℃延伸10 min,降温结束。 分别取上述PCR 扩增产物5 μL点样于1.5%琼脂糖凝胶,130 V 恒压,20 min 电泳完成后放入凝胶成像仪,观察电泳条带是否清晰、是否有杂带出现,目标条带是否扩增出来。
根据对PCR 扩增产物凝胶电泳图进行分析,确定反应体系的最佳退火温度。
1.2.4 多重PCR 反应体系的优化
在单重PCR 的反应条件下,将沙门氏菌的6 对毒力基因按照引物的DNA 解链温度Tm 值、引物之间的交叉污染等因素进行多重PCR 的试验设计,选择退火温度相近,引物长度不在同一区间的引物。多重PCR反应体系参考方法[18-19](50 μL):样品DNA 模板各2 μL、正向引物和反向引物各1 μL、Premix Tap 25 μL、ddH2O补齐至50 μL。PCR 扩增条件参数:94 ℃变性5 min,开始扩增循环, 每个扩增循环的程序为:94 ℃变性30 s、57.2 ℃下退火30 s、72 ℃延伸30 s、30 个循环, 然后72 ℃延伸10 min,降温结束。
根据以上体系做响应面优化,见表3。
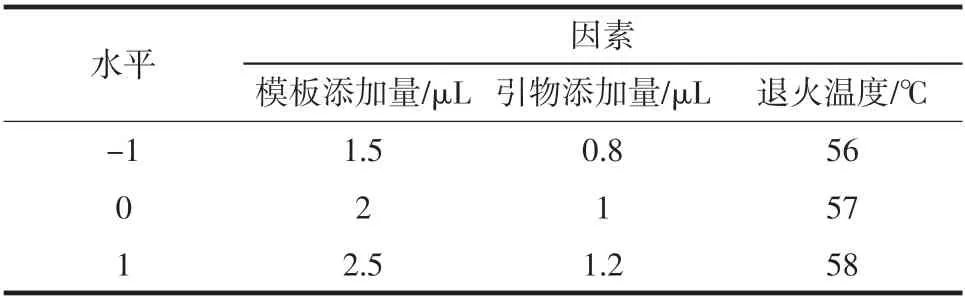
表3 响应面优化反应体系Table 3 Response surface optimization reaction system
分别取上述PCR 扩增产物5 μL 点样于1.5%琼脂糖凝胶,130 V 恒压20 min。 电泳完成后放入凝胶成像仪,观察电泳条带是否清晰、是否有杂带出现,目标条带是否扩增出来,引物之间是否有交叉污染。
1.2.5 特异性验证
在沙门氏菌DNA 模板里混合单增李斯特菌和大肠杆菌作为阴性对照,ddH2O 为空白对照,在单重PCR条件下进行PCR 反应,以鉴定该方法的特异性。
1.2.6 灵敏度检测
分别用无菌ddH2O 将提取的沙门氏菌DNA 浓度为0.165 ng/mL 进行10 倍梯度稀释为0.165、0.165×10-1、0.165×10-2、0.165×10-3、0.165×10-4、0.165×10-5、0.165×10-6、0.165×10-7ng/mL, 再将梯度稀释后的DNA作为模板,通过优化后的反应程序进行扩增,检测该方法的灵敏性。
1.2.7 重复性试验
本研究中的所有试验,均重复3 次,以验证试验方法的重复性。
1.3 数据处理
本试验采用Design-expert 响应面分析软件对多重PCR 方法的建立及优化进行设计和分析,采用凝胶成像仪对PCR 产物进行凝胶电泳后的胶进行观察并另存为图片,再采用iSee 软件对图片进行处理。
2 结果与分析
2.1 单重PCR 反应条件的确定
采用1.2.2 中表2 引物建立单重PCR 反应体系检测鼠伤寒沙门氏菌的mgtC、inva(214)、inva(284)、mogA、sseL、araB 毒力基因。 沙门氏菌毒力基因在不同温度下的电泳图见图1。

图1 沙门氏菌毒力基因在不同温度下的电泳结果Fig.1 Electrophoresis of Salmonella virulence genes at different temperatures
由图1 可知,图1B 的条带较清晰,无杂带出现,说明单重PCR 反应的最佳体系为模板1 μL、正向引物和反向引物各0.5 μL、Premix Tap 12.5 μL、ddH2O 补齐至25 μL。 单重PCR 反应的方法的最佳退火温度为57.2 ℃。
2.2 多重PCR 反应体系的优化
本研究采用响应面方法对多重PCR 反应体系进行优化,退火温度、引物添加量和模板添加量对多重PCR 方法特异性的影响见图2, 并根据图2 的试验结果,对其进行重复验证,重复验证结果见图3。

图2 多重PCR 方法响应面优化Fig.2 Multiplex PCR method response surface optimization

图3 多重PCR 方法重复性Fig.3 Repeatability of multiple PCR method
由图2、图3 可知,泳道9 的条带最为清晰且无交叉污染。 所以多重PCR 方法的最佳反应体系为DNA 2 μL、 上下引物各0.8 μL、Premix Tap 25 μL、ddH2O 18.2 μL。 Tm 值为56 ℃。
2.3 特异性验证
采用鼠伤寒沙门氏菌的mgtC、inva(214)、inva(284)、mogA、sseL、araB 毒力基因引物进行单重PCR 扩增。验证单重PCR 方法检测鼠伤寒沙门氏菌的mgtC、inva(214)、inva(284)、mogA、sseL、araB 毒力基因的特异性结果见图4。
由图4 可知, 沙门氏菌的毒力基因均扩增出目的条带,阴性对照无有效扩增条带,说明本研究的方法可用于鼠伤寒沙门氏菌的特异性检测。

图4 单重PCR 特异性分析Fig.4 Specific analysis of single PCR
2.4 灵敏度检测
采用鼠伤寒沙门氏菌mgtC、mogA、araB 毒力基因引物进行多重PCR 扩增以检测本研究的灵敏度。多重PCR 方法检测鼠伤寒沙门氏菌mgtC、mogA、araB 毒力基因的灵敏度的结果见图5。

图5 多重PCR 灵敏度Fig.5 Multiplex PCR sensitivity
由图5 可知该方法能检测的最低灵敏度为0.016 5 ng/μL。 贺晨、刘骆强等[20-21]等研究的沙门氏菌的最低检测限均为0.02 ng/μL,然而刘菲菲[22]研究的沙门氏菌最低检测限度为1ng/μL。 由此可知该方法的灵敏度好。
3 结论与讨论
本试验通过建立单重PCR 检测沙门氏菌毒力基因的试验方法建立多重PCR 快速检测多种毒力基因的试验方法。 在6 对特异性引物中进行多重PCR 反应, 筛选出mgtC、mogA、araB 3 种毒力基因进行多重PCR 反应的特异性强、无交叉污染,该方法能检测的最低灵敏度为0.016 5 ng/μL。
本试验的单重PCR 方法可以同时检测沙门氏菌毒力岛编码的基因mgtC、inva、mogA、sseL、araB, 由于引物之间的交叉污染,本研究中建立的多重聚合酶链反应(PCR)只能同时检测3 种鼠伤寒沙门氏菌毒力基因mgtC、mogA、araB。 若食品中能同时检测出mgtC、mogA、araB 基因,则该食品中的沙门氏菌毒性较强。但是该方法检测范围有限,只能对mgtC、mogA、araB 3 种基因进行检测。 本研究检测方法特异性强、灵敏度高,重复性好,可以实现快速检测食品中鼠伤寒沙门氏菌3 种毒力基因, 对预防控制鼠伤寒沙门氏菌对食品污染引起的食品安全问题具有很好的应用前景。
