颈动脉体瘤术后发生缺血性脑卒中危险因素的回顾分析
2021-07-15牟思琦丁明超吴中明魏建华王维戚
牟思琦, 丁明超, 吴中明, 张 浩, 魏建华, 王维戚
(1.佳木斯大学第一附属医院整形烧伤美容中心,黑龙江 佳木斯 154002;2.军事口腔医学国家重点实验室,口腔疾病国家临床医学研究中心,陕西省口腔疾病临床医学研究中心,空军军医大学第三附属医院口腔颌面外科,陕西 西安 710032)
头颈部副神经节瘤也被称为化学感受器瘤,是一种罕见的副交感神经系统的良性肿瘤,其中以颈动脉体瘤(CBT)最为常见[1]。Shamblin分型是CBT外科治疗史上的一个里程碑[2]。CBT切除术后可发生严重的并发症,尤其是缺血性脑卒中(IS)。现有的CBT分型无法对IS的发生进行有效评估[3]。本研究纳入2006年2月—2018年7月行CBT手术治疗的患者共43例,根据术后是否发生IS进行分组,探讨CBT术后发生IS的危险因素及预防措施。
1 资料和方法
1.1 一般资料
选取自2006年2月—2018年7月于空军军医大学第三附属医院行CBT手术治疗的患者共43例。纳入标准:术后病理诊断均为CBT;术前均行彩超、CT/CTA、DSA检查;术后随访资料完整。
1.2 手术方法
所有患者均在全麻下进行手术治疗,其中单侧发病42例(左侧:21例,右侧:21例),双侧发病1例。单纯瘤体切除术20例,瘤体切除并颈外动脉结扎14例,瘤体切除伴颈内动脉重建颈外动脉结扎4例,瘤体切除伴颈总动脉结扎5例。详见图1。
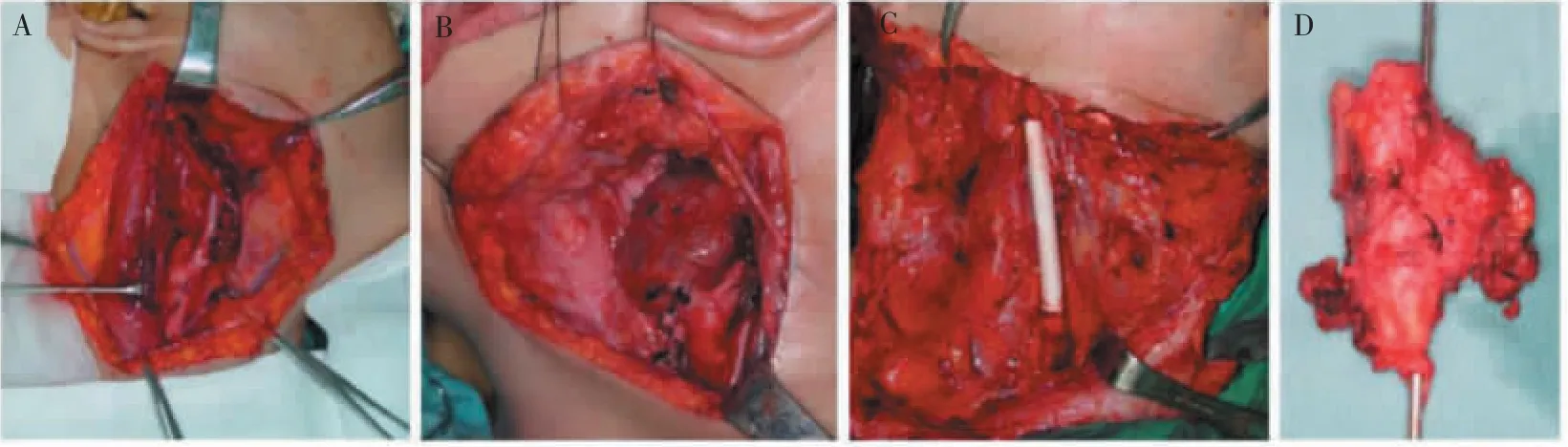
图1 CBT的各种外科手术Figure 1 Various surgical operations of CBT
1.3 评价指标
记录患者基本信息(年龄、性别)、瘤体信息(侧别、瘤体直径),以及手术信息(手术时间、术中出血量及是否伴有颈内、外动脉损伤)。比较IS组与未发生组上述资料的差异。
1.4 统计学分析
采用SPSS 19.0统计学软件对数据进行处理。计量资料用均数±标准差表示,组间比较采用t检验。计数资料用例(%)表示,组间比较采用χ2检验。并以各项指标作为自变量进行Logistic回归分析,以P<0.05认为差异有统计学意义。
2 结果
2.1 一般资料比较
纳入研究的43例CBT患者中,单侧发病者为42例(97.7%),其中左侧和右侧发病各为21例,双侧均发病者仅有1例(2.3%)。男性17例(39.5%),女性26例(60.5%),平均发病年龄(42.8±12.30)岁。5例(11.6%)在术后48 h内发生IS,术后给予改善脑循环(静脉溶栓、抗血小板、抗凝、降纤、扩容等)、他汀及神经保护等治疗,其中1例术后发生昏迷并因心肺功能衰竭于外院ICU死亡;4例出现一侧面部或肢体无力等症状,2年随访期间面部及肢体无力症状无明显改善。2组间性别、年龄、瘤体侧别差异无统计学意义。与未发生组相比,IS组患者手术时间更长,瘤体直径更大,术中出血量更多,颈内、外动脉损伤更常见,差异均有统计学意义(表1)。

表1 2组临床资料比较Table 1 Clinical data between the two groups
2.2 预后影响的多因素分析
将因变量定义为CBT术后是否发生IS(1=发生,0=未发生),以各项临床指标作为自变量进行logistic回归分析。结果显示,瘤体直径是CBT术后发生IS的独立危险因素(OR=3.13,95%CI=1.71~302.12,P=0.018)。
3 讨论
3.1 术前准备
CBT的发病位置紧邻血管,穿刺活检可能会导致血管损伤、出血及假性动脉瘤[4],故术前常采用影像学检查为依据,制订手术方案。常用方法有彩色超声、MRI/MRA、CT/CTA、DSA检查等,其中,彩色超声是CBT首选的非侵入性检查方式[5],DSA被认为是CBT术前检查的金标准[6]。术前颈动脉压迫试验可探知患者颈动脉阻断耐受时间,增加侧支循环,提高患者脑部对缺血的耐受。此外,围手术期需要保持血流动力学的平稳,适当使用扩血管及抗凝药物。
3.2 术中要点
3.2.1 术式选择大多数ShamblinⅢ型及部分ShamblinⅡ型者,肿瘤包绕、浸润颈内动脉者,术中颈内动脉损伤者,术前球囊闭塞试验阳性者,Willis环发育纤细或代偿功能差者,术中颈内动脉残端压<40 mmHg(1 mmHg=0.133 kPa),并伴肿瘤上缘距颈动脉管内口1 cm以上者均可考虑行血管重建[6],预防IS。血管重建分为自体血管重建(图2)和人工血管重建(图3)。自体大隐静脉移植主要适用于肿瘤较大且血供丰富的患者[7];人工血管远期通畅率较低,故人工血管重建多用于老龄或伴有大隐静脉曲张的患者[8],但术后可能行放疗的患者应避免选用人工血管重建的方式[9]。除此之外,若患者出现以下情况可以选择置入转流管:①瘤体较大、周围组织粘连较重、需要血管重建、手术时间较长的患者;②对侧颈动脉硬化或狭窄严重、Willis环完整性欠佳者;③术前行Matas试验,大脑对缺血耐受结果欠佳者[10]。但转流管的使用常常伴随动脉硬化狭窄严重、损伤动脉内膜组织等风险,有可能导致局部血栓形成,且在置管过程中有颈动脉夹层形成等风险[4],需要成熟的血管外科技术支持才能完成。

图2 自体血管重建Figure 2 Reconstruction with autologous blood vessel

图3 人工血管重建Figure 3 Reconstruction with artificial blood vessel
3.2.2 分离层次单纯CBT切除的分离层次有多种观点,常见的为逐层分离至颈动脉外膜下层与瘤体之间的分离平面,即Gordon-Tayler白线。也有观点认为可以分离至动脉外膜-瘤体被膜界面[11]。王伟琦等[12]提出,可以进行包膜下切除。分离方法常用的是首尾分离法,即首先从CBT下缘开始游离,将其与迷走神经、颈总动脉上段、颈内静脉进行分离;然后分离CBT上缘,暴露舌下神经及颈内、外动脉;最后从颈总动脉近心端分离至分叉起始部,再从颈外动脉远心端向分叉起始部分离,然后自颈内动脉远心端向近心端开始分离至颈动脉分叉粘连紧密处,以颈动脉分叉为中心作为去除肿瘤的最后一步[4]。Hinojosa等[3]提出了另一种分离方式——颈动脉后剥离技术(retrocarotid dissection,RCD),即游离瘤体下缘至颈动脉分叉下缘,双极电凝阻断滋养血管,然后将瘤体与颈动脉分叉分离,将颈外动脉向外后侧旋转,再将肿瘤自颈外动脉后缘向前推挤,实现近端后脱位。
3.2.3 缺损修补分离时应尽量锐性分离,因其分离层次可控性佳,不易损伤动脉,即使损伤动脉,因其创缘规整,往往可以直接修补,且有资料显示,钝性分离会造成微血管断裂和假性动脉瘤[13]。而瘤体与颈内动脉粘连紧密者,若分离过程中反复出现颈内动脉损伤,损伤较小者可直接使用无损伤缝线修补;对于损伤较大者,若直接缝合修补会导致血管狭窄,可以考虑予以补片修复或者邻近瓣修复(颈内动脉破损>1 cm),如图4所示,节段性缺损可应用颈内、外动脉交叉换位修复,如图5所示。
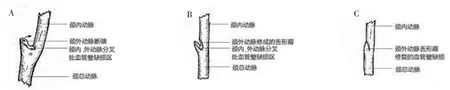
图4 颈外动脉舌形瓣修复颈动脉分叉处管壁缺损示意图Figure 4 Schematic diagram of external carotid artery lingual flap repairing vascular wall defect at furcation area

图5 颈内、外动脉交叉修复颈内动脉管壁缺损示意图Figure 5 Schematic diagram of internal carotid artery wall defect repaired by intersections of internal and external carotid arteries
3.3 术后措施
术后密切观察患者的基本生命体征,观察切口渗出情况及引流量,观察患者意识状态及肢体运动情况。术后的抗凝、抗血小板治疗可以降低IS的发生率[14]。
综上所述,本研究发现,CBT术后IS的发生与瘤体直径、术中出血量、手术时间、颈内和颈外动脉损伤有关。完善的术前检查可明确瘤体的血供及与颈动脉的关系,应制订详细的方案以尽量减少术中出血量、缩短手术时间;对于较小的颈动脉损伤,术中可应用直接修补、舌形瓣修复、颈内和颈外动脉交叉修复的方式及时修复颈内动脉;如果术前提示具有发生IS的高危因素,且已明确术中无法与颈内动脉分离,应于术前行血管重建以缩短手术时间,减少出血量,并且保留颈内动脉的功能,但须严格把握适应证;术后给予抗凝、抗血小板治疗以减少术后IS的发生。
