星形胶质细胞重编程诱导为神经细胞的实验研究
2021-07-15宋泽武王希赵浥石晶李立新
宋泽武,王希,赵浥,石晶,李立新
脑损伤后功能性神经元的再生仍然是脑修复的主要挑战。目前的研究主要集中在使用源自胚胎干细胞或诱导多能干细胞的外源细胞来产生神经细胞替代疗法[1]。尽管潜力巨大,但这种细胞移植方法面临着重大障碍,例如免疫排斥、肿瘤发生和分化的不确定性[2]。最近的研究已经证明星形胶质细胞可以在体外直接转化为神经细胞[3]。我们在阿尔茨海默病小鼠模型中进一步证明,反应性星形胶质细胞可以直接重编程神经细胞[3]。星形胶质细胞也可以先转化为神经母细胞,然后再分化为神经细胞[4]。然而,到目前为止,神经胶质细胞向神经元的转化主要是使用基于病毒的转录因子表达来实现的。相比之下,小分子已被用于促进神经分化,促进细胞重编程[5],甚至直接将成纤维细胞重编程为诱导多能干细胞(iPSCs)、神经祖细胞或神经元[6]。与基于转录因子的重编程相比,小分子提供了易用性和更广泛的下游应用。
本研究进行体外细胞实验,发现小分子化合物Y-27632、VPA、SB431542、RepSox不仅可以将星形胶质细胞直接重编程诱导为神经细胞,细胞不会经历去分化步骤,避免了干细胞诱导的缺陷。并且与以往的研究相比,提高了转化效率,精简了小分子数量,降低了操作难度,使得这一过程变的更加简便、安全;为中枢神经损伤后修复探索新的治疗方法。
1 材料与方法
1.1 实验动物及试剂 出生1~4 d的SD大鼠幼仔(南京医科大学实验动物中心)。胎牛血清(CellMax);青/链霉素(Gibco);多聚-D-赖氨酸(Sigma-Aldrich);PBS(Hyclone);2.5%胰酶消化液(含EDTA,Gibco);碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF;Hyclone);Neurobasal培养基(Gibco);DMEM/HIGHGLUCOSE培养基(Hyclone);表皮生长因子(epidermal growth factor,EGF;Hyclone);B27(Peprotech);anti-NeuN, anti-TUJ1,anti-MAP2,anti-GFAP, CY3-羊抗小鼠IgG及CY3-羊抗兔IgG(Abcom);4%多聚甲醛(Biosharp);免疫染色封闭液,Triton X-100,抗荧光淬DAPI,DMSO(碧云天);Y-27632,VPA,SB431542,RepSox(MSE)。10 cm细胞培养皿,T75培养瓶,24孔细胞培养板(Corning);眼科剪、镊、手术剪;体视显微镜(LEICA S4E);倒置相差显微镜(Nikon ECLIPSETS100);倒置荧光显微镜(LEICA DMI3000B)。
1.2 方法
1.2.1 星形胶质细胞的培养及鉴定 取出生1~4 d的SD大鼠幼仔,用体积分数为75%的乙醇消毒头颈部;用眼科剪剪开大鼠头皮及颅骨后,用镊子小心取出大脑组织,置于盛有6 mL DMEM的10 cm细胞培养皿中漂洗两次,并置于冰上。在体视显微镜下精细除去嗅球和小脑,将海马组织及丘脑等结构剥离去除,并用眼科镊仔细将脑膜从大脑皮层半球分离;避免提取的原代星形胶质细胞被脑膜细胞和成纤维细胞污染。在无菌操作台中用眼科剪将脑组织剪成直经约2 mm大小的碎块,加入22.5 mL的DMEM,再加入2.5 mL的2.5%胰酶消化液,放入4 ℃孵箱内消化30 min,每隔10 min摇晃混匀1次。随后用移液器将组织转移到含10% FBS的DMEM高糖培养基的15 mL无菌离心管内,终止消化,以900 r/min离心5 min后弃上清液,加入15 mL含10% FBS的DMEM高糖培养基重悬沉淀;用5 mL移液器反复吹打,将组织分离成单个细胞悬液(20~30次)。细胞计数后以约4×106/mL个细胞的密度接种于T75培养瓶中,并放入37 ℃、5% CO2孵箱中培养。培养第7 d细胞密度大于70%,置于摇床分离小胶质细胞(180转,30 min)和少突胶质细胞(240转,6 h),移除含有小胶质细胞和少突胶质细胞的上清液,并用PBS冲洗T75培养瓶三次;摇床分离结束后,消化重悬细胞,并接种在培养皿中进行传代提纯,随着逐次传代,混杂细胞(如神经元)相继死亡,随后细胞纯度不断提高,细胞形态高度统一。取第三代细胞进行实验,并行细胞免疫荧光染色鉴定。
1.2.2 小分子化合物诱导 分离大鼠星形胶质细胞,并接种在培养皿上传代提纯,在24孔板中将第三代星形胶质细胞培养在聚D-赖氨酸(Sigma)涂层的盖玻片(12 mm)上,并分为诱导组(A组),对照组(B组)。铺板培养2 d后,在光学显微镜下观察两组细胞的生长情况,发现细胞紧密粘附爬片生长,折光度好,细胞形态舒展,胞质饱满,已生长至铺满孔底70%~80%,有旺盛的生长活力。此时仔细将培养基吸出,用PBS轻柔地洗3次,吸干PBS,每孔加入1 mL含10% FBS的DMEM高糖培养基。A组细胞:将Y-27632(0.5 μmol/L)、VPA(0.5 μmol/L)、SB431542(94 nmol/L)、RepSox(25 μmol/L)这4种小分子溶入DMSO中,在24孔板中加入Y-27632、VPA、SB431542、RepSox 4种小分子混合物,连续刺激星形胶质细胞7 d,显微镜下观察到细胞形态发生改变,饱满的胞质变得逐渐细长,随后更换含有生长因子BDNF、NT-3的神经元培养基(B27N2-Neurobasal)。B组细胞:在24孔板中加入相同体积的DMSO,并于7 d后更换含有生长因子BDNF、NT-3的神经元培养基(B27N2-Neurobasal)。两组细胞继续培养14 d后经行免疫荧光染色。
1.2.3 神经元轴突及核标志物检测 采用免疫荧光染色法。小心地将培养基吸出,用PBS洗涤细胞3次,动作轻柔,防止细胞脱落。每孔加入1 mL 4%多聚甲醛室温30 min固定细胞。PBS清洗2次,洗掉4%多聚甲醛,每孔加入500 μL 3‰ Triton X-100室温孵育20 min,使得细胞膜形成孔道。PBS清洗2次,洗净3‰ Triton X-100,每孔加入500 μL QUICKBLOCK免疫染色封闭液,室温封闭1 h。勿用PBS清洗,用移液器直接吸出封闭液,根据一抗比例用QUICKBLOCK一抗稀释液稀释一抗,每孔加入200 μL一抗NeuN、TUJ1、MAP2、GFAP,置入4 ℃摇床过夜,或室温2 h以上孵育一抗。用PBS置摇床上清洗3~5次,每次10 min;此后的步骤均需避光操作,根据二抗比例使用QUICKLOCK二抗稀释液稀释二抗,每孔加入200 μL对应的二抗,CY3-羊抗小鼠IgG及CY3-羊抗兔IgG,室温孵育2 h。用PBS置摇床上清洗3~5次,每次10 min,加入抗荧光淬灭剂DAPI,室温孵育5 min,用PBS置摇床上清洗。荧光显微镜下观察并拍照。
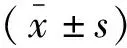
2 结 果
2.1 星形胶质细胞培养及鉴定 原代大鼠星形胶质细胞在接种2 h后,细胞贴壁,折光性好,聚集成团。2 d后,细胞胞体逐渐张开,细胞生长缓慢且细胞种类较多。早期细胞胞体明显、核较大,细胞形态不规则,呈梭形或不规则形,部分星形胶质细胞长出足突,小部分圆形、胞体较小、折光性强的细胞为小胶质细胞或少突胶质细胞。7 d后,置于摇床分离小胶质细胞(180转,30 min)和少突胶质细胞(240转,6 h),摇床分离结束后,细胞铺满瓶底,星形胶质细胞的比例明显提高;光镜下折光度高、细胞透明,细胞聚集生长,如同神经元呈巢状生长样。用移液器加入0.25%的胰蛋白酶2 mL消化细胞5 min,细胞变圆,胞浆回缩,细胞变得透亮。消化重悬后细胞接种于10 cm培养皿中,显微镜下观察到贴壁时间缩短,细胞透亮,未聚团,且大小较均一。传代培养4 d后,星形胶质细胞胞体变大,透光度较低,细胞生长迅速、纯度增加,基本无小胶质细胞或少突胶质细胞(图1)。在24孔板中将第三代星形胶质细胞培养在聚D-赖氨酸(Sigma)涂层的盖玻片(12 mm)上,用星形胶质细胞特异性抗体GFAP染色,荧光显微镜下发绿色荧光(图1)。

图1 星形胶质细胞鉴定(免疫荧光染色,×100)
2.2 小分子化合物诱导后星形胶质细胞形态变化 在24孔板中将第三代星形胶质细胞培养在聚D-赖氨酸(Sigma)涂层的盖玻片(12 mm)上,将Y-27632(0.5 μmol/L)、VPA(0.5 μmol/L)、SB431542(94 nmol/L)、RepSox(25 μmol/L)这4种小分子溶入DMSO中;在24孔板中加入这4种小分子混合物,孵育星形胶质细胞7 d,显微镜下观察到细胞形态发生改变,胞体由原来的饱满宽大逐渐变得细长,两端伸出较长的轴突,呈现两极形态,相邻细胞存在轴突-胞体、轴突-轴突等联系。随着小分子物质的持续刺激,细胞形态进一步向神经元改变。光镜下见细胞胞体明显缩小、细长,细胞发出两个轴突,随着时间推移轴突也逐渐变长。随后更换含有生长因子BDNF、NT-3的神经元培养基(B27N2-Neurobasal);21 d后可见大量具有两极且长轴突的神经元样细胞(图2)。
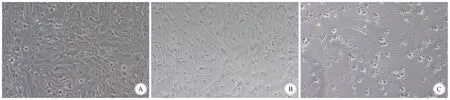
A:星形胶质细胞;B;诱导7 d;C:诱导21 d
2.3 两组细胞的神经元轴突及核标志物表达 免疫荧光染色显示,诱导第7 d,诱导组细胞中出现早期神经元轴突标志物TUJ1表达阳性细胞的比率为15.6%±0.7%,对照组细胞为3.2%±0.3%(n=5,阳性率=TUJ1阳性细胞数/细胞总数);诱导组细胞的TUJ1表达阳性率明显高于对照组,差异有统计学意义(P<0.05)。诱导第21 d,诱导组细胞成熟神经元轴突标志物MAP及核标志物NeuN表达阳性;对照组细胞基本无MAP2及NeuN表达。见图3。

A:诱导第7 d,A1:诱导组;A2:对照组;B:诱导第21 d,B1:诱导组;B2:对照组
3 讨 论
中枢神经系统损伤后,由于神经元变性、坏死[7-8],星形胶质瘢痕的形成[9]及损伤部位的大量炎症因子浸润[10-11],造成机体在自我修复过程中,难以恢复神经元的信号联系;从而引起运动、感觉障碍及自主神经功能紊乱,严重的可导致患者偏瘫或截瘫[12]。近半个多世纪以来,对于中枢神经损伤的治疗通常有手术治疗、药物治疗、康复训练等,但这些方法对于患者的愈后改善作用有限,脑损伤和脊柱损伤的患者想要自己重新站起来几乎难以实现;因此,探索新的治疗方法迫在眉睫。近年来,随着细胞工程技术的不断进步和发展,干细胞移植治疗效果得到了较大的提升;在神经系统疾病方面如脑瘫、帕金森病、脑梗死后遗症、脑外伤后遗症都取得了重大进步[13-14]。但是移植入损伤部位的细胞由于空间分布离散及微环境的抑制作用,导致植入细胞存活率、功能性远远低于体外实验结果;并且内源性干细胞量少、获取困难,外源性干细胞存在免疫排斥、存活和伦理的问题。既往的研究表明,反应性神经胶质细胞可以通过单个转录因子重编程为神经细胞,但是要通过慢病毒作为载体才能实现[15-16]。而慢病毒本身及其转染试剂对细胞有一定的毒性作用及肿瘤发生等问题。小分子物质将星形胶质细胞直接重编程为神经细胞,细胞不会经历去分化步骤,或者在转化过程中经历的原始干性细胞阶段的时间很短暂[17],避免了干细胞移植存在的缺陷;极大地丰富了移植细胞的细胞库,并且还具有取材方便、减少免疫排斥、原位移植等优点。
Zhang等对20种小分子化合物进行最终筛选,筛选出了多种对神经发育至关重要的信号通路的小分子(总共9个)[18],包括LDN193189、SB431542、TTNPB、Thiazovivin、CHIR99021、DAPT、VPA、A83-01、RepSox。其调控星形胶质细胞的关键发育途径,成功将来自大脑皮层和中脑的星形胶质细胞转分化为神经细胞,并且在转分化过程中,未检测到细胞干性及细胞增殖相关指标的表达,对比慢病毒介导的重编程模式存在的分化不确定、肿瘤发生等问题,小分子物质使得这一过程变的更加简便,安全。但使用9种小分子,涉及分子种类多,实施复杂,限制临床应用。本研究在此基础上,简化了小分子的数量,确定了一组能够将大鼠星形胶质细胞重编程为神经细胞并且诱导效率较高的4种小分子组合(Y-27632,VPA,SB431542,RepSox)。在重编程过程中,小分子物质首先阻断促进细胞向星形胶质细胞分化的通路:TGFβ信号通路。RepSox和SB4311542,阻断TGFβ激活素受体,该通路在细胞分化过程中抑制细胞向神经元分化,并促进星形胶质的分化[19]。Y-27632是Rhor相关激酶的抑制剂,促进细胞存活,提高重编程效率。VPA是星形胶质细胞生成神经母细胞所必须的,能显著激活NeuroD1和Neurogenin2的表达。诱导效率的提高和小分子数量的精简,为此种技术应用于临床提供了可能。
使用这4种小分子混合物孵育星形胶质细胞7 d,显微镜下观察到细胞形态发生了改变,饱满的胞质变得逐渐细长,随后更换含有生长因子BDNF、NT-3的神经元培养基(B27N2-Neurobasal)。细胞继续培养一段时间后行免疫荧光染色。小分子连续诱导第7 d,免疫荧光检测显示,诱导组细胞出现早期神经元轴突标志物TUJ1表达,阳性率为15.6%±0.7%,而对照组细胞仅为3.2%±0.3%;诱导组细胞的TUJ1表达阳性率明显高于对照组(P<0.05)。诱导第21 d,诱导组细胞可见神经元轴突标志物MAP2以及神经元核标志物NeuN表达[20],对照组细胞基本无MAP2及NeuN表达。
本研究表明,Y-27632、VPA、SB431542、RepSox这4种小分子混合物可以在体外将大鼠星形胶质细胞直接重编程诱导为神经细胞。下一步的研究需要在体内进行验证,为中枢神经损伤后修复提供新的方法。
