Fe/Ag催化臭氧氧化降解苯酚的研究
2021-07-14徐锦明毛君妍张原浩宿俊杰胡伟武
侯 颖,徐锦明,李 平,毛君妍,张原浩,宿俊杰,陈 男,胡伟武
(1.中国地质大学(北京)水资源与环境学院,北京 100083;2.中国地质大学(北京)数理学院,北京 100083;3.南京理工大学材料科学与工程学院,江苏 南京 210094)
0 引 言
近年来,含有各种难降解有机物的废水引发的生态问题频发,这些废水中大部分含有多环芳烃、卤代烃、杂环类化合物、有机农药等有毒且难降解的有机污染物[1]。含酚废水是危害严重的工业有机废水之一,对于含酚废水的处理和控制成为近年来的研究热点。目前,对于苯酚废水的处理方法主要包括:吸附法、膜分离法、电化学法以及高级氧化法等[2-3]。高级氧化法(Advanced Oxidation Processes,简称AOPs)反应产生的羟基自由基(·OH)具有极强的氧化性,能将有机污染物有效地分解,甚至彻底地转化为无害无机物(如二氧化碳和水等)[2]。该工艺具有氧化性强和操作条件易于控制的优点,是一种极具前景的氧化技术。
在高级氧化法中,非均相催化臭氧化技术利用了臭氧与催化剂的组合,臭氧是一种常见的氧化剂。在不同的介质环境条件下,不同氧化剂对有机物的氧化效率呈现差异性,废水的酸碱条件、温度和催化剂的催化能力均有可能作为潜在影响因素[4]。在间接反应中,臭氧分解产生的高活性·OH可与污染物直接作用,引发链反应,能使大多数有机物迅速矿化降解[5]。非均相催化臭氧化技术能改善臭氧的分解和自由基的产生,催化反应加速有机污染物的去除[6-7]。非均相臭氧氧化使用的催化剂主要有4种:金属氧化物、无金属负载型固体催化剂、负载金属型催化剂、负载型活性炭催化剂[8-10]。目前非均相催化臭氧化存在两种可能的机理:(1)认为有机物被吸附在催化剂表面,形成具有一定亲核性的表面螯合物,然后臭氧或者羟基自由基与之发生氧化反应,形成的中间产物可能在表面进一步被氧化,也可能脱附到溶液中被进一步氧化;(2)认为催化剂不但可以吸附有机物,而且还直接与臭氧发生氧化还原反应,产生的氧化态金属和羟基自由基可以直接氧化有机物[11]。
前人报道了不同的金属及其氧化物(如Ru,MgO)制备催化剂降解有机污染物的研究[12-13],但催化剂制备过程复杂,且COD去除效果不佳。过渡金属元素制备的催化剂具有高催化活性,且双金属催化剂制备过程简易。本研究拟制备双金属Fe/Ag催化剂催化臭氧降解苯酚,其主要目的:(1)成功制备Fe/Ag双金属催化剂;(2)明确Fe/Ag催化臭氧化的最佳反应条件;(3)探讨Fe/Ag催化臭氧化反应的机理。本研究可为进一步提高有机污染废水的去除提供理论依据和实验材料。
1 材料与方法
1.1 试剂与仪器
AgNO3、Fe和苯酚(C6H5OH)均购于国药集团化学试剂有限公司,为分析纯,且使用前无须预处理。实验用水均为去离子水。
测试仪器包括:臭氧发生器(CF-G-3-10g,青岛国林),紫外可见分光光度仪(DR6000,美国HACH),pH计(瑞士METTLER TOLEDO),扫描电子显微镜(SEM)(SSX-550,日本Shimadzu),X射线衍射仪(XRD)(D8 Focus,德国Bruker),比表面积分析仪(BET)(AUTOSORBIQ2,美国Quantachrome)。
1.2 催化剂的制备与表征
实验使用的Fe催化剂为铁粉,Fe/Ag催化剂使用前驱物质AgNO3和Fe粉末制备,Fe/Ag催化剂制备原理如下:
Fe+2AgNO3=2Ag+Fe(NO3)2
(1)
准确称取9.445 g铁粉和11.805 g AgNO3,将称取的AgNO3溶解在200 mL氮气吹脱的去离子水中;经完全溶解后,在溶液中加入称取的铁粉,手动搅拌15 min并静置10 min;先后使用无水乙醇洗涤一次、去离子水洗涤两次,将洗净后的药品放入冷冻干燥机中干燥24 h,制备得到催化剂Fe/Ag,将制备的催化剂保存在棕色瓶中。
催化剂的物相分析基于XRD图谱分析[14],通过粉末在X射线衍射中10°~90°范围的衍射情况确定样品的晶体结构。催化剂比表面积分析基于BET测定分析,在仪器上对两种催化剂粉末进行氮吸附测量,以基于Brunauer-Emmett-Teller(BET)模型确定比表面积、孔径分布和孔隙体积。催化剂的晶型结构检测使用SEM,在扫描电子显微镜上检查样品的形态。
1.3 实验装置
实验反应装置如图1所示。自制反应器为圆柱形上流式有机玻璃柱,采用下进上出的进出水方式,其下部为微孔爆气装置,有效容积为1 000 mL。实验前将反应发生器使用去离子水清洗数次,调节氧气瓶阀门控制氧气流量使之稳定在2 L/min。在反应发生器内加入废水和催化剂后通入7.27 mg/L臭氧,通过流量计控制臭氧流量稳定。反应产生的臭氧尾气用碘溶液回收。

图1 臭氧化反应装置图Fig.1 Schematic diagram showing the ozonation reactor setupA.尾气吸收装置;B.反应发生器;C.臭氧发生器;D.流量计;E.氧气瓶
1.4 分析方法
COD的测定采用紫外可见分光光度计[15]。分光光度计在610 nm波长下用1 cm比色皿进行测定。
苯酚浓度采用高效液相色谱法测定[16],通过配备有UV检测器的HPLC(1260 Infinity,Aglient technologies)测量水溶液中的苯酚。HPLC分析在XDB-C18接枝二氧化硅柱(Agilent C18-XDB,250 mm × 4.6 mm × 5 μm)上、柱温20 ℃、固定波长λ=270 nm条件下进行。进样量为20 μL,进样速度为1.0 μL/min,流动相由体积比为7∶3的乙腈和水组成。
苯酚和COD的去除效果通过去除率和反应速率常数K表征。
2 结果与讨论
2.1 催化剂表征结果
2.1.1 XRD
Fe和Fe/Ag样品的粉末XRD衍射图如图2所示。Fe相的相关特征峰对应于JCPDS卡号99-0064,Ag相的相关特征峰对应于JCPDS卡号99-0094。Fe样品中只检测到Fe相,未检测到含铁氧化物相,在44.72°、65.51°和82.35°处显示强衍射峰,分别归入Fe的(110)、(200)和(211)平面。Fe/Ag样品在44.72°、65.29°、82.33°处显示强衍射峰,其中未检测出Ag相的主峰。Luo等[17]在研究中指出,由于物质的低含量或低结晶度,不能检测到其典型衍射峰,并且物质的某些衍射峰强度随着主相含量的增加而增加。推测Fe/Ag样品的Ag负载量较少,XRD图谱为Fe相图谱,未出现本质变化。
2.1.2 BET
通过N2吸附-解吸等温线研究了Fe和Fe/Ag催化剂的结构性质,数据列于表1中。纯铁的比表面积、孔隙体积和孔径分别为5.159 m2/g、0.012 cm2/g和2.708 nm,负载Ag后,比表面积下降了22.8%,孔隙体积下降了50.0%。Fe本身吸附量较小,负载Ag后存在孔隙阻塞和小颗粒附聚的可能性,这倾向于降低比表面积和孔隙体积[18]。BET结果表明Fe有效负载了Ag。
2.1.3 SEM
在高放大倍率下,Fe金属颗粒表面清晰,显示为圆形颗粒,且具有良好的颗粒分散性,观察到大多为单个颗粒分布或较少的附聚。而随着金属Ag负载的加入,Fe的颗粒聚集效应更加明显,孔隙明显减少。这与BET比表面积和孔隙体积结果匹配(图3)。

图3 Fe和Fe/Ag的SEM图像Fig.3 SEM images of Fe and Fe/Ag(a)Fe,5 000倍;(b)Fe/Ag,5 000倍
2.2 不同反应体系下苯酚和COD去除效果分析
2.2.1 投加催化剂的影响
在模拟废水体积为500 mL、pH=6.3的条件下,反应60 min后,对比单独臭氧氧化、投加1.00 g Fe催化剂和投加1.00 g Fe/Ag催化剂的情况下,苯酚和COD的去除效果,并通过监控反应过程中体系pH值的变化,探讨反应中间产物的形成。
投加催化剂和催化剂类型对苯酚和COD去除的影响如表2和图4所示。单独臭氧氧化在中性条件下与目标有机物的反应活性较低,投加催化剂Fe和Fe/Ag后,苯酚和COD去除率有效提高,苯酚去除率分别达到90.4%和99.8%,COD去除率分别达到62.0%和73.2%(图4(a)和(c)),表明催化剂在该臭氧化反应中起着重要作用。三种体系下,一级回归方程的相关系数R2>0.93(表2),较好地符合伪一级反应动力学。与单独臭氧氧化相比,反应速率常数在投加催化剂后有效提高;在投加催化剂Fe/Ag后,苯酚和COD的降解反应速率分别达到单独臭氧氧化的3.6倍和2.2倍(图4(b)和(d)),显示出良好的协同作用。这种效果是催化剂的投加促使O3产生高活性的羟基自由基(·OH)所致[19-20],与王益平等[21]和Hammouda 等[19]分别使用NiO/AC和纳米钴基钙钛矿ACoO3催化臭氧降解苯酚的研究中提出催化剂促进臭氧分解产生·OH,使体系氧化能力显著增强的结论一致。反应60 min后,三种体系的pH值稳定在2.5~3.0之间(图4(e)),这是因为苯酚降解过程中生成小分子酸致使pH下降[22],由于小分子酸难以进一步降解,最终pH值稳定。

图4 单独臭氧氧化与催化臭氧化的影响Fig.4 Effects of ozone oxidation alone and catalyst ozonation(a)对苯酚去除率的影响;(b)苯酚降解反应动力学;(c)对COD去除率的影响;(d)COD降解反应动力学;(e)对pH的影响

表2 单独臭氧氧化与催化臭氧化影响下去除苯酚和COD的反应速率常数(K)
2.2.2 催化剂投加量的影响
前期结果显示Fe/Ag/O3为最优反应体系,在相同的实验条件下,分别投加0.25 g、0.50 g、1.00 g、2.50 g Fe/Ag催化剂,对比分析苯酚和COD的去除效果。
催化剂投加量对苯酚和COD去除的影响如表3和图5所示。随着催化剂投加量的增加,苯酚和COD的去除都首先表现出快速的增加(图5(a)和(c))。在催化剂投加量为2.50 g时,苯酚去除率接近100%,表明催化剂投加量的增加在催化臭氧化降解苯酚过程中起着促进作用。在催化剂投加量为1.00 g时,COD去除率最高,达到74.0%;而继续投加催化剂则显示出COD去除率降低的负面效果。通常情况下,活性组分的增加通过增加活性位点的数目来实现,从而提高催化剂的总体性能。然而,随着活性成分含量的过度增加,对催化剂模拟目标物的降解产生了负面影响,这是因为:(1)更多的活性成分可能会使ROS淬灭;(2)更多的活性成分负载可能会改变催化剂的表面结构和性质[23],进而降低催化活性。在不同催化剂投加量的Fe/Ag/O3体系下,一级回归方程的相关系数R2>0.90(表3),较好地符合伪一级反应动力学。在催化剂投加量为2.50 g时,苯酚与COD去除的反应速率常数均达到最大(图5(b)和(d)),反应前10 min苯酚和COD的去除速率大幅度提高,随后增长变缓并趋于稳定。这是由于随着催化剂投加量的增加,催化剂的表面积增加,反应活性位增多,使得反应体系中生成·OH的机会增大[24-25],从而提高反应速率;随着反应的进行,反应体系中生成的·OH增多,导致其自身发生复合反应,降低反应体系中·OH的有效浓度,从而导致反应速率增长变缓。反应60 min后,不同体系下的pH值稳定在2.5~3.1之间(图 5(e));在Fe/Ag投加量为1.00 g时,pH值最低,可能由于在此投加量下苯酚降解过程中产生的小

表3 Fe/Ag投加量影响下去除苯酚和COD的反应速率常数(K)
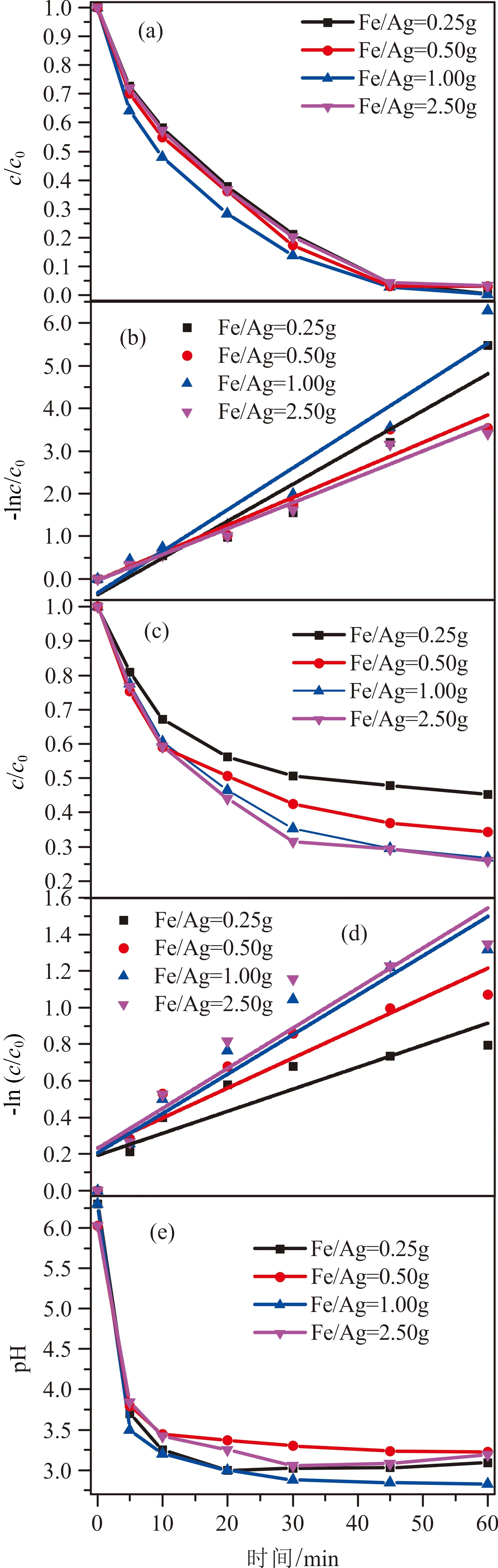
图5 Fe/Ag投加量的影响Fig.5 Effect of Fe/Ag dosage(a)对苯酚去除率的影响;(b)苯酚降解反应动力学;(c)对COD去除率的影响;(d)COD降解反应动力学;(e)对pH的影响
分子酸最多,致使pH下降最多。
2.2.3 初始溶液pH值的影响
前期结果显示Fe/Ag的最佳投加量为1.00 g,在相同的实验条件下,pH对苯酚和COD的去除效果的影响在3.0~11.0的pH范围内进行。
图6显示了pH对苯酚和COD去除的影响。在3.0~11.0的pH范围内,苯酚去除率均达到95.0%以上(图6(a)),且苯酚去除的反应速率常数介于0.080~0.110之间(图6(b)),初始pH对苯酚去除影响甚微,表明本研究的催化剂在催化降解苯酚方面具有适应广泛pH的能力。随着pH的增加,COD去除率有效提高并在pH=6.3(模拟废水原始pH)时达到73.2%的最高值(图6(c)),过高的pH表现出负面效果[26]。一般认为,臭氧具有偶极、亲核和亲电等化学性质,因此在水中很不稳定,部分分解成氧化性能更高的自由基(如·OH)。OH-是诱发O3分解的链式反应的介质[27],因此碱性条件对臭氧分解起着促进作用。由于体系和反应条件的不同,本研究的结果表明,COD去除率并不是在pH值最高时达到最大(图6(d)),其原因在于:在高pH值条件下,·OH大量产生,臭氧分解量增加,在快速的间接反应过程中,污染物降解可能会产生少量的CO32-、HCO3-等阴离子,这些少量的阴离子会对臭氧分解·OH产生抑制作用[28-29]。这一结果表明该体系具有无须调节pH的优势,增强了该体系在实际应用中的可能。在溶液初始pH=3.0的条件下,体系pH的变化呈现出与其他体系不同的规律(图6(e)),反应前5 min内,体系pH值不断上升,这可能是体系pH值动态变化过程的前期变化缓慢,滞后于溶液pH值变化所致。

图6 初始pH对苯酚和COD去除效果的影响Fig.6 Effect of initial pH on the removal of phenol and COD(a)对苯酚去除率的影响;(b)苯酚降解反应动力学;(c)对COD去除率的影响;(d)COD降解反应动力学;(e)对pH的影响
2.3 反应机理的初步探讨
O2-和HO2-是O3链式反应的中间产物,这是OH-能启动O3分解链反应并产生·OH的原因,链式反应中形成的·OH可以彼此结合,生成H2O2[30]。一般研究认为,·OH是反应的主要活性物质[31]。据报道,催化剂表面的气态臭氧分解主要包括两个步骤:臭氧在表面上的吸附和吸附中间体的解吸[32]。在前期催化剂表征的研究中,催化剂吸附对目标污染物的降解影响很小,可排除有机物吸附于催化剂表面进而被水中臭氧氧化降解的可能,由此推测该反应遵从臭氧在催化剂表面的化学吸附导致生成活性物质而降解水中有机物的反应机理[33]。
为了进一步探讨体系的反应机理,在初始pH值为6.3、Fe/Ag投加量为1.00 g的条件下,考虑5种情况,对比反应60 min后苯酚和COD的去除率:(1)不添加自由基捕获剂;(2)添加活性衍生物H2O2捕获剂Fe(Ⅱ)-EDTA;(3)添加·OH捕获剂异丙醇(IPA);(4)添加·O2抑制剂四甲基哌啶(Tempol);(5)同时添加以上三种捕获剂。
未添加自由基捕获剂和添加不同捕获剂的情况下苯酚和COD的去除率(C/C0× 100%)如图7所显示。在添加活性自由基捕获剂的4种情况下,苯酚的去除率与不添加捕获剂相比下降不超过4.0%,苯酚去除率基本不变,表明体系中臭氧浓度较高,臭氧直接降解了苯酚;然而自由基捕获剂的加入能显著降低COD的去除率,在体系中分别加入Fe(Ⅱ)-EDTA、IPA、Tempol及三种自由基捕获剂,COD去除率从73.2%分别下降到62.0%、36.6%、67.6%、25.4%,表明活性自由基对体系中COD去除效率影响的强弱排序为:·OH> H2O2>·O2,这与Von Gunten等人[34]的研究结果一致。在添加不同的活性自由基捕获剂后,体系中COD的去除率没有下降到零有两种原因:(1)体系中较高浓度的臭氧本身直接氧化去除有机物;(2)捕获剂未完全捕获活性自由基,部分残留自由基仍然发挥作用。

图7 投加自由基捕获剂对苯酚和COD去除率的影响Fig.7 Removal of phenol and COD by three different radical traps
3 结 论
(1)通过典型的置换法制备了双金属催化剂材料Fe/Ag,与Fe相比,负载Ag以后催化剂的颗粒聚集效应增强,Fe/Ag比表面积减小了22.8%。
(2)Fe和Fe/Ag的加入均提高了苯酚和COD的去除率,且Fe/Ag催化体现出良好的协同效应,与单独臭氧氧化相比,在Fe/Ag投加量为1.00 g、pH= 6.3的最优反应条件下,反应60 min后苯酚和COD的去除率分别提高了18.4%和29.4%。
(3)Fe/Ag在催化降解苯酚方面具有适应广泛pH的能力,在pH值为3.0~11.0范围内,苯酚去除率均达到95.0%以上。
(4)Fe/Ag相对于Fe比表面减小,但其催化效果更好,这表明催化剂表面吸附不起主导作用;Fe/Ag对苯酚和COD的去除效果在加入·OH、·O2和H2O2的捕获剂后明显削弱,这表明反应遵从臭氧直接作用和自由基作用的机理,其中异丙醇的加入使COD去除率下降50.0%,进一步表明·OH贡献最大。
