“铬”显神通
——过氧化氢环境下三价铬的变化探究
2021-07-14吴嘉璇温瀚韬吴锶敏梁泳彤铁绍龙李玥
吴嘉璇,温瀚韬,吴锶敏,梁泳彤,铁绍龙,李玥
华南师范大学化学学院,广州 510006
铬位于元素周期表中d区第一过渡系列,价态丰富,其化合物颜色多变,化学性质多样,如氧化还原性、配位性和磁性等,是大学基础无机化学重点考察的特征元素。为了更直观地了解铬的物理化学性质,《无机化学实验》《基础化学实验》等教材[1–4]均设计了对铬化合物性质的验证实验,但在进行Cr(III)与过氧化氢反应验证三价铬的还原性的实际操作中,接近一半的学生未得到预期实验结果。通过文献调研发现[5],Cr(III)与过氧化氢的反应是一个复杂但有趣的反应,在不同的反应条件下,生成的产物不同,呈现的溶液颜色不同,即若反应条件控制不当,往往得不到预期结果。因此,本文针对Cr(III)与过氧化氢反应的影响因素进行了探究,对实验结果进行了分析。另外,本文介绍了相关实际应用与趣味实验,以供实验课教学参考。
1 实验仪器及药品
实验仪器:pHS-3C型精密pH计、电子天平、烧杯(5 mL、50 mL、100 mL)、量筒(5 mL、10 mL、100 mL)、试管、离心试管、离心机、胶头滴管、玻璃棒。
实验药品:0.1 mol·L−1硫酸铬溶液、30%过氧化氢溶液、硫酸溶液(2 mol·L−1、4 mol·L−1、8 mol·L−1、浓)、氢氧化钠溶液(2 mol·L−1、4 mol·L−1、8 mol·L−1)。
2 实验步骤及现象
2.1 探究溶液pH对Cr(III)与过氧化氢反应的影响
2.1.1 实验步骤
(1) 室温下,不同pH的Cr(III)溶液的配制:加酸或碱调节0.1 mol·L−1Cr2(SO4)3溶液pH分别为2.00、4.10、5.65、6.75、8.43、10.03、11.72、13.37。
(2) 分别取5 mL上述溶液于8支试管中,然后向其逐滴加入30% H2O2溶液,直至溶液不再发生变化,观察并记录实验现象。
2.1.2 实验现象及结论
不同pH条件下,Cr(III)与30% H2O2的反应现象见图1,并由此分析得出pH对该反应的影响,见表1。
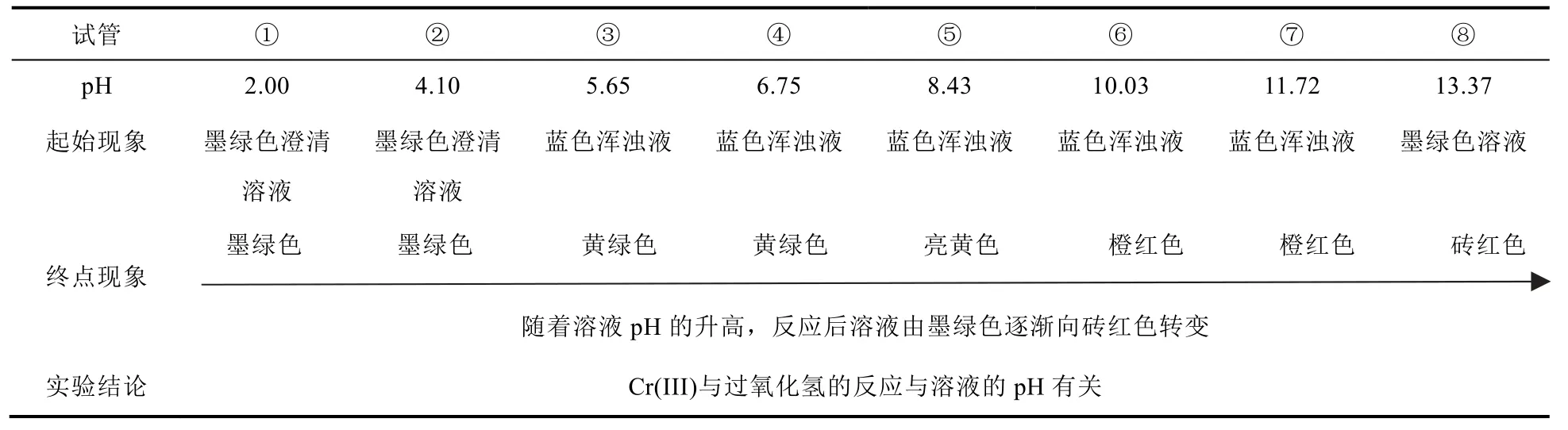
表1 pH对Cr(III)与H2O2反应的影响
2.1.3 实验原理
(1) 滴加30% H2O2溶液前。
查阅资料[6–8]可知:当c[Cr(III)] = 0.2 mol·L−1时,pH = 4.17时开始生成蓝色氢氧化铬沉淀,pH =5.60时沉淀完全,随着pH的继续升高,沉淀会慢慢溶解直至完全。因此,试管①②溶液为墨绿色溶液,试管③–⑦中为蓝色浑浊液,试管⑧溶液恢复墨绿色澄清溶液。
(2) 滴加30% H2O2溶液直至过量。
试管①②中溶液未发生明显变化,即Cr(III)在此环境下不能与H2O2发生反应或者与H2O2反应非常缓慢;试管③–⑤蓝色沉淀都消失,溶液变为黄绿色或黄色,在此过程中可能发生以下反应:
2Cr(OH)3+ 4OH−+ 3H2O2= 2CrO42−+ 8H2O
CrO42−的溶液为黄色,但Cr(III)被H2O2氧化成Cr(VI)的过程中消耗OH−,pH降低,Cr(OH)3溶解生成Cr3+,则出现绿色Cr3+和黄色CrO42−混合后的黄绿色溶液。
试管⑥–⑧溶液呈现橙色或者砖红色,且随着pH增大,溶液颜色越红[9]。可能是在碱性条件下,H2O2酸式解离产生的HO2−进攻Cr(III)O2−的氧化产物Cr(VI)O42−,从而过氧根取代氧配体,并伴随铬的单电子还原,最终形成砖红色的[Cr(O2)4]3−或Cr(V)O83−[9–17]:
2CrO42−+ 7H2O2+ 2OH−= 2CrO83−+ 8H2O
其中,由Cr(V)O83−转化为Cr(V)O83−的可能机理如下[16]:
H2O2+ OH−⇌ HO2−+ H2O
[CrVIO4]2−+ HO2−⇌ [HCrVI(O)4(O2)]3−
[HCrVI(O)4(O2)]3−⇌ [CrVI(O)3(O2)]2−+ OH−
[CrVI(O)3(O2)]2−+ H2O2⇌ [CrVI(O)2(O2)2]2−+ H2O
[CrVI(O)2(O2)2]2−+ H2O2→ [CrV(O2)4]3−+ H2O
值得注意的是,OH−在该反应中至关重要。在酸性条件下,Cr(III)与H2O2反应生成Cr(VI),但未进一步反应生成Cr(V),这可能是与过氧根取代和铬的单电子还原过程有关。研究发现[10,16],铬的单电子还原是发生在三个过氧根取代氧配体后,但在酸性条件下,CrO42−被两个过氧根取代后会发生歧化反应,放出氧气,不能进一步被还原成CrO83−,所以在该条件下,溶液并没有由黄色变为砖红色。而随着OH−浓度增大,一方面OH−在反应中会与HO2−竞争配位Cr离子,从而抑制过氧根与铬离子配位;另一方面,在酸性条件下过氧根与铬配位生成的产物不稳定,容易分解放出氧气,重新生成没有过氧根配位的铬离子,相反,在碱性条件下过氧根铬配合物是稳定存在的。即从动力学上讲,碱性环境对该反应是抑制作用,但同时在热力学上,碱性条件稳定了最终产物,促进了该反应;另外,HO2−的浓度会随着pH的升高而增大。因此溶液碱性越强,[Cr(O2)4]3−或Cr(V)O83−的生成量越多,砖红色越深。
因此,溶液酸碱度的不同,Cr(III)与过氧化氢的反应进行程度不同,产物不同。
2.2 探究H2O2浓度对Cr(III)与过氧化氢反应的影响
通过pH实验的探究发现,当溶液环境为强碱性时,溶液所经历的化学反应最丰富,因此探究H2O2浓度对Cr(III)与过氧化氢反应的影响时,选择pH > 13的Cr2(SO4)3溶液作为该探究反应底物。
2.2.1 实验步骤
将配制的0.1 mol·L−1Cr2(SO4)3溶液的pH调至13.50后,分别取3 mL该溶液至6支试管中,然后向其逐滴加入浓度分别为3%、8%、13%、18%、23%、30%的H2O2,观察并记录每滴后的试管中的实验现象(图2),并由此分析出H2O2浓度对该反应的影响,见表2。

表2 反应物浓度对反应的影响

图2 Cr(III)与不同浓度H2O2反应的实验现象(pH = 13.50)
2.2.2 实验原理
随着过氧化氢浓度的增加,Cr(III)与过氧化氢的氧化还原反应趋向完全,生成物的颜色由亮黄色不断加深至砖红色。值得注意的是,无论3%的H2O2过量多少,溶液都停留在亮黄色,不能进一步反应生成砖红色物质。在pH = 13.50时,Cr(III)与过量的不同浓度过氧化氢发生以下化学反应[9,10]:
Cr3++ 3OH−= Cr(OH)3↓
Cr(OH)3+ OH−= CrO2−+ 2H2O
2CrO2−+ 3H2O2+ 2OH−= 2CrO42−+ 4H2O
2CrO42−+ 7H2O2+ 2OH−= 2CrO83−+ 8H2O
2.3 探究温度对Cr(III)与过氧化氢反应的影响
2.3.1 实验步骤
分别取3 mL浓度实验中配制的pH = 13.50 Cr2(SO4)3溶液于5支试管中,并将其分别置于0 °C、25 °C、50 °C、75 °C、100 °C的水浴中,然后向试管中各滴加过量30% H2O2溶液,观察并记录实验现象(如图3),并由此分析温度对该反应的影响,见表3。

图3 Cr(III)与30% H2O2在不同温度下反应的实验现象(反应时间t = 30 min)

表3 温度对Cr(III)与30% H2O2反应的影响
2.3.2 实验原理
由以上实验结果可知,随着反应温度的升高,反应后溶液颜色由红棕色向亮黄色转变。反应过程与浓度实验相同,但生成的红色物质CrO83−不稳定,随着温度的上升会逐渐分解为亮黄色的CrO42−[14,16,18]。值得注意的是,生物体内因过量过氧化氢导致生成的红色物质CrO83−被认为是造成生物体内DNA损伤的重要祸首[19]。
4CrO83−+ 2H2O = 4CrO42−+ 4OH−+ 7O2↑
综上三个实验的探究可得,Cr(III)与过氧化氢的反应产物与溶液的酸碱度、过氧化氢浓度和反应温度密切相关,反应条件不同,化学反应过程不同,中间产物和最终产物也不同,因此,二者的反应溶液呈现出丰富的颜色。
3 铬离子转化关系与小结
结合以上探究结果以及文献调研[5],我们对铬离子的转化关系进行了归纳,提出了图4的铬离子转化关系图。相应的化学反应方程式如下:

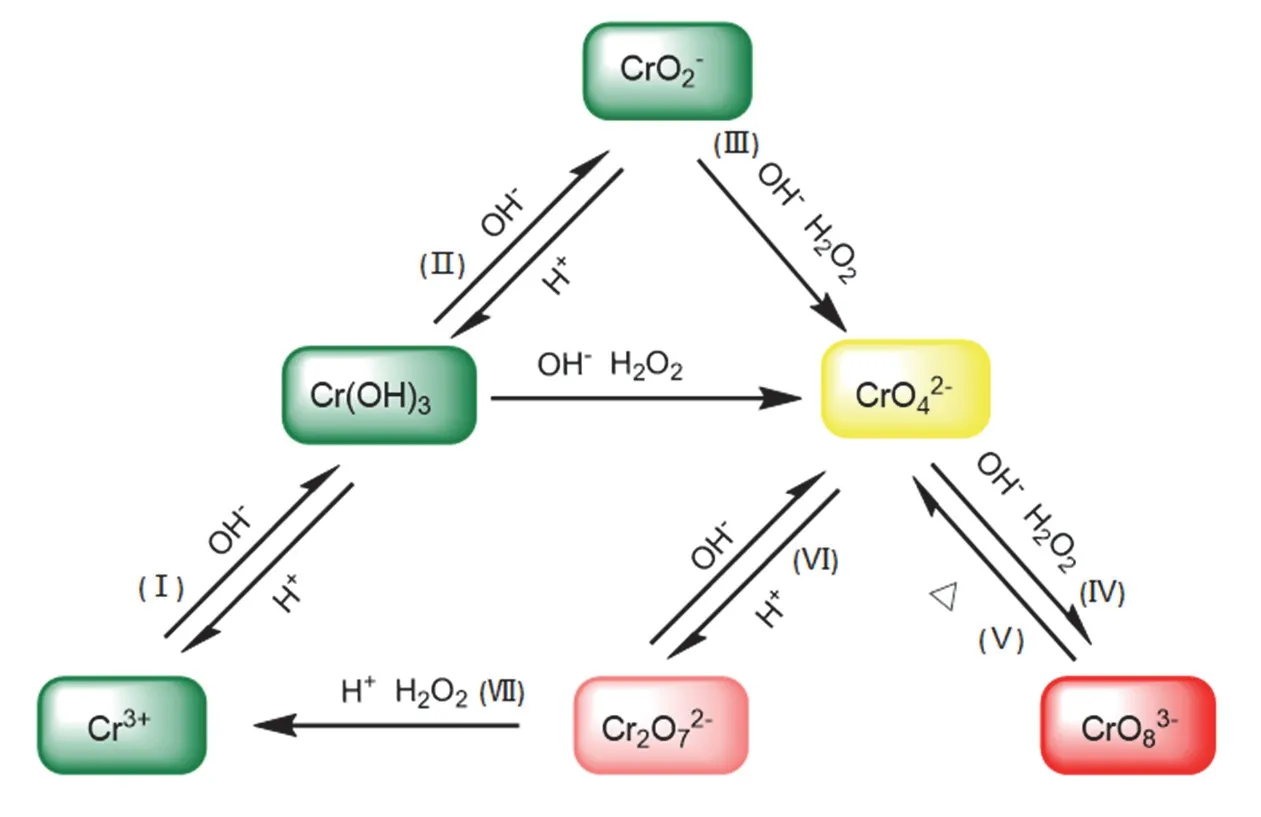
图4 铬离子转化关系图
在强碱条件下,Cr3+与OH−首先反应生成沉淀Cr(OH)3,氢氧化铬与过量的OH−进一步发生反应,生成CrO2−;而墨绿色的CrO2−在该环境下能与H2O2反应生成黄色的CrO42−,也可能反应生成砖红色的CrO83−。针对这一过程的探究结果可总结如下:
(2) 不同pH条件下,该反应进行程度不同。随着pH的增大,Cr3+与H2O2由强酸下不反应,到逐渐能够反应生成黄色的CrO42−,再到碱性条件下,可进一步生成砖红色的CrO83−。
在该反应中,OH−至关重要,因为在碱性条件下,H2O2酸式解离产生的HO2−进攻CrO2−的氧化产物CrO42−,从而过氧根取代氧配体,伴随铬的单电子还原,才最终形成砖红色的CrO83−,因此溶液的pH是影响该反应的重要因素。
(3) H2O2的浓度也是影响该反应的因素之一。过量的低浓度H2O2与Cr3+反应只能停留在黄色的CrO42−这一步骤,但高浓度H2O2可与Cr3+进一步反应生成砖红色的CrO83−,可能是因为低浓度的过氧化氢配位能力较弱,无法与Cr(VI)配位,从而进行下一步反应。
(4) Cr3+与H2O2的反应与反应温度有关。由于砖红色的CrO83−对热不稳定,因此随着温度的上升会逐渐分解为亮黄色的CrO42−。
4 相关应用及趣味实验
4.1 相关应用
碱性环境中,Cr3+很容易被H2O2氧化为CrO42−。因此,利用H2O2处理Cr3+是一种环境友好型技术,在节能、资源综合利用效率和环境污染等方面具有显著优势。
4.1.1 处理镀铬溶液的Cr3+[20]
镀铬溶液加入双氧水,在通电的条件下,镀液中Cr3+含量下降;而不通电时,Cr3+含量上升。利用该现象和原理,通过控制通电时双氧水的量、温度、阳极电流密度等实验条件,实现双氧水对Cr3+含量的调节。
4.1.2 铬的快速测定方法[21]
1.推动“三变”改革。以农民为中心,强化农民主体地位,以敢为人先、锐意突破、实事求是的“小岗精神”推动“资源变资产、资金变股金、农民变股东”的“三变”改革。“三变”改革的前提要摸清农村集体资产的家底,做好清产核资、确权颁证工作,盘活农村资源资产,探求农村集体经济新的实现形式和运行机制。引导农民以土地、参股、手艺参股集体经济,盘活闲置的农村宅基地和民房,开展民俗、民宿为主的乡村旅游,增加农民财产性收入,积极发展农业产业化经营联合体,健全利益联结机制与分享机制,带动农民共同富裕。[6]
在生活中对天然和人造革中的铬进行快速测定时,先用30%的过氧化氢和浓硫酸的混合物分解皮革至透明溶液,再用高锰酸钾溶液将三价铬氧化为六价铬;或者用硝酸和硫酸分解皮革中的有机物,再用氯酸钾氧化三价铬为六价铬。获得溶液中的六价铬浓度再用碘量法或滴定法测定,从而实现对化合物中铬的测定。
4.2 相关趣味实验
受上述探究启发,我们设计了下列趣味实验可以吸引学生的注意力,提高学生的学习兴趣,帮助学生理解课堂教学内容,加强学生对铬的化合物之间相互转化原理的理解,强化理论认知。
4.2.1 自制过氧化氢浓度试纸
将滤纸浸没在一定浓度的硫酸铬的强碱性溶液中,待完全浸透后取出晾干。滤纸剪成条状,向其滴加不同浓度的过氧化氢溶液,根据其呈现的颜色变化,分辨出不同浓度的过氧化氢溶液。由于过氧化氢易挥发,在测试过程中要注意快速蘸取。
4.2.2 会变色的字
蘸取30%的过氧化氢溶液在4.2.1小节中制得的滤纸上写字,呈红色,再及时将试纸用吹风机稍加热,字可由红色变为亮黄色。如果再蘸取1–2次30%的过氧化氢溶液,实验现象会更明显。
4.2.3 会膨胀的气球
在试管中加入适量0.1 mol∙L−1硫酸铬溶液,将硫酸铬溶液的pH调节至强碱性,加入过氧化氢溶液,溶液从墨绿色变为砖红色。在试管口套上一个气球,将试管放入80 °C的水中,气球从干瘪变膨胀。
4.2.4 温度监控器
在试管中加入适量0.1 mol∙L−1硫酸铬溶液,将硫酸铬溶液的pH调节至强碱性,加入过氧化氢溶液,溶液从墨绿色变为砖红色。将该试管放入所要测定的热溶液中,若溶液变成亮黄色则达到设定温度。
4.3 知识卡片
为了给学生完整的、科学的实验操作训练,我们设计了下方的知识卡片(图5),简单介绍了铬的理化性质、注意事项和处理铬废液的方法[22]。

图5 铬的知识卡片
5 结论和意义
本文探究了pH、反应物浓度以及反应温度等因素对Cr(III)与过氧化氢反应的影响,并提出了可能的反应机理。实验结果表明,该反应过程复杂,实验条件不同,实验现象不同。因此,在学生进行验证实验时,应严格控制实验条件,方可得到预期结果。另外,本文在探究实验的基础上,介绍了实际应用,延伸出相关趣味实验,便于学生对于铬的化合物氧化还原反应原理的理解,提高学习兴趣,以供教学参考。
