易漏诊的胃底腺黏膜型胃癌并纯胃底腺型胃癌1例
2021-07-14沈凯徐静於亮亮
沈凯 徐静 於亮亮
胃底腺型胃癌(gastric adenocarcinoma of fundic gland type,GAFG)是指类似胃底腺细胞的低异型度分化型腺癌,其免疫组化染色Pepsinogen Ⅰ和/或H+/K+-ATPase阳性。2019 年WHO第五版消化道病理指南将位于黏膜层的胃底腺肿瘤命名为泌酸腺腺瘤,浸润至黏膜下时才定义为GAFG,分为主细胞为主、壁细胞为主和混合型。日本学者Ueyama 等[1]进一步将广义胃底腺型胃癌分为纯的胃底腺型胃癌(pure gastric adenocarcino⁃ma of fundic gland type,p-GAFG)和胃底腺黏膜型胃癌(gastric adenocarcinoma of fundic gland mucosal type,GAFGM),前者预后较好,后者侵袭性强,有不同的临床病理学特点。现将1 例GAFGM 合并p-GAFG的罕见病例报道如下。
1 临床资料
患者男,66 岁,因体检行胃肠镜检查。既往母亲、弟弟均有胃印戒细胞癌病史。体格检查、实验室检查、腹部CT 增强、肺部CT 平扫、肠镜等检查均无异常。胃镜提示:胃底见2 枚直径0.5~0.6 cm 息肉,近贲门处息肉表面光滑(见封三图5),近大弯处息肉表面充血伴血痂(见封三图6)。活检病理均提示胃底腺黏膜伴小凹上皮增生。遂行内镜下黏膜切除术治疗。术后病理:(胃底近贲门)胃底腺息肉;(胃底近大弯)胃底腺型胃癌,免疫组化染色Pepsinogen Ⅰ、H+/K+-ATPase、MUC6、β-catenin 膜染色阳性,MUC5AC 阴性,浸润深度>1 000 μm,基底切缘和侧切缘无法评估(见封三图7)。因胃底近大弯处GAFG 为非治愈性切除,后行外科近端胃切除术。术后病理:胃底近大弯处瘢痕未见癌组织残留。反复重切后意外发现胃底近贲门处瘢痕的黏膜下层见少量结构异型腺体,考虑高分化腺癌(见封三图8),结合免疫组化染色显示MUC5AC(见封三图9)、Pepsinogen Ⅰ(见封三图10)、MUC6、β-catenin 膜染色阳性,H+/K+-ATPase 阴性,考虑胃底腺黏膜型胃癌。于是再次重切此处的内镜下黏膜切除术的标本,可见胃底腺区域有少量结构异型腺体,免疫组化显示MUC5AC、Pepsinogen Ⅰ、MUC6、β-catenin 膜染色阳性,H+/K+-ATPase 阴性,符合GAFGM。综上所述这是一例有2 处病灶的GAFG,其中胃底近大弯处病灶为p-GAFG,而近贲门病灶为少见的GAFGM。
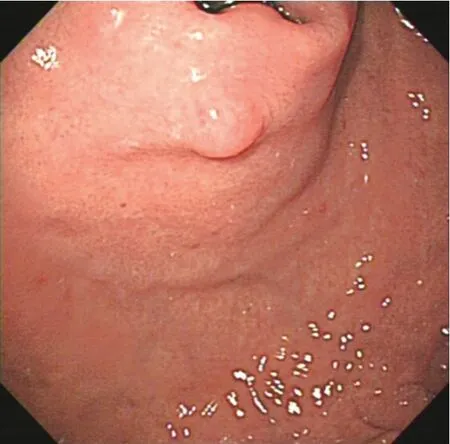
图5 胃底近贲门处病灶
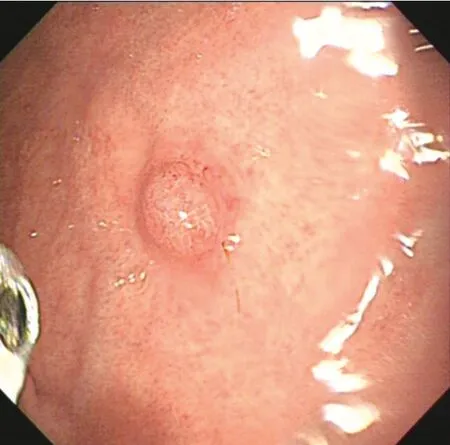
图6 胃底近大弯处病灶
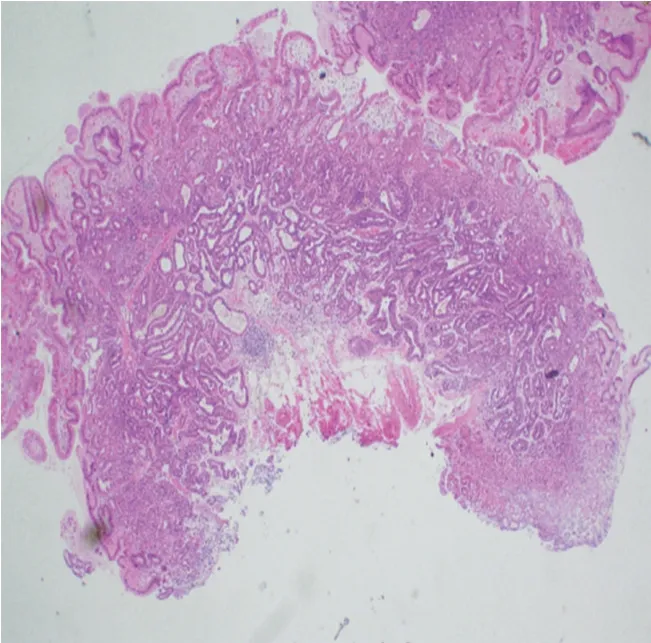
图7 胃底近大弯内镜下黏膜切除术术后病理(HE染色,×40倍)

图8 胃底近贲门外科近端胃切除术术后病理(HE染色,×40倍)
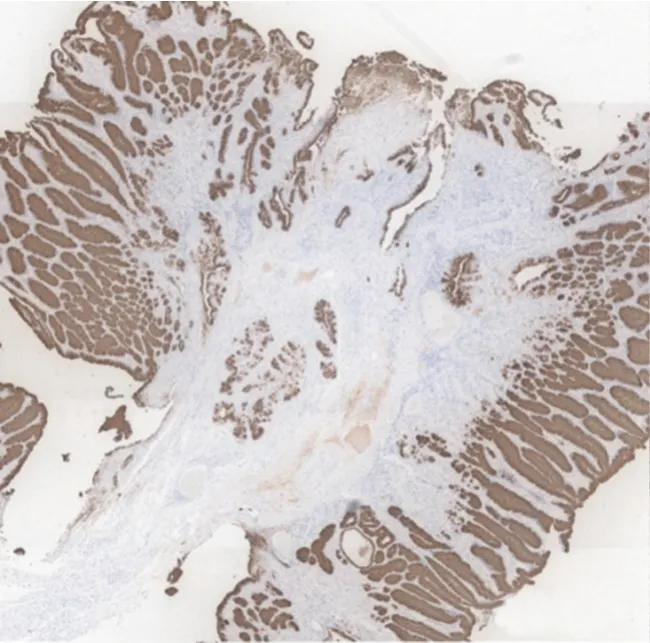
图9 胃底近贲门处黏膜下层病理(免疫组化染色,×40倍)
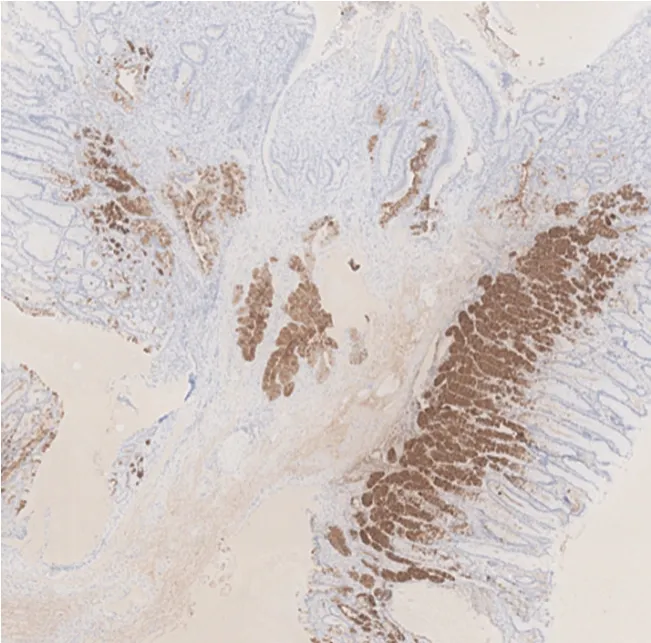
图10 胃底近贲门处瘢痕的黏膜下层病理(免疫组化染色,×40倍)
2 讨论
2007 年日本Tsukamoto 等[2]首次报道胃底腺主细胞分化的胃癌,2010 年Ueyama 教授等[3]将其命名为胃底腺型胃癌-主细胞型。2018 年Ueyama 教授团队[1]进一步提出将广义GAFG 分为p-GAFG 和GAFGM,前者肿瘤组织仅模拟胃底腺分化,预后好,后者还有模拟小凹上皮分化的成份,预后差。相对p-GAFG 而言,GAFGM 多呈凹陷性,平均肿瘤直径更大,浸润深度更深,更容易发生脉管浸润,免疫组化染色可见MUC5AC、MUC6 阳性的肿瘤细胞分化更占优势。GAFGM 分为3 型,1 型为模拟小凹上皮分化的肿瘤成份和模拟胃底腺分化的肿瘤成份,界限清晰,呈分层结构,免疫组化可见MUC5AC 染色阳性的肿瘤成份位于黏膜表层,MUC6、Pepsinogen Ⅰ或伴H+/K+-ATPase 染色阳性的肿瘤成份位于深层,此型预后相对较好。2 型为模拟两种分化的肿瘤成份混合均匀并侵犯黏膜全层,此型预后最差。3 型为模拟两种分化的肿瘤成份均匀混合并局限在黏膜深层或黏膜下层,此型恶性度居中,相对少见,因为在肿瘤表面覆盖了正常上皮,因此,3 型临床诊断最难[4]。
本次病例胃底靠近大弯侧病灶为p-GAFG,诊断相对容易。白光下可见表面存在小凹边缘上皮拉长等微结构的异常表现。苏木精-伊红染色病理图可见病灶表面存在小凹深浅不一,窝间部宽窄不同等表面微结构异常的表现,和内镜下表现一致,而且胃底腺区域的腺体拉伸、扭曲、共壁等结构异型较为明显,病理上也不易漏诊。而靠近贲门侧病灶为GAFGM,诊断很难。首先,内镜下此病灶为胃底腺息肉样外观,表面光滑,无结构异型和血管扩张;其次肿瘤腺体量少,EMR 标本和外科术后标本都是经过重切才发现少量结构异型的腺体,极易漏诊;最后,肿瘤腺体不仅核异型度低,结构异型也不够典型,其黏膜下的肿瘤腺体主要表现为肿瘤细胞挤向腔内、呈乳头样凸起,仅靠苏木精-伊红染色,诊断非常困难,需要很有经验的病理医生,结合免疫组化,才能进一步确定它是GAFGM。因此,此处病灶的诊断对病理医生也是一项巨大的挑战。结合内镜、病理表现,本次病例此处病灶应该是3 型的GAFGM,因肿瘤组织较少且局限在黏膜固有层和黏膜下层,表面覆盖正常上皮,是诊断困难的主要原因。
本次报道的患者为双发GAFG 病灶,查阅文献,国内外偶有双发病灶的报道[5,6]。日本学者Watanabe等[7]还报道了1 例有3 处病灶的GAFG。但GAFGM合并GAFG 出现的情况在国内外尚属首例。一般胃癌的发生都是多基因、多信号通路参与的过程。因患者有胃癌家族史,故推测遗传相关的某些胃癌基因或信号通路可能与GAFG 多发有关。Nomura 等[8]研究认为GAFG 中GNAS 基因参与的Wnt/β-catenin 信号通路具有一定的特异性,而GNAS 基因突变在普通胃腺癌中少见,其研究中的β-catenin 细胞核染色阳性率可高达80%。但本例β-catenin 染色仅细胞膜阳性,查阅文献,部分研究确实存在只有细胞质和细胞膜染色的情况,细胞核染色阳性率并不高[9,10]。
从临床治疗来看,1 型GAFGM 预后较好。采用内镜下黏膜切除术或内镜下黏膜剥离术将病灶完整切除后1型GAFGM可同p-GAFG 一样随访。2 型预后较差,Okumura 等[11]报告了一例浸润胃壁全层并伴脉管、淋巴结转移的GAFGM。此型往往形态呈Ⅱc 样,肿瘤直径大,浸润深度更深,内镜下不易跟未分化癌、MALT 淋巴瘤、淀粉样变等疾病鉴别。因肿瘤核异型度低,深挖活检或大块活检的诊断价值高于EUS-FNA。此型临床一旦确诊,建议积极手术治疗。3 型虽然恶性程度居中,但临床也有合并未分化肿瘤成份的个案报道[12]。再加此型肿瘤表面覆盖正常上皮,边界和深度判断难,若行内镜下黏膜切除术治疗很容易出现切缘阳性等情况。Uchida等[13]报道了一例仅局限在黏膜下、内镜下黏膜切除术术后才确诊的GAFGM,因切缘阳性,而追加了外科手术。而本次病例也是因为追加手术才意外发现近贲门的GAFGM病灶。如果按照自然病程,此处肿瘤可能会经过多年增殖、隆起较为明显时才被发现,此时肿瘤往往浸润较深、并可伴随未分化成份,行内镜下黏膜切除术/内镜下黏膜剥离术治疗很容易出现非治愈性切除的情况。再加上目前内镜医生和病理医生对GAFGM认识不足,因此外科手术可能是治疗GAFGM 的首选,尤其2 型和3 型GAFGM,若内镜下黏膜切除术/内镜下黏膜剥离术术后有非治愈系性切除的情况,建议积极追加外科手术。
综上所述,GAFGM 是广义GAFG 中的一种亚型,临床和病理诊断都有一定难度,而且病灶侵袭性强,预后差,不能当做p-GAFG 来处理,内镜医生和病理医生都需要进一步提高对本病的认识。
