基于倾向性评分匹配法的血浆D-二聚体升高与新型冠状病毒肺炎重症化相关性研究
2021-07-13李莎莎李风成高学武王金玲
徐 静,李莎莎,李风成,高学武,王金玲,姜 宁,谭 林
新型冠状病毒肺炎(coronavirus disease 2019,COVID-19)是由严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)感染引起的急性呼吸道传染病。患者早期症状主要为发热、干咳、乏力,少数患者以呕吐、腹泻等消化道症状为主,重症患者多在发病1周后出现胸闷、呼吸困难、呼吸窘迫,严重者可快速进展为急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)和感染性休克。Guan等[1]报道进入ICU治疗的 COVID-19重症患者28 d病死率高达 61.5%。因此寻找与COVID-19重症化相关的因素,避免轻症向重症发展对 COVID-19患者的救治至关重要。有关COVID-19患者的尸检病理已证实大多数死亡病例中存在系统性微血管血栓形成[2]。既往已有学者提出血浆D-二聚体(D-dimer, D-D)水平升高与COVID-19的严重程度有关[3],但大多数研究都是简单地提及 COVID-19 患者D-D水平升高或者非动态分析D-D水平变化。本研究重点关注血浆D-D水平,分析其与COVID-19重症化之间的动态关系,以期指导临床早期发现重症病例,早期治疗。
1 资料与方法
1.1 资料来源 本研究为回顾性调查性研究。研究资料来自2020年1月20日—2月8日在阜阳市第二人民医院住院治疗的COVID-19确诊患者的临床资料。纳入标准:SARS-CoV-2核酸检测2次阳性;住院时间长于1周,且临床资料完整。本研究获得阜阳市第二人民医院伦理委员会批准(202000303006),因突发重大公共卫生事件豁免知情同意。
1.2 相关定义 患者病情严重程度分级标准参考国家卫生健康委员会发布的《新型冠状病毒肺炎诊疗方案(试行第六版)》[4],分为轻型、普通型、重型和危重型。基础疾病定义为以下疾病至少有1种且已确诊半年以上:高血压、糖尿病、心脑血管疾病、慢性呼吸系统疾病、慢性肝病、贫血或肿瘤。疾病重症化定义为入院1周内从轻型/普通型进展至重型/危重型。血浆D-D持续升高定义为入院后5 d之内的持续升高。
1.3 数据采集及分析 回顾性分析所有实验室确诊的COVID-19患者的临床电子病历、护理记录、实验室检查结果和放射学检查结果。收集资料包括年龄、性别、吸烟史、饮酒史、基础疾病史、流行病学史、生命体征、临床分型、生化指标,包括淋巴细胞绝对值、D-D水平、ALT、AST、TBIL、ALP、γ-谷氨酰转肽酶(γ-glutamyl transpeptidase, GGT)、CRE、LDH。采用中国食品药品监督管理局批准的实时RT-PCR方法,对呼吸道标本(包括鼻咽拭子或痰标本)进行流感、副流感病毒检测。所有患者均行胸部CT检查。
1.4 临床治疗措施 患者住院后均给予相应治疗,具体如下。呼吸支持:吸氧或机械通气。药物治疗:α-干扰素(500万U,2次/d,雾化吸入),洛匹那韦/利托那韦(200 mg/50 mg/粒,2粒/次,2次/d,口服)。症状严重者,根据临床特点选择性给予口服或静脉注射抗生素(莫西沙星、哌拉西林钠他唑巴坦钠、美罗培南)、甲基强的松龙[1~2 mg/(kg·d)]、丙种球蛋白、莲花清瘟胶囊、血必净。对于呼吸衰竭、休克或多器官衰竭的患者,在ICU实施包括体外膜肺氧合在内的生命支持措施。
1.5 统计学处理 描述性分析中,符合正态分布的计量资料以±s表示,2组间比较采用Students't检验;不符合正态分布的计量资料以中位数和四分位数[M(P25,P75)]表示,2组间比较采用Mann-WhitneyU检验;多组间比较采用方差分析,进一步两两比较采用Tukey's多重比较检验。计数资料比较使用χ2检验或Fisher确切概率法,均采用双侧检验。由于样本量差别大,且基线不齐,变量多而样本量偏少,不适合直接使用多因素分析,故采用倾向性评分匹配以消除潜在的混杂因素。具体方法为使用多因素Logistic回归分析2组间有差别的指标对于疾病进展的作用,并计算倾向性评分,采用卡尺内最近邻匹配,根据倾向性评分进行匹配(比例设置为1∶2)。生存分析使用Kaplan-Meier 曲线表示,统计学差异使用Logrank及单因素CoX风险比例回归进行检验。P<0.05为差异有统计学意义,采用R语言进行统计分析(http://www.r-project.org/)。
2 结 果
2.1 患者的基线资料 我院收治的115例COVID-19患者中,13例临床资料缺失,予以排除,最终纳入102例确诊患者。102例COVID-19确诊患者中,中位年龄为42.2(31.7,49.6)岁,其中60例(58.8%)为男性,19例(18.6%)存在基础疾病,6例(5.9%)有吸烟史,7例(6.9%)有间断饮酒史,74例(72.5%)有流行病学史。根据血浆D-D变化情况将患者分为D-D不升高组(85例)及D-D持续升高组(17例),组间比较结果显示,相对于D-D不升高组,D-D持续升高组患者的年龄更高,其中年龄>50岁的患者占58.8%,淋巴细胞绝对值更低,LDH水平更高(P均<0.05)。另外,D-D持续升高组有8例(47.1%)患者出现了重症化,D-D不升高组有7例(8.2%)出现重症化,差异有统计学意义(P<0.05)。2组在性别、合并基础疾病、ALT、AST、TBIL、ALP、GGT及CRE水平方面比较,差异均无统计学意义(P均>0.05)(表1)。

表1 COVID-19确诊患者的临床特征Table 1 Clinical characteristics of patients with confirmed COVID-19
2.2 倾向性评分匹配 使用多因素Logistic回归计算2组患者的倾向性评分,对2组患者的年龄、淋巴细胞绝对值及LDH分别进行匹配(图1),最终获得51例患者,D-D不升高组34例(66.7%),持续升高组17例(33.3%)。匹配成功后2组间比较,结果显示D-D持续升高组患者的重症化比例高(P<0.05),其他临床特征差异无统计学意义(P均>0.05)(表2)。
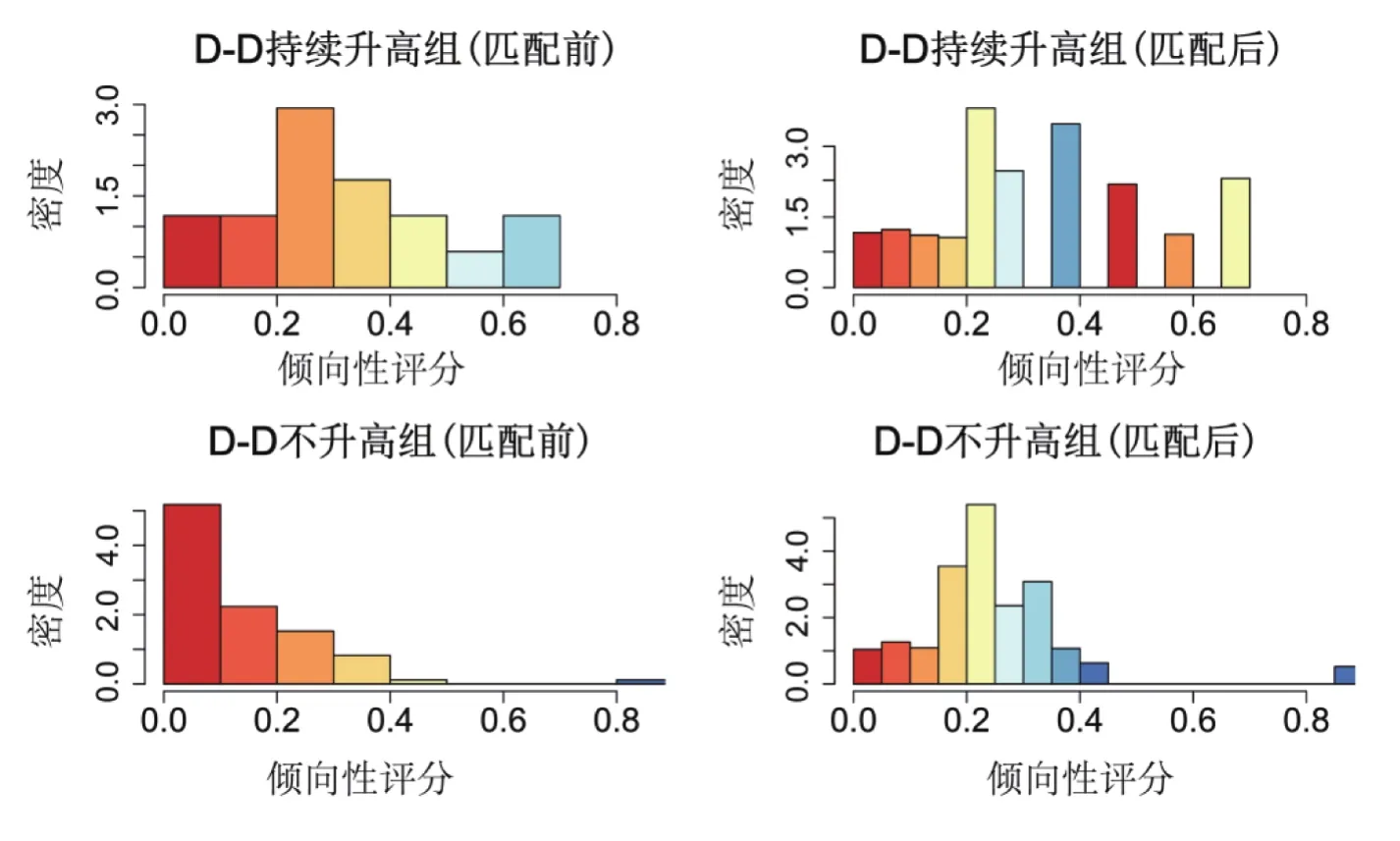
图1 匹配前后2组倾向性评分的分布直方图密度代表患者数,颜色代表每例患者倾向性评分的具体得分,评分原则:采用多因素Logistic回归校正表1中显示的2组不均衡因素(年龄、淋巴细胞绝对值及LDH),并且采用“Logit”模型计算个体进入处理组的概率(倾向值PS),采用最邻近匹配按1∶2进行匹配Figure 1 Distribution histogram of propensity scores before and after matching in 2 groups
表2 倾向性匹配后患者的临床特征分析Table 2 Clinical characteristics analysis of patients after propensity matching
2.3 生存分析 匹配成功后D-D持续升高组有8例(47.1%)患者病情重症化,D-D不升高组中有4例病情重症化(11.8%),2组比较差异有统计学意义(χ2=6.007,P=0.014)。Kaplan-Meier曲线对数秩检验(Log-rank 检验)差异也有统计学意义(χ2=6.900,P=0.009),单因素CoX风险比例回归分析结果显示D-D持续升高是疾病重症化的独立风险因素,其HR为4.372(95%CI:1.313~14.556)(图2)。
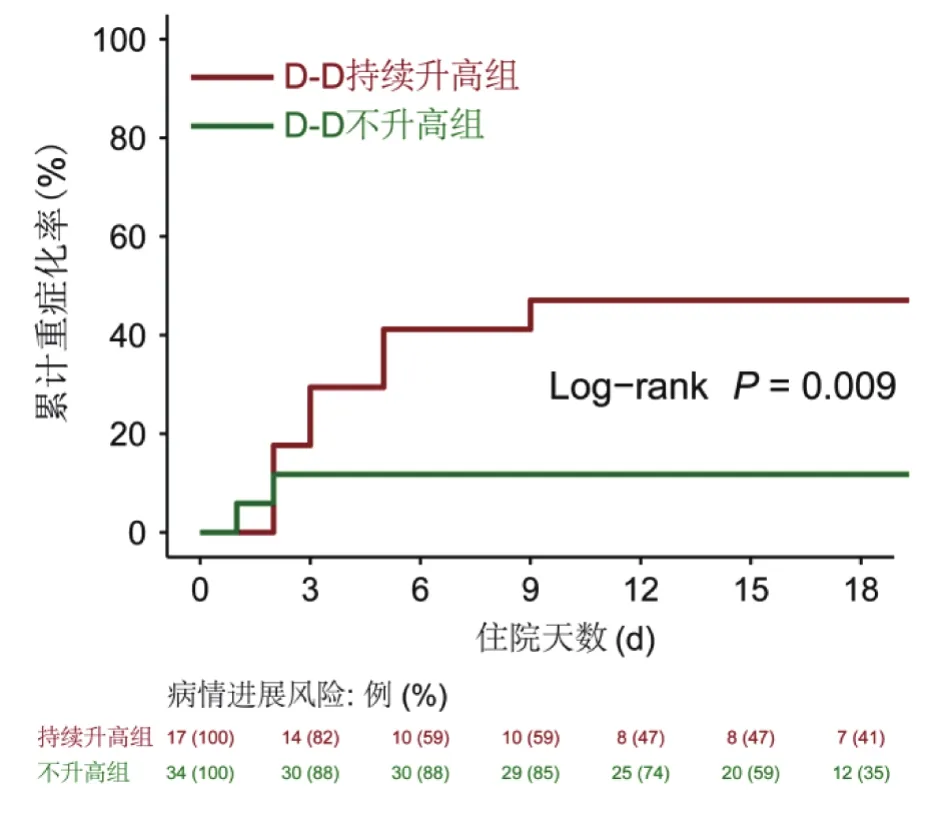
图2 D-D对COVID-19进展的生存分析Figure 2 Survival analysis on COVID-19 progression using D-D
3 讨 论
COVID-19患者早期即可出现严重的急性呼吸道感染症状,一些患者迅速发展为ARDS、急性呼吸衰竭,且合并其他严重并发症,重症化比例高达30%[5]。据研究报道COVID-19患者从入院到进展至ARDS的时间可短至2 d,病情变化快,病死率超过10%[5-6]。快速的病情变化及较高的重症化比例,不仅导致了高病死率,而且意味着占据更多医疗资源,在目前全球疫情持续蔓延的情况下,无疑给疫情防控及治疗带来了巨大的压力。因此,早期发现可能进展至重症的病例,及时阻止疾病进展至关重要。本文通过回顾性研究,探索COVID-19重症化的相关因素,以期指导临床更早地发现有重症倾向的患者,给予及时有效的治疗干预,预防病情发展至重型,改善患者预后,节约医疗资源。
血浆D-D是纤维酶水解所产生的一种特异性降解产物,能反映出机体纤维蛋白溶解功能,通常于机体高龄状态和存在继发性纤维蛋白溶亢进时升高[7]。目前测定D-D已应用于各种临床实践,其在排除诊断下肢深静脉血栓形成和肺栓塞中的应用价值已得到充分肯定[8-9]。本研究回顾性分析了COVID-19患者的各种临床指标,并对其进行倾向性匹配和生存分析,最终发现血浆D-D持续升高组的患者有更高的重症化比例,且D-D水平持续升高是该病进展的独立风险因素。Chen等[6]对99例武汉市COVID-19患者的流行病学和临床特征进行回顾性分析,发现有36例D-D水平升高,但并未做进一步分析。Huang等[5]分析了武汉市COVID-19患者的临床特征,发现与未入住ICU的轻症患者相比,入住ICU的重症患者血浆D-D水平明显升高[0.5(0.3~0.8)mg/Lvs.2.4(0.6~14.4)mg/L],表明病情进展至重症的患者可能存在D-D水平持续升高。Zhang等[10]指出入院时D-D>2.0 g/ml(增加4倍)可有效预测COVID-19患者的院内病死率,认为D-D可能是一种有助于改善COVID-19患者管理的早期标志物。SARS-CoV-2感染还对患者体内凝血系统产生了一定的影响,重/危重型患者体内 D-D升高程度较轻型和普通型患者明显[11]。重症COVID-19患者D-D升高的程度与深静脉血栓形成呈正相关[12]。Connors等[13]指出重症COVID-19患者由于机体对病毒的炎症反应导致血栓性炎症和深静脉血栓形成,且这些患者大都伴有D-D水平的升高。可见深静脉血栓形成可能与病情加重相关,而D-D水平升高或许能够反映COVID-19患者深静脉血栓形成,这或许是重症COVID-19患者D-D水平升高的原因。与SARS-CoV一样,SARS-CoV-2可能主要作用于淋巴细胞,尤其是T淋巴细胞,病毒颗粒通过呼吸道黏膜传播并感染其他细胞,在体内诱发细胞因子风暴,产生一系列免疫反应,并引起外周血白细胞和免疫细胞的变化。COVID-19患者发生细胞因子风暴与肺部炎症及广泛的肺损伤有关,机体会迅速进展至ARDS和败血性休克,最终导致多器官功能衰竭[6]。而当机体存在细胞因子风暴时,D-D水平明显升高,D-D水平与细胞因子风暴的严重程度相关[14-15],这可能是D-D水平持续升高与COVID-19重症化相关的原因。
另外,本研究结果也显示了相对于D-D不升高组,D-D持续升高组患者年龄更高,淋巴细胞绝对数更低,LDH水平更高,由于样本量不大,未能进行多因素分析,结合既往的研究,考虑上述3个因素也是疾病进展的风险因素[1,6,16],但需要获得更多的临床数据进行多因素分析后才能明确。
总之,COVID-19患者病死率高,本研究通过倾向性匹配,消除混杂因素的影响,采用生存分析与单因素CoX风险回归分析后,明确了血浆D-D的持续升高与COVID-19重症化相关,可以早期预警疾病的进展风险,有助于改善患者预后,极大地节约紧张的医疗资源。
