停用核苷(酸)类药物后诱发HBV相关慢加急性肝衰竭的临床特征及远期预后分析
2021-07-13石新星曾义岚
石新星,王 林,张 鸿,黄 亮,曾义岚
慢性乙型肝炎(chronic hepatitis B, CHB)是一种因HBV感染而引起的肝脏炎症、肝纤维化的慢性疾病。应用核苷(酸)类药物[nucleos(t)ide analogues, NAs]持续治疗后,多数患者的HBV DNA水平、肝细胞炎症和纤维化等可得到有效控制[1-2]。尽管NAs是多数患者抗HBV治疗的主要选择,但由于多方面因素影响,患者可能会出现不规则停药现象。一项有关CHB患者停用恩替卡韦的研究发现,因未达到停药标准而停药的患者肝炎复发率高达80%,且有部分患者诱发了HBV相关慢加急性肝衰竭(HBV related acute-on-chronic liver failure, HBV-ACLF),预后较差[3]。由于NAs可抑制HBV DNA复制,但难以清除病毒持续复制的来源——松弛环状双链DNA(covalently closed circular DNA, cccDNA),在尚未恢复HBV特异性的细胞免疫反应时停止使用NAs,HBV DNA会急速复制,机体免疫应答被迅速激活,对肝细胞造成严重的免疫损伤,进而诱发肝炎[4]。当前,有关CHB患者停用NAs后诱发HBV-ACLF的临床特征及远期预后分析尚缺乏大样本量的研究,有关影响HBV-ACLF患者的预后因素研究可能存在一定的偏倚。基于此,本研究通过对1164例CHB患者的临床资料进行分析,旨在探究CHB患者停药后诱发HBV-ACLF的临床特征及预后情况,以期为CHB患者停药诱发HBV-ACLF的临床诊治提供参考。
1 对象与方法
1.1 对象 纳入2014年6月—2019年6月成都市公共卫生临床医疗中心收治的HBV-ACLF患者,参考随机抽样样本量计算公式n=P(1-P)/[e2/Z2+P(1-P)/N],其中置信度设置为P<0.01,比例估计设置为0.5,精度值百分比分别设置为0.03和0.04,计算出样本量为985~1543,取整数1200作为目标样本量,排除临床资料不完整患者后,最终纳入患者1164例。根据发病前是否停用NAs分为停药组(n=187)和非停药组(n=977)。根据ACLF进展情况将停药组患者分为ACLF-早期(n=60)、ACLF-中期(n=47)和ACLF-晚期(n=80)3组。纳入标准:①临床检查符合《肝衰竭诊治指南(2018年版)》[5]中有关ACLF的诊断标准;②患者性别不限,年龄≥18岁;③临床资料完整。排除标准:①合并其他类型肝炎病毒感染者;②因药物、酒精或其他原因导致的肝损伤者;③经检查存在恶性肿瘤或合并其他重要脏器功能障碍患者;④长期接受抗凝治疗患者;⑤妊娠妇女。部分患者遵医嘱停药标准:①HBeAg阳性患者用药1年若HBV DNA低于检测下限,ALT复常和HBeAg血清学转换后,再巩固治疗至少3年(每隔6个月复查1次)仍保持不变患者可停药随访;②HBeAg阴性患者用药治疗后,HBsAg消失且HBV DNA检测为阴性,可停药随访[6]。本研究已获得患者知情同意及我中心伦理委员会的批准。
1.2 方法
1.2.1 一般资料及临床资料 收集患者的一般资料及临床资料,包括:性别,年龄,住院时间,平均动脉压,饮酒史,既往病史(肝硬化、糖尿病、高血压、慢性肾病),停药患者抗病毒疗程,自发性细菌性腹膜炎(spontaneous bacterial peritonitis, SBP)、肺部感染、脓毒症、电解质紊乱、腹水、出血、肝性脑病(hepatic encephalopathy,HE)、急性肾损伤(acute kidney injury, AKI)等并发症发生情况以及ACLF分期。
1.2.2 实验室检查 收集患者的实验室检查资料,包括:①HBV标志物(HBeAg、HBV DNA载量),采用实时荧光定量PCR法和化学发光法进行检测。②ALT、AST、TBIL、总胆汁酸(total bile acid,TBA)、ALB、CRE、BUN、血清Na+等,采用全自动生化分析仪(7600型,日立中国有限公司)进行检测。③WBC、PLT、中性粒细胞(neutrophil,NEU)、HGB,采用血液分析仪(XT-2000i型,日本SYSMEX株式会社)应用电阻抗法进行检测。④PT、凝血酶原活动度(prothrombin activity,PTA)、国际标准化比值(international normalized ratio, INR),采用血液分析仪进行检测。⑤根据患者相关生化指标计算终末期肝病模型(model of end-stage liver disease, MELD)评分和估算肾小球滤过率(estimated glomerular filtration rate, eGFR)及Child-Pugh分级。
1.2.3 治疗及随访 所有患者入院后接受营养支持、抗感染等常规对症治疗和抗病毒治疗,符合肝移植条件患者纳入肝移植等待队列。所有患者在发病后进行门诊及住院随访,中位随访时间为1年,随访终点为患者失访、死亡或接受肝移植。记录患者28 d、90 d和360 d的总体生存期(overall survival, OS)及相关严重并发症情况。
1.3 统计学处理 采用SPSS 20.0软件对数据进行分析。计量资料符合正态分布以±s表示,组间比较行独立样本t检验,非正态分布以中位数及四分位数[M(P25,P75)]表示,组间比较行Mann-WhitneyU检验;计数资料以例(%)表示,比较行χ2检验;等级资料行秩和检验;相关性采用Spearman相关性分析;生存分析采用Log-rank检验;P<0.05为差异有统计学意义。
2 结 果
2.1 患者一般资料及实验室检查结果 停药组患者停药前的抗病毒疗程为18(6,36)个月,停药组患者的HBeAg阳性率、HBV DNA载量显著高于非停药组,而ALB和PLT水平低于非停药组(P均<0.05);2组患者的其他指标比较,差异均无统计学意义(P均>0.05),见表1。
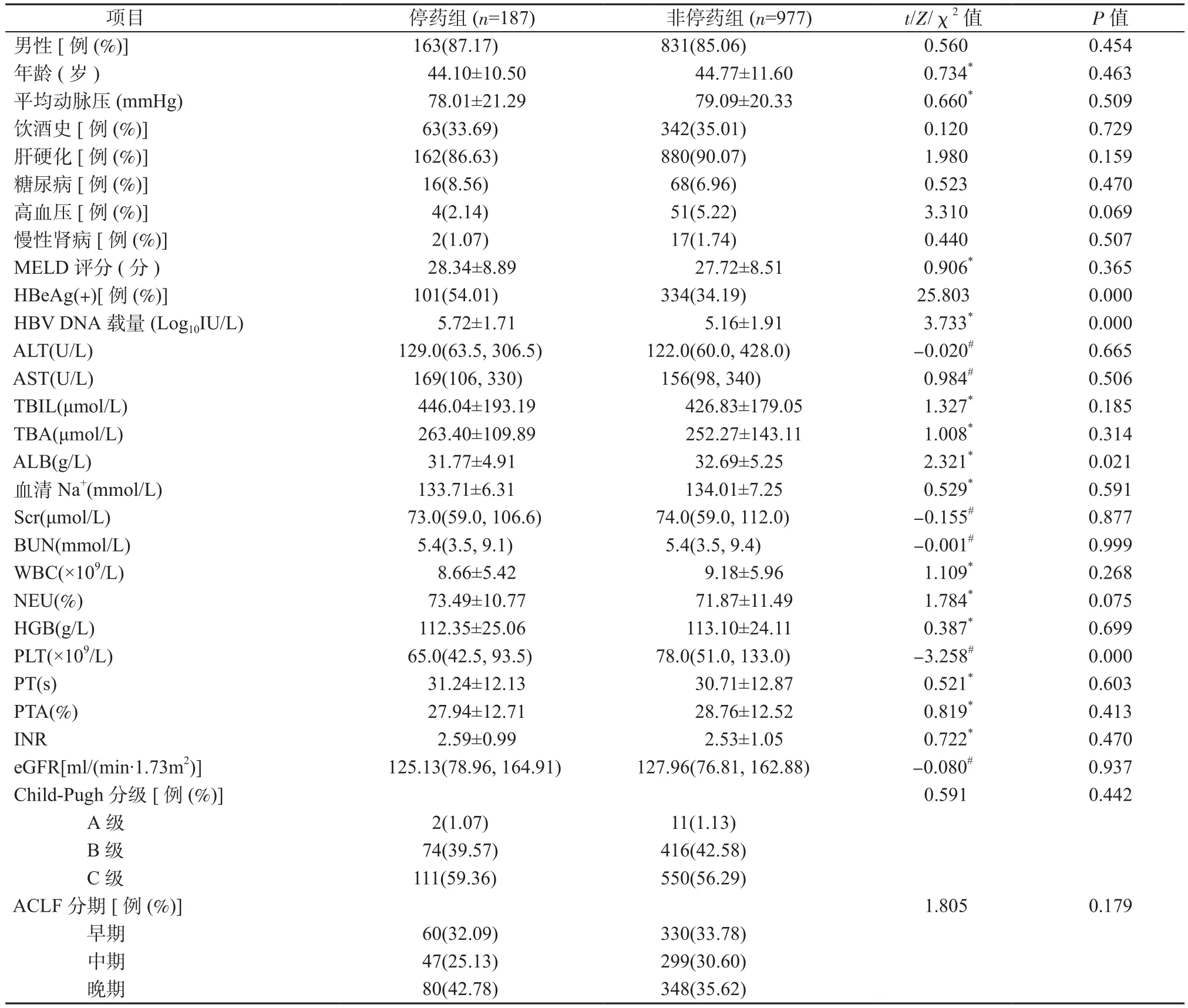
表1 患者一般资料及实验室检查结果Table 1 General information and laboratory test results of patients
2.2 2组患者住院时间及并发症发生情况 停药组患者的中位住院时间长于非停药组,但差异无统计学意义(P>0.05);在肝病相关临床事件中,停药组患者的肺部感染、脓毒症发生率均高于非停药组(P均<0.05);2组患者的SBP、电解质紊乱、腹水、出血、HE和AKI发生率比较,差异均无统计学意义(P均>0.05),见表2。
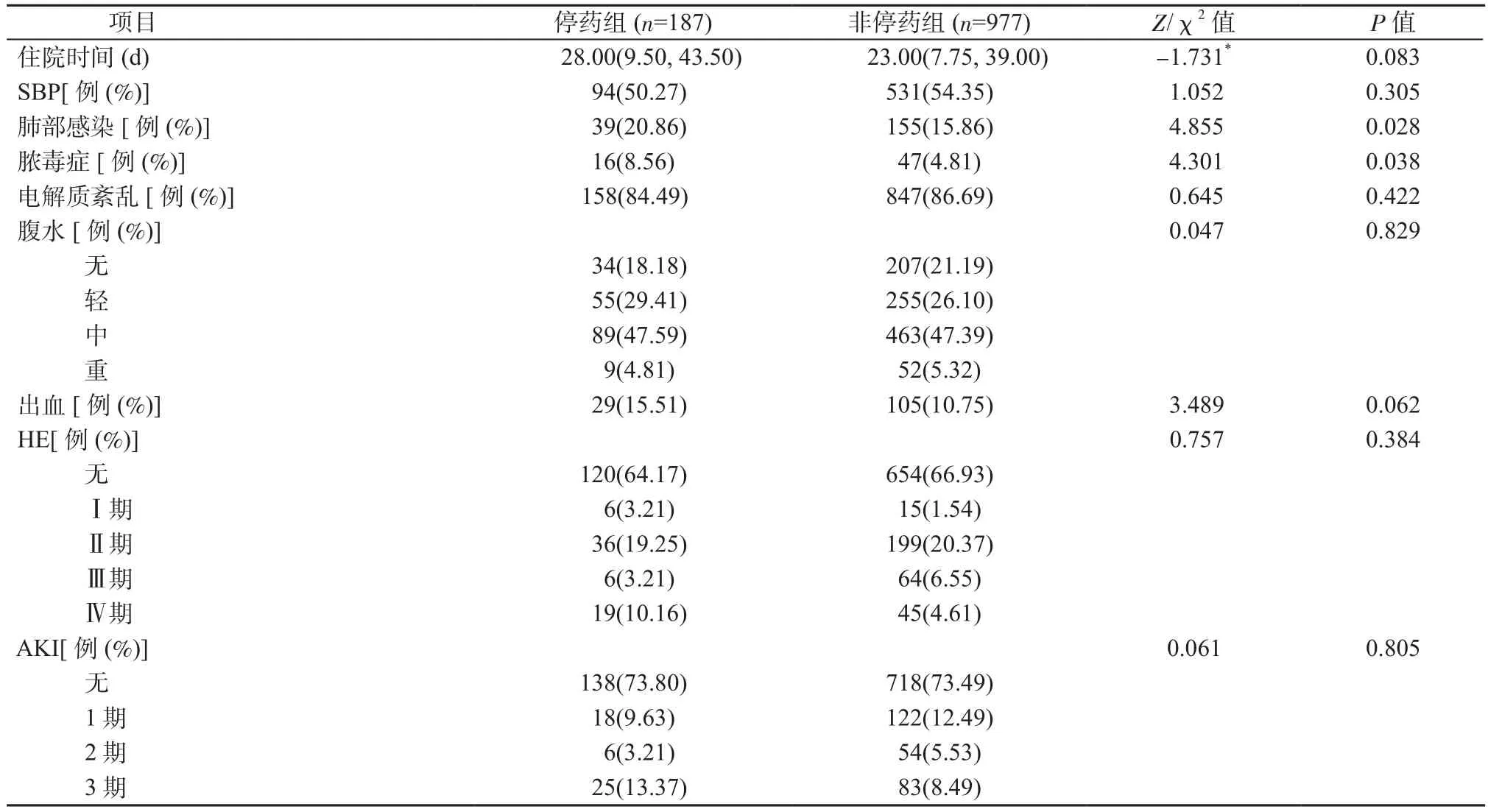
表2 2组患者住院时间及并发症发生情况Table 2 Duration of hospitalization and complications of patients in 2 groups
2.3 患者停药时间与ACLF发生情况 停药组患者的中位停药时间为6.0(2.0,20.6)个月,不同ACLF分级亚组中,ACLF-早期停药时间为5.5(2.0,14.5)个月,ACLF-中期停药时间为5.0(2.0,18.7)个月,ACLF-晚期停药时间6.0(3.0,20.6)个月。相关性分析结果显示,ACLF的分期与停药时间无相关性(r=0.083,P=0.257)。
2.4 患者随访及远期OS分析 所有患者进行定期门诊或住院随访,中位随访时间为1年,随访终点为患者失访、死亡或接受肝移植。1164例患者中共计失访81例(6.96%)。其中,停药组出院即失访8例,随访至12 d失访1例,随访至30 d失访3例,接受肝移植1例;非停药组出院即失访58例,随访至30 d失访7例,随访至79 d失访1例,随访至90 d失访1例,接受肝移植1例。停药组28 d以及90 d的OS均显著低于非停药组(P均<0.05);360 d时,2组患者的OS相比,差异无统计学意义(P>0.05),见图1、表3。
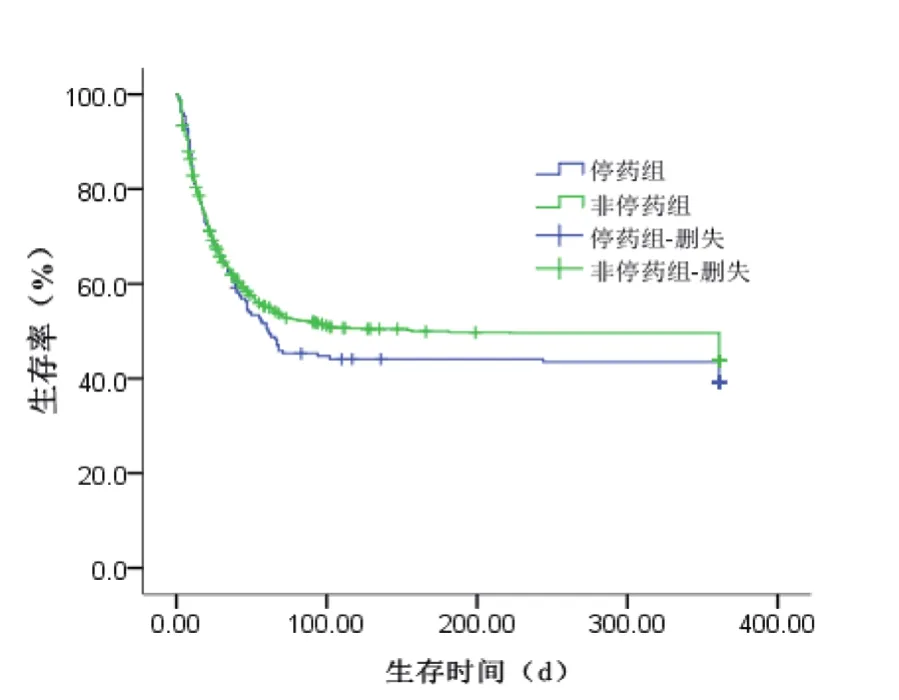
图1 停药组及非停药组患者总体生存率Figure 1 Overall survival rate of patients in drug withdrawal group and non-drug withdrawal group
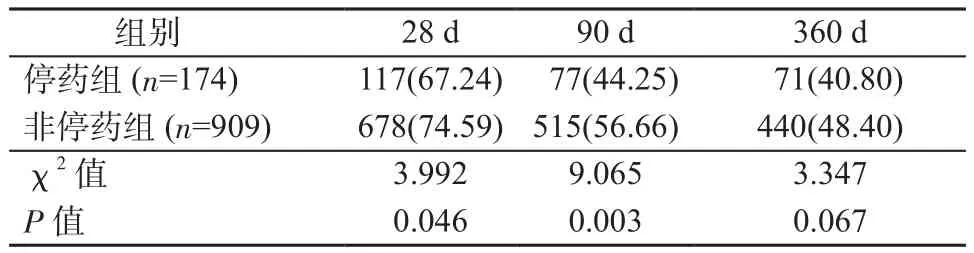
表3 2组患者病后第28 d、90 d和360 d时的总体生存率情况分析[例(%)]Table 3 Analysis of overall survival rate on illness day 28,90 and 360 of 2 groups[cases(%)]
3 讨 论
NAs作为临床抗HBV治疗的主要药物,在抑制HBV复制、减轻肝细胞炎症、延缓肝功能衰竭及其他并发症方面具有重要作用[7-8]。尽管相关指南已对NAs的使用及停用标准提出了推荐意见,但仍有部分患者存在依从性差,不规律服药及随意停药的问题,最终出现停药后复发,甚至进展至肝衰竭[9]。一项有关CHB患者停用抗病毒药物后的Meta分析研究显示,患者停药后持续病毒学抑制率随时间的延长而下降,停药后24个月的复发率高达93.3%[10]。有关NAs停用后引发的不同临床结局,已成为临床研究的热点与难点之一。对CHB患者停药后的临床特征及预后进行分析,有利于了解ACLF对疾病严重程度的影响,为CHB患者停药诱发相关ACLF的临床诊治提供参考。
本研究基于一个大型队列研究(n=1164),可准确反映CHB患者的停药率、临床特征、停药后诱发ACLF的整体情况。结果显示,因停用NAs抗病毒药物导致诱发ACLF的患者约占16.07%(187/1164),提示停用NAs是CHB患者发生ACLF的常见诱因。刘晓燕等[11]对698例ACLF患者的临床资料进行回顾性分析,发现因停用NAs诱发ACLF的比例逐年上升,2016年达到21.49%,较本研究发生率高,这可能与两项研究之间样本量的不同及收集病例的时间早晚有关。对停药组与非停药组的临床及生化指标分析发现,停药组患者的HBeAg阳性率、HBV DNA载量明显高于非停药组。NAs主要通过抑制HBV DNA聚合酶或反转录酶而抑制HBV DNA的复制,对cccDNA无清除作用,一旦停药,极易导致病毒以cccDNA为模板继续复制,使HBV再激活[12-14],有研究表明,HBV DNA水平与HBeAg阳性率呈正相关[15],这也是停药组患者HBeAg阳性率、HBV DNA载量明显高于非停药组的原因。另外,停药组患者的ALB和PLT水平低于非停药组,提示停药后对肝脏功能的损害可能更大,直接影响肝脏功能。ALB是由肝实质细胞合成的蛋白,在维持血液循环、调节血浆胶体渗透压方面具有重要作用,当患者存在恶性肿瘤或肝脏合成功能障碍时,其水平会明显下降[16]。停药后,患者HBV DNA载量明显升高,一方面病毒可通过抑制巨核细胞的分裂来抑制PLT的生成,另一方面可通过抑制机体免疫功能使PLT破坏增多,从而降低患者PLT水平。肺部感染、脓毒症等均是ACLF的严重感染并发症[17]。本研究发现,在肝病相关临床事件中,停药组患者的肺部感染、脓毒症发生率均高于非停药组,提示因停药导致的ACLF患者发生严重并发症的几率更高。病原菌介导的肝细胞炎症和因HBV活化导致的免疫抑制,可引起肝脏功能急剧衰竭,进而导致ACLF患者出现严重感染并发症[18]。
本研究分析CHB患者停药时间与ACLF发生情况的关系显示,停药组患者的中位停药时间为6.0(2.0,20.6)个月,不同ACLF分期亚组中,各亚组停药时间差异无统计学意义,提示ACLF病情严重程度与停药时间无关。但一项长达10年的随访研究发现,CHB患者根据指南推荐停药标准停药后,复发率高,且在停药后的6、12、24个月,复发率呈逐渐递增趋势[19]。因此一旦发现患者停药,不论停药时间长短都应当建议患者密切随访,做到早发现、早治疗,降低ACLF发生率。
CHB患者停药后诱发ACLF的预后情况,一直是临床研究的重点。本研究对所有患者进行随访,研究结果显示,停药组的28 d、90 d的OS均显著低于非停药组,但2组患者360 d的OS无明显差异,表明停药后患者出现的病死情况主要集中在90 d内,对患者远期OS无明显影响。因此,针对停用NAs的CHB患者,临床应进行为期至少3个月的密切随访,在发现异常时及时采取对症治疗措施,以降低ACLF的复发,提高患者生存质量。
综上所述,因停药后诱发ACLF的患者HBeAg阳性率、HBV DNA载量和脓毒症发生率显著上升;停药会影响患者的近期生存率,且停药组患者短期病死率更高,但停药时间与患者病情严重程度无明显相关。本研究仍存在一定不足之处,未对影响患者诱发ACLF的预后因素进行分析,有待后续完善前瞻性随机研究进行验证与深入分析。
