呋喃酮C-30对鲍曼不动杆菌菌毛及生物被膜的作用
2021-07-13敬蓉冯雁京刘原张伟刘聪蕊和平柯蕊赵玉杰杨妮
敬蓉 冯雁京 刘原 张伟 刘聪蕊 和平 柯蕊 赵玉杰 杨妮
1西安交通大学第二附属医院医用超声研究室710004;2西安交通大学第二附属医院心血管内科710004;3西安交通大学第二附属医院呼吸内科710004;4西安交通大学第二附属医院全科医学710004;5西安交通大学第二附属医院重症医学科710004;6西安交通大学第二附属医院急诊科710004
鲍曼不动杆菌是一种重要的能引起医院获得性感染的机会性病原体,主要在危重住院患者及其周围环境中持续存在并茁壮成长。据估计,全世界每年有100万例鲍曼不动杆菌感染,造成15 000人死亡[1]。特别是多重耐药鲍曼不动杆菌,其可通过多种机制对多种抗生素产生耐药性[2],因此临床抗感染治疗面临很大的挑战。鲍曼不动杆菌的定植和耐药性与其生物被膜形成能力密切相关[3-4]。此外,生物被膜可能在鲍曼不动杆菌与宿主的相互作用中发挥关键作用,生物被膜的形成也促进医疗器械相关感染的发生[4-5]。
鲍曼不动杆菌在非生物表面形成生物被膜主要由csu A/BABCDE伴侣组装系统介导[5-7],而其合成菌毛的过程又受Bfm RS双组分调节系统调节。csu A/BABCDE伴侣组装系统对鲍曼不动杆菌菌毛形成和生物被膜形成至关重要[8-10]。研究表明,群体感应(quorum sensing,QS)系统可以通过增加BfmS和Bfm R基因的转录来调节细菌生物被膜和菌毛的组装[11]。而且,QS系统的衰减也会导致其他毒力因子表达减弱[12]。因此,阻断QS系统可能是对抗QS介导的生物被膜相关鲍曼不动杆菌感染的一种新策略。
呋喃酮C-30是一种新型卤代呋喃酮化合物,能阻断QS系统,进而减弱细菌的毒力因子。相关研究证实,使用呋喃酮C-30可以抑制浮游和生物被膜铜绿假单胞菌中的QS系统[13-15]。然而,呋喃酮C-30对鲍曼不动杆菌QS系统所介导的毒力因子的影响鲜有报道。
本实验研究了低剂量呋喃酮C-30对鲍曼不动杆菌标准菌株ATCC19606体外模型生物被膜形成和菌毛组装的影响,从而探索治疗鲍曼不动杆菌感染的新的策略。
1 材料与方法
1.1 实验菌株 鲍曼不动杆菌标准菌株ATCC19606购自美国Type Culture Collection公司。以大肠杆菌ATCC25922和铜绿假单胞菌ATCC27853为质控菌株。
1.2 主要试剂与仪器 呋喃酮C-30购自美国QCC公司,PCR反应体系和分子标准购自日本Ta KaRa公司,引物合成和序列分析由北京鼎国昌盛生物技术有限公司完成。水解酪蛋白琼脂(MH琼脂)购自法国梅里埃公司,麦康凯琼脂粉购自杭州天和微生物有限公司,溴化乙锭为北京奥科公司产品,结晶紫购自上海中国远航化工厂。北京凯元信瑞仪器有限公司Mini SC及SC型电泳槽,美国MJ Research公司PTC-200梯度PCR仪,美国Bio-Rad公司GelDoc2000凝胶成像系统,美国ABI公司Step One Plus Real Time PCR扩增仪,日本日立公司透射电子显微镜H-7650,德国Implen公司ND-1000分光光度计,德国BMG Lab Technologies公司96孔板酶标仪。
1.3 方法
1.3.1 呋喃酮C-30最低抑菌浓度的测定 根据临床和实验室标准研究所指南(2016年),应用微量肉汤稀释法进行测定。选取呋喃酮C-30的浓度上限为512 mg/L,呋喃酮C-30以2倍的稀释度(0~512 mg/L)加入96孔聚乙烯板中。再向每个孔中加入100μl鲍曼不动杆菌菌悬液(1.5×108CFU/ml)。孵育24 h后,观察无肉眼可见细菌生长的最低药物浓度即为呋喃酮C-30对鲍曼不动杆菌ATCC19606菌株的最低抑菌浓度。
1.3.2 呋喃酮C-30对生物被膜形成的影响 制备鲍曼不动杆菌标准菌株ATCC19606菌悬液(1.5×108CFU/ml),实验组添加10μmol/L呋喃酮C-30,对照组不加,37℃孵育72 h。每24小时更换1次液体。通过测量结晶紫的OD590来量化生物被膜的形成。本实验重复14次。
1.3.3 呋喃酮C-30对菌毛结构的影响 透射电镜观察呋喃酮C-30对鲍曼不动杆菌菌毛结构的影响。呋喃酮C-30组将鲍曼不动杆菌菌悬液(1.5×108CFU/ml)接种于含呋喃酮C-30(10μmol/L)的培养基;对照组将细菌悬液接种于不含呋喃酮C-30培养基,37℃孵育24 h。细菌浮游菌悬浮液的离心沉淀物用PBS冲洗并用2.5%戊二醛固定24 h。PBS冲洗干净后,再将样品置于2%磷钨酸溶液中染色。用日立H-7650透射电子显微镜观察样品。
1.3.4 呋喃酮C-30对蹭行运动的影响 应用琼脂糖平板观察鲍曼不动杆菌ATCC19606的表面运动性。用牙签挑取单个菌落,分别穿刺接种到含有(10μmol/L)或不含有呋喃酮C-30的MH琼脂平板的底部。在37℃孵育24 h后,测量琼脂和底部界面处蹭行区的直径。本实验重复12次。
1.3.5 PCR法检测菌毛编码及调控基因 按照试剂盒说明,提取鲍曼不动杆菌ATCC19606的DNA。按照相关文献[11],合成菌毛编码csu A/BABCDE及调控基因Bfm RS的引物。建立PCR反应体系(25μl),其中2×Taq Mix 12.5μl,模板DNA 2μl,正向引物(10μmol/L)1μl,反向引物(10μmol/L)1μl,灭菌蒸馏水补足至25μl。空白对照不加模板DNA,加入2μl灭菌蒸馏水。PCR反应条件:94℃酶激活、DNA预变性5 min;94℃变性30 s,58℃退火30 s,72℃延伸30 s,共30个循环;最后72℃延伸5 min。扩增产物在1.5%琼脂糖凝胶上通过电泳分离,并使用GelDoc2000凝胶成像系统可视化。引物序列见表1。

表1 目的基因引物序列
1.3.6 检测菌毛编码及调控基因m RNA表达水平 根据PCR结果,8个基因在鲍曼不动杆菌标准菌株ATCC19606中均表达,应用实时PCR法进一步验证。制备鲍曼不动杆菌标准菌株ATCC19606菌悬液(1.5×108CFU/ml),实验组添加10μmol/L呋喃酮C-30,对照组不加,37℃孵育72 h,刮取生物被膜菌。使用Trizol法制备RNA,并根据逆转录试剂盒的说明合成c DNA。反应条件如上所述。应用实时PCR扩增仪获取相关基因的扩增及融解曲线。本实验重复3次。
1.4 统计学分析 应用SPSS 18.0软件进行统计分析,采用两独立样本的t检验、完全随机设计方差分析方法进行统计检验。P<0.05为差异有统计学意义。
2 结果
2.1 呋喃酮C-30的最低抑菌浓度 呋喃酮C-30对鲍曼不动杆菌ATCC19606菌株的最低抑菌浓度为64 mg/L。见图1。

图1 96孔板微量肉汤稀释法测定呋喃酮C-30最低抑菌浓度
2.2 呋喃酮C-30对生物被膜形成的影响 结晶紫染色法观察呋喃酮C-30处理后鲍曼不动杆菌生物被膜形成数量的变化。呋喃酮C-30组吸光度值(0.690±0.104)低于对照组(0.997±0.134),差异有统计学意义(t=8.118,P<0.001)。见图2。
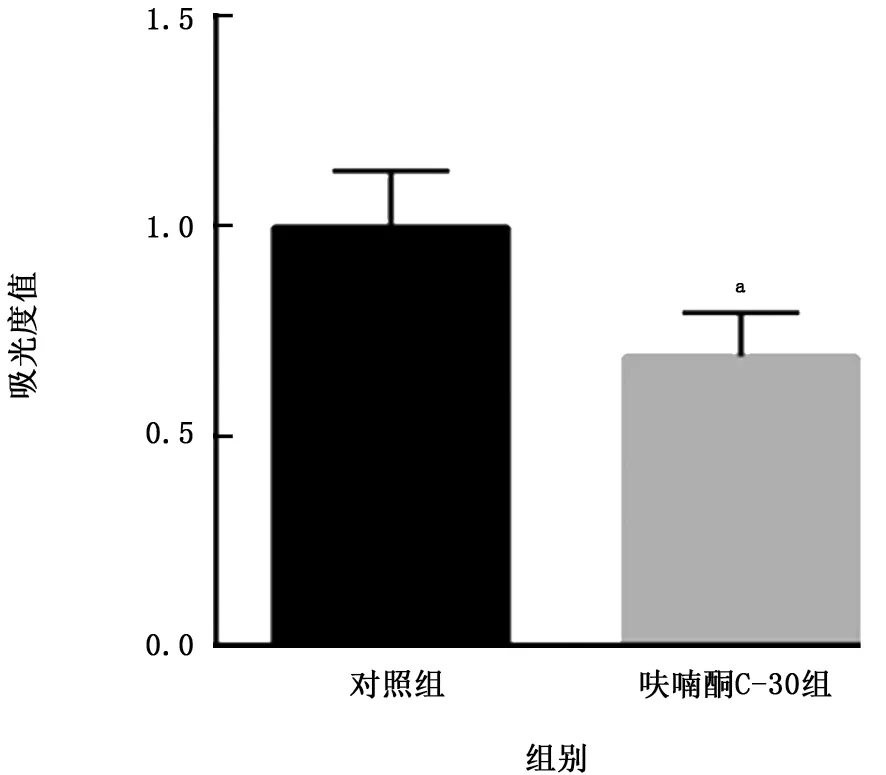
图2 呋喃酮C-30对鲍曼不动杆菌生物被膜的影响
2.3 呋喃酮C-30对菌毛结构的影响 负染色后,应用透射电镜分别在15 000倍和60 000倍的放大倍数下观察呋喃酮C-30组及对照组鲍曼不动杆菌菌毛结构。对照组鲍曼不动杆菌周围有丰富的菌毛样结构,而呋喃酮C-30组鲍曼不动杆菌周围没有明显的菌毛样结构。见图3。

图3 透射电镜观察呋喃酮C-30对鲍曼不动杆菌菌毛结构的影响 A、C:对照组;B、D:呋喃酮C-30组 ×15 000(A、B)×60 000(C、D)
2.4 呋喃酮C-30对蹭行运动的影响 琼脂糖表面运动实验结果显示,呋喃酮C-30组鲍曼不动杆菌ATCC19606蹭行运动能力减低(图4)。与对照组[(7.675±1.061)mm]相比,呋喃酮C-30组鲍曼不动杆菌蹭行区直径[(5.808±0.474)mm]显著减小(t=4.306,P=0.001)。见图5。

图4 表面蹭行运动实验检测细菌蹭行运动能力 A:对照组;B:呋喃酮C-30组
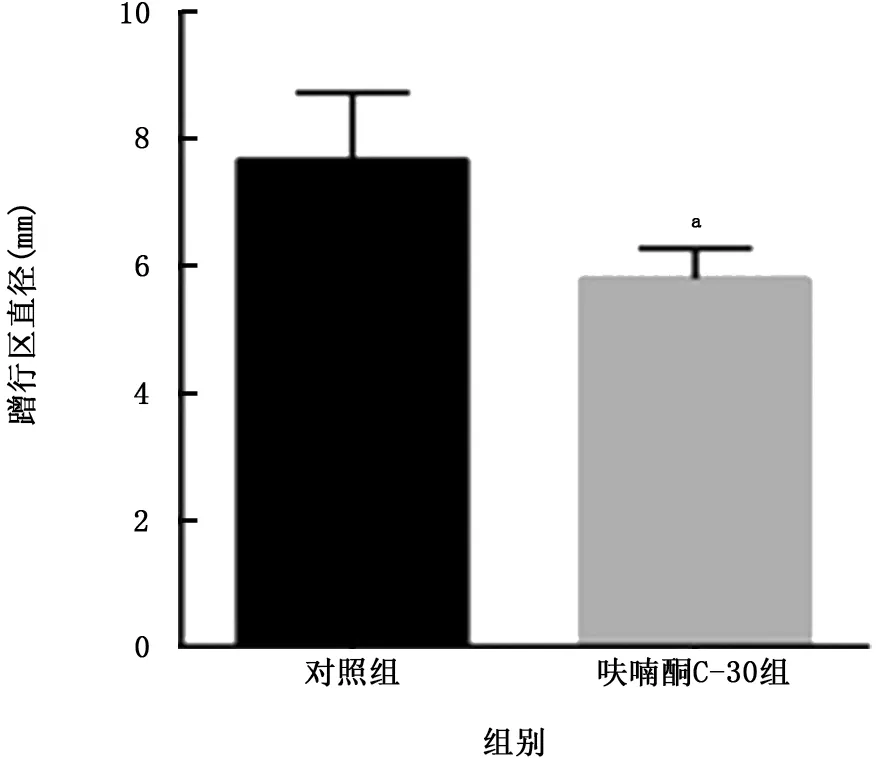
图5 2组鲍曼不动杆菌蹭行区直径的比较
2.5 PCR法检测菌毛编码及调控基因 PCR结果显示鲍曼不动杆菌标准菌株ATCC19606中8个测试基因均呈阳性(图6)。内参基因16sRNA、菌毛编码基因csu A/BABCDE以及调节基因Bfm RS的扩增曲线和融解曲线如图7~15所示,提示引物特异性较好。实时PCR结果如表2及图16所示,呋喃酮C-30下调了所有测试基因的表达,尤其是csu A/B、csu E、Bfm R基因的表达水平显著降低,且差异有统计学意义(P值均<0.05)。
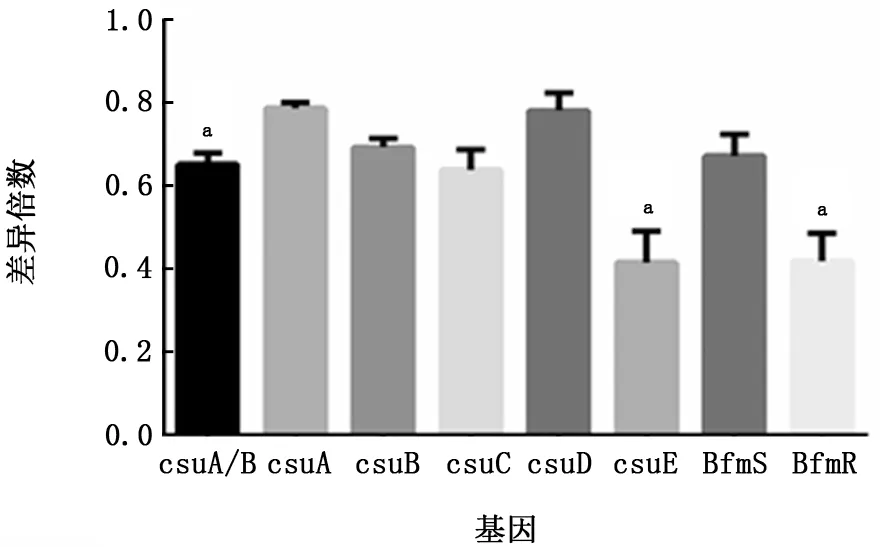
图16 实时PCR检测呋喃酮C-30对菌毛编码及调节基因表达的影响

表2 呋喃酮C-30组菌毛编码及调节基因的相对表达量
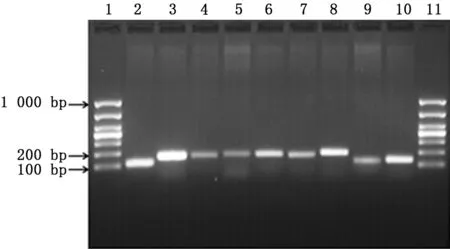
图6 PCR检测鲍曼不动杆菌标准菌株ATCC19606菌毛编码及调节基因

图7 16sRNA基因的扩增曲线和融解曲线 A:扩增曲线;B:融解曲线
3 讨论
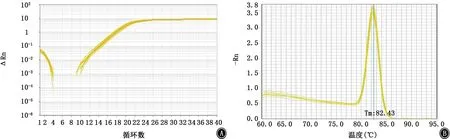
图8 csu A/B基因的扩增曲线和融解曲线 A:扩增曲线;B:融解曲线
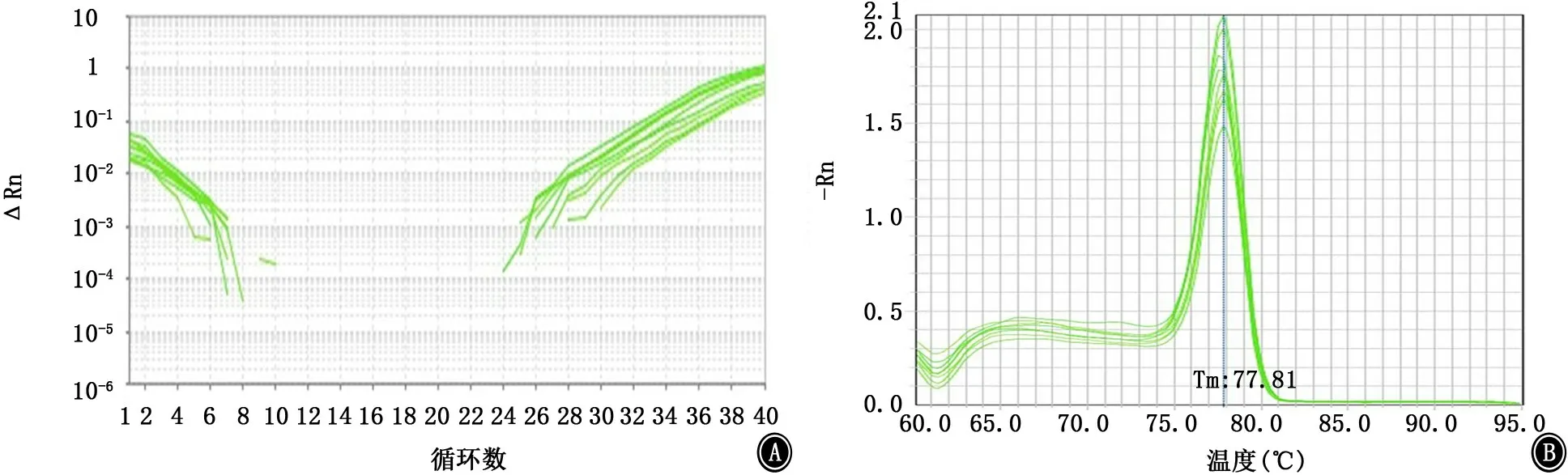
图9 csu A基因的扩增曲线和融解曲线 A:扩增曲线;B:融解曲线

图10 csuB基因的扩增曲线和融解曲线 A:扩增曲线;B:融解曲线
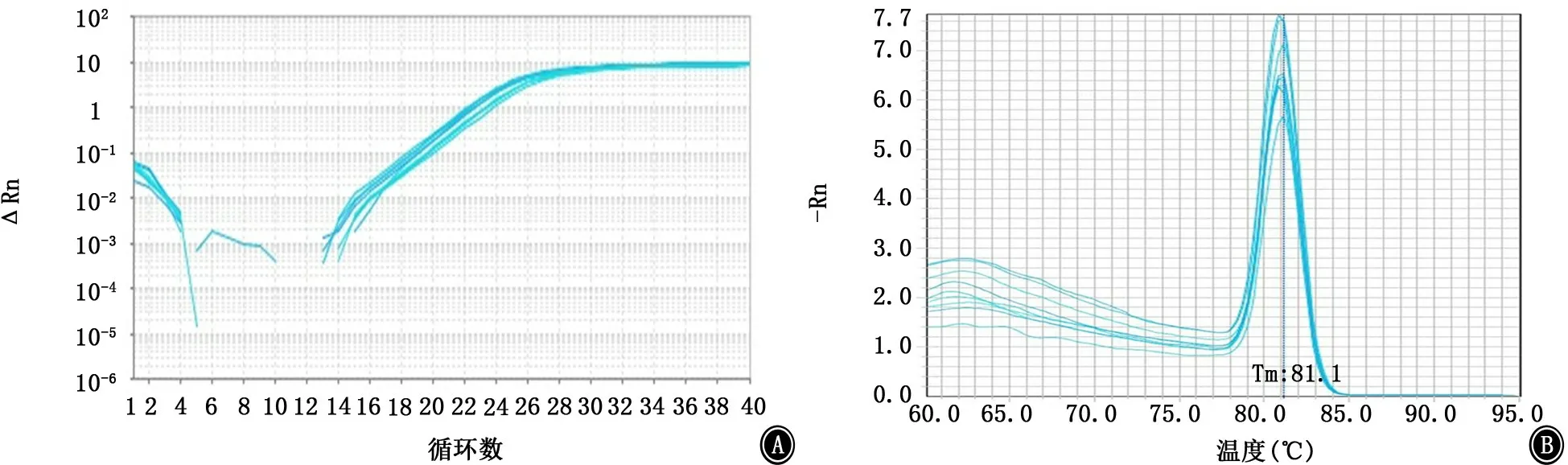
图11 csuC基因的扩增曲线和融解曲线 A:扩增曲线;B:融解曲线
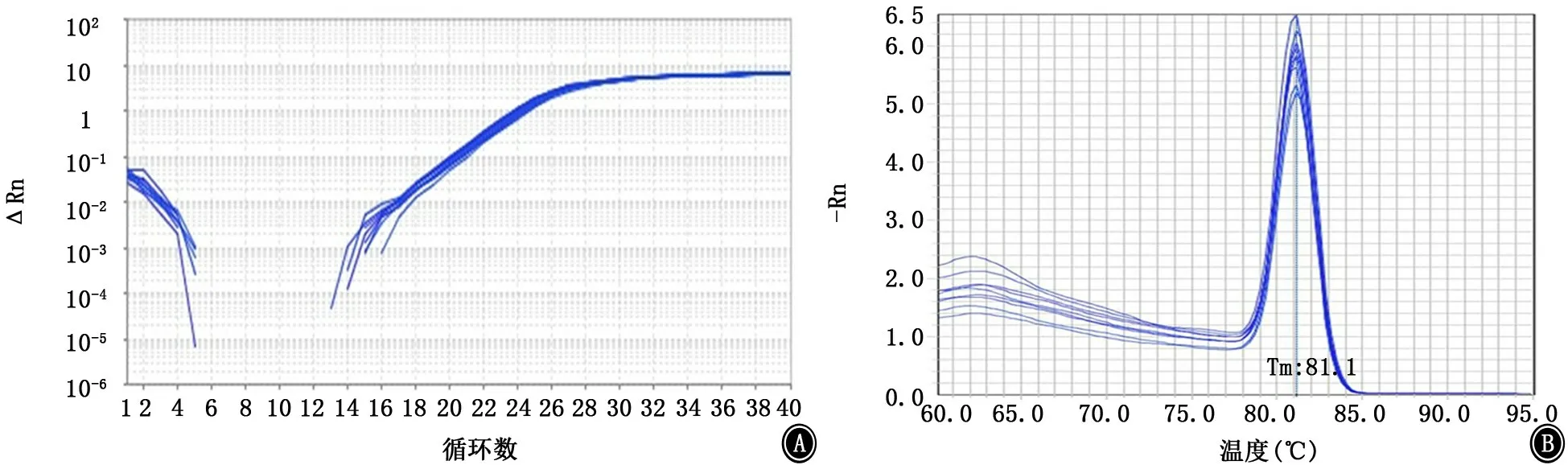
图12 csuD基因的扩增曲线和融解曲线 A:扩增曲线;B:融解曲线
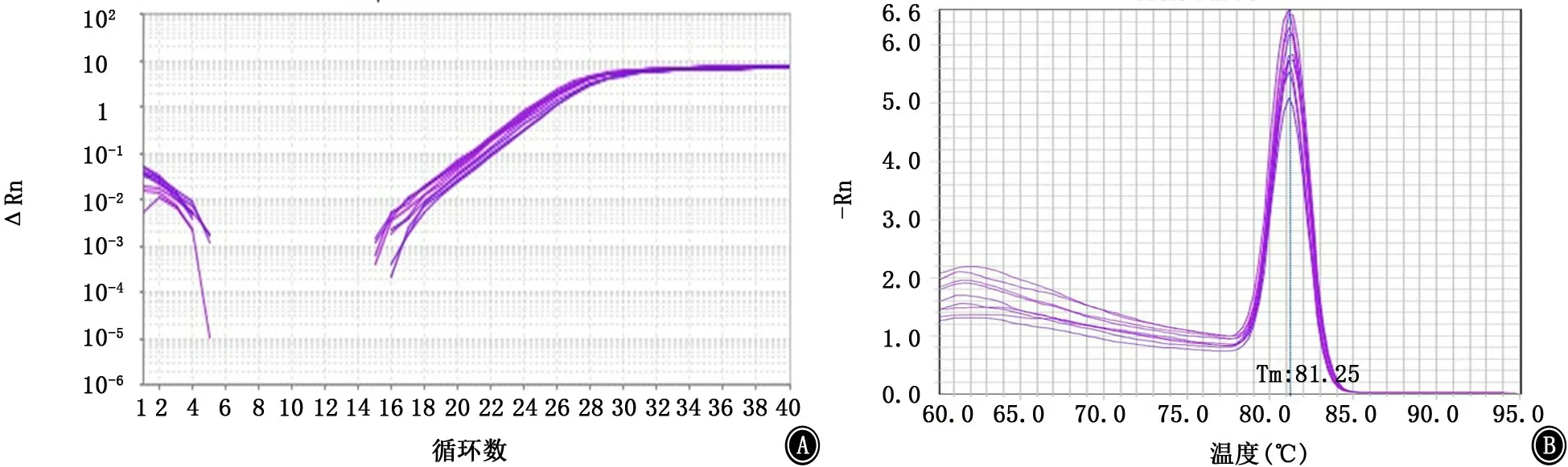
图13 csuE基因的扩增曲线和融解曲线 A:扩增曲线;B:融解曲线
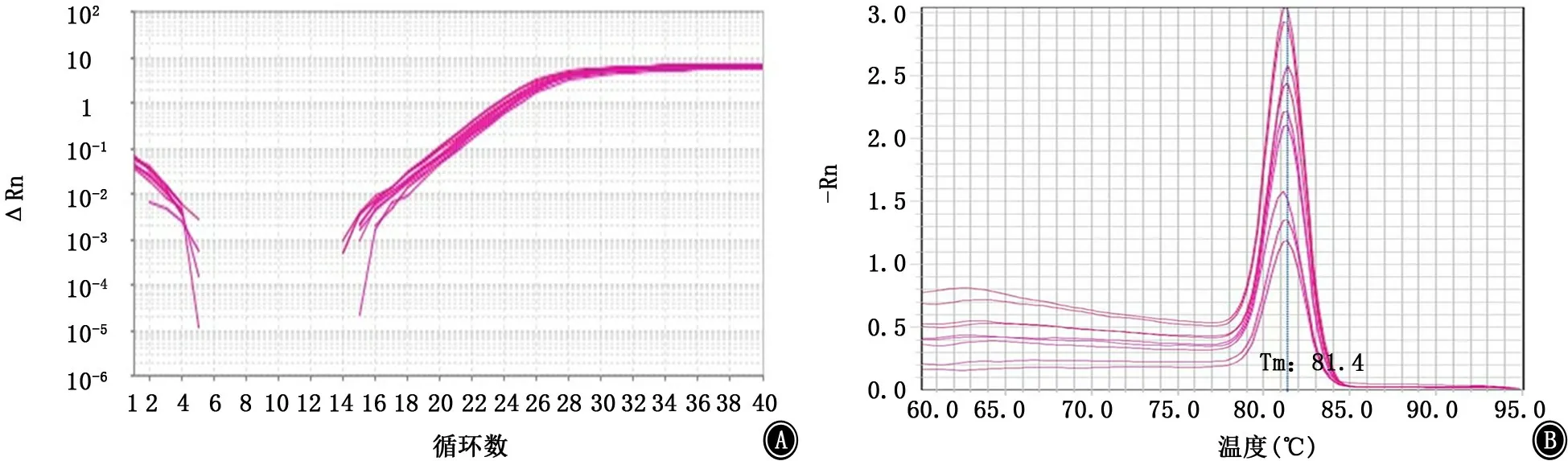
图14 BfmS基因的扩增曲线和融解曲线 A:扩增曲线;B:融解曲线
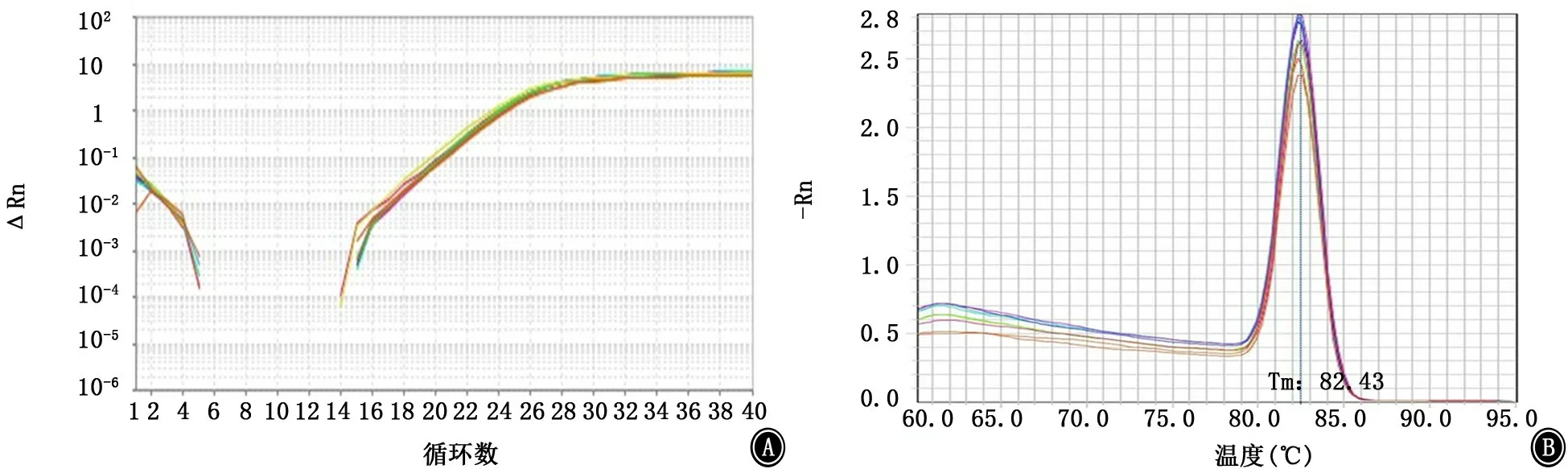
图15 Bfm R基因的扩增曲线和融解曲线 A:扩增曲线;B:融解曲线
QS系统是细菌的一个重要调节系统,细菌利用它来协调与某些生物行为有关的基因的表达,如生物被膜的形成、毒力因子的产生和次级代谢物[16-19]。QS系统能够使细菌更好地适应环境压力,提高存活率,因此破坏QS系统可能是治疗鲍曼不动杆菌感染的一个新的策略[20-23]。QS系统抑制剂是一类新型的药物,通过抑制或者下调细菌QS系统,干扰其所调控的相关毒力表型的表达,包括细菌菌毛的合成和生物被膜的形成。呋喃酮C-30是根据天然存在的呋喃酮化合物人工合成的一种QS系统抑制剂,具有较强的QS抑制活性,常用作研究QS抑制的阳性对照[24]。关于呋喃酮C-30对铜绿假单胞菌的作用已有许多相关文献[13,25],但对鲍曼不动杆菌的研究尚未见报道。由于铜绿假单胞菌和鲍曼不动杆菌同属于革兰阴性菌,具有相似的生物学特性,因此在本研究中使用呋喃酮C-30干扰鲍曼不动杆菌的QS系统,并进一步观察其对菌毛组装和生物被膜形成的影响。
本研究观察了呋喃酮C-30对鲍曼不动杆菌菌毛和生物被膜的影响。结果表明,呋喃酮C-30能够显著抑制细菌菌毛样结构和生物被膜的形成,并能减弱鲍曼不动杆菌的蹭行运动能力。此外,用呋喃酮C-30处理后,鲍曼不动杆菌的菌毛和生物被膜编码及调节基因表达水平下调。以上结果表明呋喃酮C-30可抑制鲍曼不动杆菌标准菌株ATCC19606生物被膜和菌毛相关基因的表达,尤其是csuE和Bfm R基因的表达,从而导致细菌菌毛合成减少、生物被膜形成和蹭行运动能力降低。
菌毛编码基因csu A/BABCDE在鲍曼不动杆菌标准菌株ATCC19606生物被膜形成中起重要作用。鲍曼不动杆菌的菌毛参与其生物被膜形成过程,在生物被膜形成的初始阶段发挥作用,可以介导鲍曼不动杆菌在表面的黏附以及微菌落的形成。最近的研究表明,csu E的表达能够调节鲍曼不动杆菌标准菌株ATCC19606形成菌毛和在非生物表面形成生物被膜的能力[7]。此外,菌毛编码基因csu A/BABCDE的表达由双组分调节系统调节,该系统由BfmS编码的传感器激酶和BfmR编码的反应调节剂组成[10]。基因转录和翻译分析表明,Bfm R的失活可以导致csu操纵子的表达缺失,从而导致细菌在非生物表面菌毛产生和生物被膜形成能力的消失[26]。本研究结果发现,用呋喃酮C-30处理后,csuE和Bfm R基因的表达水平显著降低,从而导致细菌菌毛组装和生物被膜形成减弱。这一结果表明呋喃酮C-30可能作用于QS系统,然后干扰Bfm RS双组分调节系统和菌毛编码基因csu A/BABCDE,最终导致细菌生物被膜和菌毛的合成减少,蹭行运动能力减弱。
本研究的重点是首次阐明呋喃酮C-30与生物被膜形成减少、菌毛组装和蹭行运动能力之间的关系。呋喃酮C-30对鲍曼不动杆菌生物被膜形成的抑制作用主要由csuE和BfmR基因调节。但是本研究也具有一定的局限性。首先,在此次研究中仅使用鲍曼不动杆菌的标准菌株,后续需要研究更多的临床菌株;其次,笔者尚未探讨呋喃酮C-30对鲍曼不动杆菌耐药性的影响。因此,今后需要更多的实验来进行阐明。
综上所述,本研究表明呋喃酮C-30能显著抑制鲍曼不动杆菌菌毛结构和生物被膜的形成,并削弱细菌的蹭行运动能力。呋喃酮C-30对生物被膜形成的抑制作用主要受csuE和BfmR基因的调节,故它有可能是治疗鲍曼不动杆菌感染的潜在药物,但仍需要进一步研究来探讨其临床应用前景。
利益冲突 所有作者均声明不存在利益冲突
