NLRP3炎症小体在重症社区获得性肺炎患者中的表达
2021-07-13周呈义周国旗刘振峰邹玉刚邹丽陆小凤曾静罗先跃
周呈义 周国旗 刘振峰 邹玉刚 邹丽 陆小凤 曾静 罗先跃
1遵义市第一人民医院(遵义医科大学第三附属医院)核医学科563000;2遵义市红花岗区人民医院呼吸与危重症医学科563003
重症社区获得性肺炎(community-acquired pneumonia,CAP)是ICU收治的常见疾病,自20世纪50年代抗菌素发明以来CAP虽然得到很好的治疗,但是重症CAP的高病死率一直未得到改善,仍保持在20%~50%[1]。即使近些年来抗生素发明和生命支持方法得到不断进步,但重症CAP高病死率的现状仍没有得到改变。越来越多的研究认为合适的免疫调节联合抗生素治疗可能会提高重症CAP的治疗效果和预后。固有免疫是机体抵抗病原体侵犯的第一道防线,而相应的免疫受体及通路在固有免疫中发挥着重要作用,这些受体包括Toll样受体家族、核苷酸结合和寡聚化结构域样受体(NOD-like receptors,NLRs)等。NLRP3炎症小体是NLRs家族成员的组成之一,现有的研究已经证实其与冻伤蛋白相关周期性发热综合征、痛风、糖尿病、牛皮癣、HIV-易感性增加、炎症性肠病等有关[2]。近来的研究表明NLRP3炎症小体的活化与某些肺部感染常见病原体有关,但缺少相关的临床研究。因此,本研究拟通过观察CAP患者痰液及外周血单核细胞NLRP3炎症小体及相关炎症介质的表达,为临床有效防治重症CAP提供免疫学理论依据。
1 对象与方法
1.1 研究对象 本研究经伦理委员会同意后,随机选取2018年4月至2019年4月于遵义市红花岗区人民医院呼吸与危重症医学科住院的CAP患者20例,其中普通CAP患者12例,男9例(75.0%),女3例(25.0%),平均年龄(60.8±11.2)岁;重症CAP患者8例,男4例(50.0%),女4例(50.0%),平均年龄(66.3±9.5)岁。另外选取同期于遵义市红花岗区人民医院体检的健康人群10名作对照,男6名(60.0%),女4名(40.0%),平均年龄(61.0±7.7)岁。健康对照组个体的排除标准:自身免疫疾病、人免疫缺陷病毒感染、肿瘤、怀孕、其他感染性疾病或肺部疾病。CAP的诊断标准[3]为在胸部影像学提示急性肺部浸润的基础上合并以下条件中的至少2项:(1)呼吸道症状,如咳嗽、咳痰等;(2)感染中毒症状,如畏寒、发热等;(3)肺部异常体征,如湿性啰音;(4)炎症指标异常(如白细胞计数、C反应蛋白增高等)。利用ATS/IDSA 2007标准识别重症CAP,重症CAP入选标准[3]:(1)需要有创机械通气;(2)感染性休克需要血管收缩剂治疗。CAP的排除标准:自身免疫性疾病,HIV感染,恶性肿瘤,怀孕,医院获得性肺炎,或者感染性疾病。收集所有研究对象的一般资料,同时进行APACHEⅡ、SOFA、CURB 65评分判断患者器官功能、病情严重程度。
1.2 主要试剂和仪器 主要仪器设备:NIKON光学显微镜购自日本NIKON公司,XW-80A型漩涡混合器购自精科公司,超净工作台购自苏州净化公司,垂直电泳槽购自上海仪器总厂,电泳仪购自美国Bio-Rad公司,电泳电转系统购自美国Bio-Rad公司,低温离心机购自德国Backman,转移槽DYCP-40C购自上海仪器总厂,恒温箱购自德国ZEEnit700,IP Win32采图系统购自美国Syngene公司,凝胶图像分析系统购自美国Bio-Rad公司,PCR仪购自美国Bio-Rad公司。主要试剂:Histopaque-1077液购自美国Sigma公司,淋巴细胞分离液购自宝生物工程(大连)有限公司,RPMI 1640购自美国BioWhittaker公司,兔抗人NLRP3抗体、兔抗人IL-1β抗体和兔抗人肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)抗体购自美国SANTA公司,PCR引物购自宝生物工程(大连)有限公司。
1.3 标本的获取
1.3.1 血液标本的获取 在住院第1天、第3天和出院日抽取重症CAP、普通CAP患者外周静脉血,健康对照组抽取同期健康体检者的外周静脉血,所有的血液标本均在7∶00和14∶00之间抽取2份,每份5 ml。1份加入等体积Histopaque-1077(Sigma-Aldrich,St.Louis,MO)液,混匀后室温下600 r/min离心20 min(离心半径为10 cm),按浓度梯度吸出单个核细胞层的细胞,用RPMI 1640(BioWhittaker,Walkersville,MD)洗2次,纯化的单核细胞分离后立即进行RT-PCR定量检测;另一份行依地酸二钠抗凝,4℃条件下1 200 r/min离心10 min(离心半径为10 cm),血浆于-20℃保存,用于蛋白质印迹检测。
1.3.2 痰液标本的获取 收取重症CAP及普通CAP患者住院期间下呼吸道合格痰液(每低倍镜视野下<25个鳞状上皮细胞,每高倍镜视野下>25个白细胞),健康对照组采取高渗盐水诱导排痰收集,从痰液中分离痰栓,分为2份,1份称重,按1 g加入4 ml 0.1%的二硫苏糖醇搅拌混匀过滤,过滤液加入同体积的磷酸盐缓冲液,4℃条件下1 500 r/min离心15 min(离心半径为10 cm),悬浮细胞备用蛋白质印迹检测。
1.4 PCR检测 利用逆转录PCR检测外周血单核细胞中的NLRP3 mRNA表达,将1μg单核细胞RNA进行逆转录成DNA,然后进行扩增。使用正向引物5'-AAAAGACTCATCCGTGTGCC-3'和反向引物5'-TTCCTGGCATATCACAGTGG-3'检测外周血中单核细胞的NLRP3 mRNA表达。同时使用正向引物5'-GGTCTTACTCCTTGGAGGCCATGT-3'和反向引物5'-GACCCCTTCATTGACCTCAACTACA-3'测定每个样品中GADPH m RNA的水平。在1%琼脂糖凝胶上分离PCR产物,并在透照仪上拍摄数码照片。
1.5 蛋白质印迹检测 利用蛋白质印迹检测痰液细胞和外周血单核细胞NLRP3、IL-1β和TNF-α蛋白表达。主要步骤:(1)标本获取,清洗后放入液氮中保存待检测;(2)蛋白提取,将组织标本放入裂解液中解冻,利用Bradford法检测蛋白浓度;(3)电泳及转膜,将20 mg蛋白标本载入凝胶孔中进行凝胶电泳,条件为20 V 30 min,结束电泳后将凝胶上分离到的蛋白条带通过转移电泳方式转印至固相支持物上;(4)抗体孵育和检测,先后用无标记的一抗及辣根过氧化物酶标记的二抗进行孵育、检测。利用1.46版本Image J软件对蛋白质印迹结果进行分析。
1.6 统计学分析 采用SPSS 20.0软件进行数据分析。正态分布的计量资料以±s表示,采用t检验进行比较;非正态分布的计量资料以中位数和四分位数间距表示,采用非参数检验进行比较。计数资料以例数(百分数)表示,采用χ2检验及Fisher确切概率法比较组间差异。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 结果显示,重症CAP组患者APACHEⅡ、SOFA、CURB 65评分均高于普通CAP组,同时重症CAP组患者炎症指标(C反应蛋白、降钙素原)均高于普通CAP组;所有患者中有7例需要机械通气,均为重症CAP患者;另外,重症CAP组治愈率明显低于普通CAP组,且住院时间明显增长。见表1。
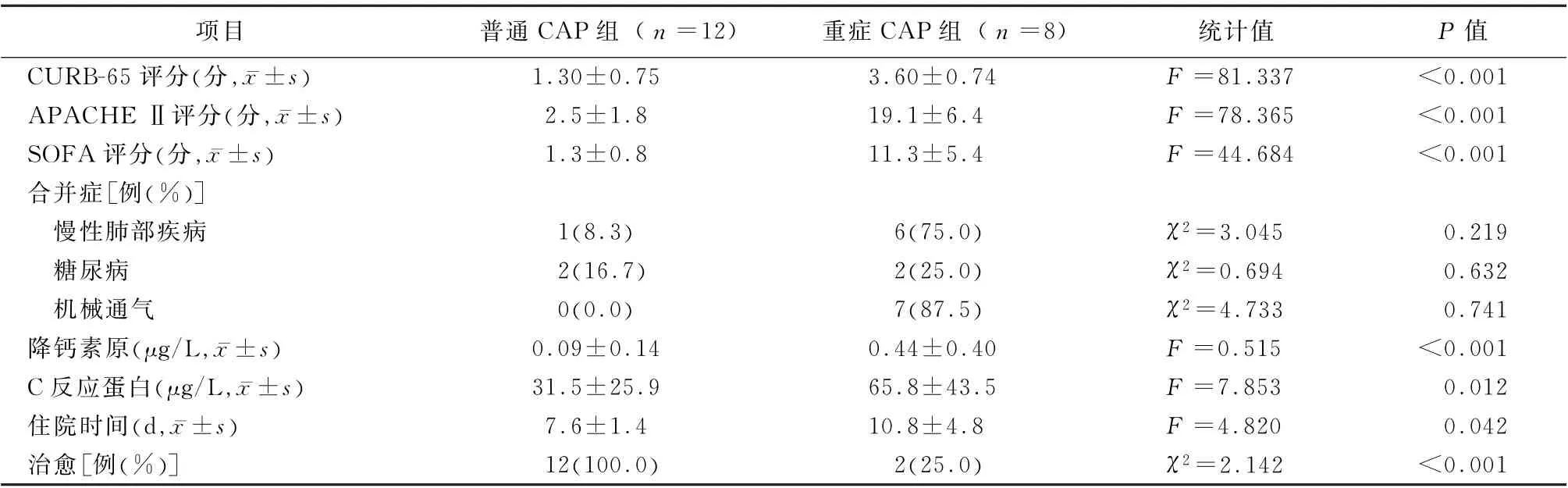
表1 普通CAP组和重症CAP组患者一般资料比较
2.2 蛋白质印迹 利用蛋白质印迹分别检测痰液细胞的NLRP3、IL-1β和TNF-α表达,结果显示:普通CAP组及重症CAP组痰液细胞的NLRP3表达均高于健康对照组,重症CAP组痰液细胞的NLRP3表达高于普通CAP组(P值均<0.05);普通CAP组及重症CAP组痰液细胞的IL-1β表达均高于健康对照组,重症CAP组痰液细胞的IL-1β表达高于普通CAP组(P值均<0.05);普通CAP组及重症CAP组痰液细胞的TNF-α表达均高于健康对照组,重症CAP组痰液细胞的TNF-α表达高于普通CAP组(P值均<0.05)。见表2。
表2 各组痰液标本中NLRP3、IL-1β和TNF-α表达比较(±s)
注:CAP为社区获得性肺炎;TNF-α为肿瘤坏死因子α;与健康对照组比较,a P<0.05;与普通CAP组比较,b P<0.05
组别 例数 NLRP3 IL-1β TNF-α健康对照组 10 0.20±0.14 0.65±0.17 0.94±0.18普通CAP组 12 0.98±0.17a 0.85±0.21a 1.13±0.12a重症CAP组 8 1.16±0.17ab 1.09±0.20ab 1.21±0.09ab F值 114.813 4.469 10.327 P值 <0.001 0.021 <0.001
利用蛋白质印迹分别检测外周血单核细胞中的NLRP3、IL-1β和TNF-α表达,结果显示:普通CAP组及重症CAP组外周血单核细胞中的NLRP3表达均高于健康对照组,重症CAP组外周血单核细胞中的NLRP3表达高于普通CAP组(P值均<0.05);普通CAP组外周血单核细胞中的IL-1β表达高于健康对照组(P<0.05);重症CAP组外周血单核细胞中的TNF-α表达高于普通CAP组及健康对照组(P值均<0.05)。见表3。
表3 各组外周血标本中NLRP3、IL-1β和TNF-α表达比较(±s)
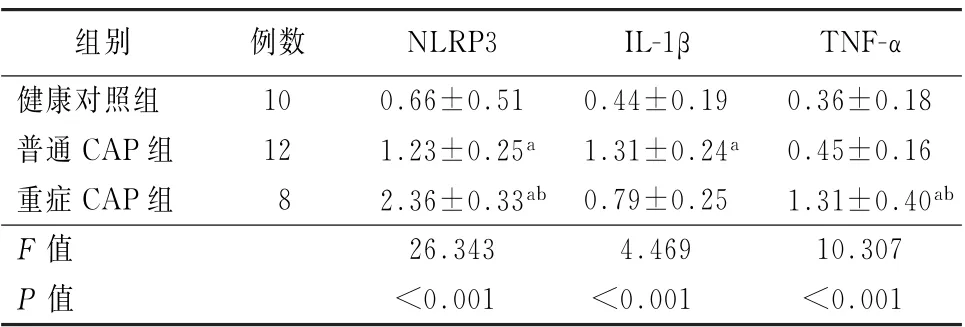
表3 各组外周血标本中NLRP3、IL-1β和TNF-α表达比较(±s)
注:CAP为社区获得性肺炎;TNF-α为肿瘤坏死因子α;与健康对照组比较,a P<0.05;与普通CAP组比较,b P<0.05
组别 例数 NLRP3 IL-1β TNF-α健康对照组 10 0.66±0.51 0.44±0.19 0.36±0.18普通CAP组 12 1.23±0.25a 1.31±0.24a 0.45±0.16重症CAP组 8 2.36±0.33ab 0.79±0.25 1.31±0.40ab F值 26.343 4.469 10.307 P值 <0.001 <0.001 <0.001
2.3 PCR检测 利用RT-PCT检测外周血单核细胞中的NLRP3 mRNA表达,结果显示:普通CAP组及重症CAP组外周血单核细胞中的NLRP3 mRNA表达均高于健康对照组,重症CAP组外周血单核细胞中的NLRP3 m RNA表达高于普通CAP组(P值均<0.05)。见表4。
表4 各组外周血单核细胞中NLRP3 m RNA表达比较(±s)

表4 各组外周血单核细胞中NLRP3 m RNA表达比较(±s)
注:CAP为社区获得性肺炎;与健康对照组比较,a P<0.05;与普通CAP组比较,b P<0.05
组别 例数 NLRP3 m RNA健康对照组 10 0.31±0.35普通CAP组 12 0.46±0.65a重症CAP组 8 0.64±0.78ab F值 21.429 P值 0.002
3 讨论
CAP是全球急诊科就诊和住院治疗的主要疾病之一,2014年美国急诊科就诊人数达423 000例。此外,重症CAP患者需要较高的护理条件,例如进入ICU[4]。据估计,重症CAP占所有ICU入院人数的6%,其中ICU死亡率为35%,整体院内死亡率为50%[5]。CAP给社会造成了严重的经济负担,并对患者造成了极大的死亡风险;因此,早期对重症CAP识别和及时治疗直接关系患者的预后。目前国际上已使用几种常用的评分量化表对肺炎严重程度进行分类并评估住院需求,比如肺炎严重程度指数和CURB 65等量化指标。另外,ATS/IDSA 2007 CAP指南建议ICU入院的主要和次要标准,主要标准是需要机械通气和需要血管加压药的感染性休克。这2个标准也反映了2个最相关的CAP并发症:急性呼吸衰竭和败血症,这些都与高病死率有关。既往研究已经表明NLRP3炎症小体在肺癌、COPD等多种呼吸系统疾病的发病过程中发挥了重要作用[3],在除外慢性活动性肺部疾病以外的CAP患者较少,入选本研究的所有患者均达到所需标准,符合研究要求。
先天性免疫系统是宿主防御的第一道防线,其中种系编码的模式识别受体活化对有害刺激(如病原体入侵、死细胞和环境刺激物等)的反应起到至关重要的作用[6]。目前已发现的模式识别受体有5种,其具有核苷酸结合寡聚化结构域,包括NLR家族成员(如NLRP1、NLRP3和NLRC4),缺乏黑色素瘤2和pyrin等[7]。既往研究表明NLR家族中参与炎症反应的有NLRC4、NLRX1、NLRP1、NLRP3、NLRP10等[2],其中对NLRP3的研究较多。经典NLRP3炎症小体激活需要通过2种不同的信号,分别是启动和激活信号:首先启动信号增加前IL-1β和NLRP3转录,然后第二信号诱导其寡聚化,最终激活其生物学功能。现有的研究已经阐明NLRP3能被多种刺激激活,如细胞外ATP[8]、石棉[9]和流感病毒[10],并参与许多疾病的发病机制[11]。近来的研究表明NLRP3信号与肺部疾病有明显相关性,如该信号与重症哮喘气道炎症反应程度有关[12],NLRP3炎症小体的激活与病毒所致肺部损伤严重程度有关[13]。Witzenrath等[14]的研究表明NLRP3炎症小体激活可能参与肺炎链球菌性肺炎的发生,但缺少相关的临床观察研究。本研究通过APACHEⅡ、SOFA、CURB 65评分等方法将试验对象分为健康对照组、普通CAP组、重症CAP组;利用蛋白质印迹检测痰液细胞和外周血单核细胞的NLRP3表达发现普通CAP组及重症CAP组患者痰液细胞的NLRP3表达均高于健康对照组,重症CAP组痰液细胞的NLRP3表达高于CAP组;同时利用RT-PCT检测外周血单核细胞中的NLRP3 m RNA表达,结果显示:普通CAP组及重症CAP组外周血单核细胞中的NLRP3 m RNA表达高于健康对照组,重症CAP组外周血单核细胞中的NLRP3 m RNA表达高于普通CAP组。因此,笔者推测NLRP3炎症小体的表达可能与CAP的发生发展有关,并且可能与CAP的严重程度有关,需要以后大样本的研究进一步证实。
NLRP3作为一种跨膜结构的受体分子[15],首先是机体免疫系统激活Toll样受体后促进单核/巨噬细胞等通过核转录因子κB通路促进NLRP3和前IL-1β表达。然后是许多细胞事件的共同特征,膜渗透性或孔形成、溶酶体和线粒体损伤,以及活化氧产生等导致的K+外流可激活NLRP3炎症小体[16]。最后,活化的NLRP3炎症小体通过Caspase-1信号促进IL-1β等炎症因子产生,最终参与炎症反应的发生。以上NLRP3信号通路已经被证实不仅与肺部肿瘤性疾病有关[17],并且参与急性肺损伤的发病机制[18]。然而,目前尚未完全阐明NLRP3信号通路在CAP中的作用机制。本研究利用蛋白质印迹分别检测痰液细胞和外周血淋巴细胞的IL-1β和TNF-α表达,结果显示:普通CAP组及重症CAP组痰液细胞的IL-1β表达均高于健康对照组,重症CAP组痰液细胞的IL-1β表达高于普通CAP组;普通CAP组及重症CAP组痰液细胞的TNF-α表达均高于健康对照组,重症CAP组痰液细胞的TNF-α表达高于普通CAP组。另外,普通CAP组外周血单核细胞中的IL-1β表达高于健康对照组,重症CAP组外周血单核细胞中的TNF-α表达显著高于普通CAP组及健康对照组。本研究不足之处有:(1)由于样本量较小并不能分析出CAP中NLRP3炎症小体的敏感性与特异性,以及与其他炎症标志物的相关性;(2)由于既往研究证实NLRP3炎症小体广泛参与肺部疾病的发病机制,因此对肺部炎症应该不具有特异性,尚不能作为肺部疾病鉴别的生物标志物,以上不足需以后大样本、多中心的研究证实。
综合以上研究结果可知,CAP患者NLRP3炎症小体的表达增加,并且不同严重程度的CAP患者表达存在差异;同时,伴随CAP患者炎症因子如IL-1β和TNF-α表达的变化。近来的研究表明[19]阻断NLRP3可以减轻炎症反应并减少病原体感染的机会。由此总结,NLRP3炎症小体在CAP尤其重症CAP中表达较高,推测NLRP3炎症小体活化通路可能参与了CAP患者的炎症反应及免疫调节过程。然而,具体的免疫调节机制及临床意义需要进一步研究加以证实。
利益冲突 所有作者均声明不存在利益冲突
