高温大曲中产香酵母的筛选及特征香气分析
2021-07-13卢延想梁慧珍陈鹏刘正钟成
卢延想,梁慧珍,陈鹏,刘正,钟成*
(1.天津科技大学生物工程学院,天津 300457;2.天士力控股集团有限公司研究院,天津 300410)
酵母菌是白酒酿造过程中必不可少的一类微生物,其种类和数量直接影响白酒的产量和质量。酱香型白酒采用高温制曲工艺,大曲发酵阶段最高温度可达65℃。由于酵母菌普遍不耐高温,主要在温度较低的制曲前期大量繁殖,一般占总微生物数量的2%~5%,随着曲块发酵温度升高酵母菌逐渐死亡,因此制曲后期很少检出酵母菌[1]。大曲出仓后会经过3个月~6个月的储藏期,曲房长期处于通风阴凉干燥状态,环境中的酵母菌和大曲中存活或休眠的酵母菌在大曲上富集和二次生长,因此储藏后的大曲中能够检测到少量酵母菌[2]。随后,曲块粉碎后通过撒曲进入发酵制酒过程。
孔维兵等[3]从酱香大曲中分离到60株酵母,它们分属7个不同的属,分别为伊萨酵母属(Issatchenkiasp.)、假丝酵母属(Candida sp.)、丝孢酵母(Trichosporon sp.)、酵母属(Saccharomyces sp.)、德巴利酵母属(Debaryomyces sp.)、毕赤氏酵母属(Pichia sp.)和复膜孢酵母属(Saccharomycopsis sp.)。 罗方雯等[4]运用高通量测序技术从茅台镇7个主酿酒区域的大曲中共检出33个酵母属,其中复膜孢酵母属(Saccharomycopsis)和威克汉姆酵母(Wickerhamomyces)是绝对优势酵母属;韦元琪等[5]在高温酒曲里筛得一株耐盐且高产海藻糖的库德里阿兹威氏毕赤酵母(Pichia kudriavzevii)。蔡雪梅等[6]筛选到一株产香较好并在酒醅发酵过程中不影响其它风味物质产生的毕赤酵母(Pichia kudriavzevii);罗小叶等[7]从高温大曲中筛得一株产醇和产酯能力较强的扣囊复膜酵母(Saccharomycopsis fibuligera);刘茗铭[8]从大曲中筛得一株高产苯乙醇(113.63 μg/g)的扣囊复膜酵母;WU Q等[9]从酒醅中筛选出9种酵母,并且酿造环境的温度和酸度会影响白酒风味物质的生成。产香酵母可以通过对酸和醇的酯化作用,生成使酒口感醇厚的酯类物质[10]。本研究从高温大曲中筛选产香酵母,解析其主要代谢产物,并模拟酒厂进行发酵,探索产香酵母对白酒酿造的影响以及应用前景。
1 材料与方法
1.1 材料与试剂
高温大曲:取自贵州国台酒厂;酵母蛋白胨葡萄糖(yeast peptone dextrose,YPD)液体培养基、YPD 琼脂培养基、麦芽汁液体培养基:青岛海博生物技术有限公司;糖化酶(15 000 U/g):市售;真菌DNA提取试剂盒:北京索莱宝科技有限公司。固态发酵培养基参考文献[6]的方法制备。液体发酵培养基:YPD液体培养基中加入葡萄糖10%、乙酸0.5%、乙醇2%。
1.2 仪器与设备
DK-S26型水浴锅:上海森信实验仪器有限公司;BX53型电子显微镜:日本OLYMPUS公司;ZHWY-200D型摇床:上海智城分析仪器公司;SHP-250B型生化培养箱;天津天宇实验仪器公司;64R型离心机:美国 Beckman Coulter公司;50/30μm DVB/CAR/PDMS Stableflex萃取头:美国SUPELCO公司;Trace1310-ISQ气相色谱-质谱联用仪、Trace1310气相色谱仪:美国Thermo Fisher公司。
1.3 试验方法
1.3.1 酵母菌的分离纯化
准确称取25 g酱香大曲置于225 mL生理盐水(0.9% NaCl)中,150 r/min 摇床振荡 30 min,充分混合后静置,取100 μL上清液进行平板涂布、平板划线分离。
1.3.2 产香酵母的初筛
将分离纯化后的菌株接种于YPD液体培养基中,30℃、150r/min摇床培养24h。以2%接种量接于100mL液体发酵培养基中,30℃、150 r/min培养6 d。发酵结束后,将发酵液5 000 r/min离心15 min,过0.22 μm滤膜。参照GB/T 10345—2007《白酒分析方法》测定发酵液的总酯[11],筛选产酯香较好的酵母菌做下一步复筛。
1.3.3 产香酵母的复筛
在黑暗中她头晕得想要呕吐,她先是扶住了栏杆,然后呻吟一样唤了一声汪小波。汪小波在暗中板过她的肩头,她的泪适时地淌了出来。
将初筛酵母接种于30mL麦芽汁液体培养基,30℃、150 r/min培养36 h扩培至108cfu/mL,以5%接种量接入固态发酵培养基中,30℃恒温发酵15 d。取2 g发酵产物于顶空瓶中,加入10 mL饱和氯化钠溶液,再加入乙酸薄荷酯内标20 μL(100 mg/L)。60℃顶空瓶中预热10 min后插入固相萃取头吸附40 min,萃取结束后立即插入气相色谱-质谱联用仪(gas chromatographymass spectrometry,GC-MS)进样口热解吸 5 min。 色谱条件:HP-FFAP石英毛细管柱(50m×0.20mm×0.33μm);升温条件:柱温箱温度50℃保持3 min,以3℃/min升温至170℃,再以6℃/min升温至230℃保持5 min,总检测时间50 min;载气流速1.5 mL/min;分流比设为不分流;溶剂延迟4 min;质量扫描范围m/z 30 amu~550 amu,检索NIST库,选取匹配度大于800的物质,采用内标法计算化合物的含量。
1.3.4 菌株鉴定
1.3.4.1 菌株形态学观察及生理生化试验
菌落形态观察:将菌株划线转接到YPD培养基上倒置培养2 d,观察并记录菌落形状、颜色、边缘、光滑度、菌落硬度等菌落特征;细胞显微镜观察:将酵母接种到YPD液体培养基中,30℃、150r/min摇床培养24h,100倍油镜下观察细胞形态特征。
生理生化试验:参照文献[12-13],进行糖发酵试验、碳源同化试验、尿素水解试验、产类淀粉试验。
1.3.4.2 菌株分子鉴定
按照真菌DNA提取试剂盒说明书提取酵母DNA,采用真菌通用引物ITS1、ITS4扩增ITS区,将聚合酶链式反应(polymerase chain reaction,PCR)产物送至华大基因股份有限公司进行18S rDNA序列测序。将测序结果与NCBI数据库中已知序列进行比对,选取基因序列同源性较高的相关酵母菌株的18S rDNA区域序列作为参比对象,用MEGA7.0进行相似性分析并用Neighbor-Joining法构建系统发育树。
1.3.5 产香酵母的模拟生产发酵试验
使用GC检测蒸馏酒样中的25种骨架成分[14],用2-乙基丁酸、叔戊醇、乙酸正戊酯做内标。气相色谱条件:检测器为氢火焰离子化检测器;载气为氮气;氢气流速为35 mL/min,空气流速为350 mL/min;进样口温度200℃,检测器温度250℃;进样量1μL,分流比20∶1;采用 HP-FFAP(30 m×0.53 mm×1.00 μm)色谱柱;升温条件:初始温度37℃,保持7 min;5℃/min升至80℃;以10℃/min升至100℃,保持4 min;再以15℃/min升至200℃,保持7 min。
2 结果与分析
2.1 酵母菌的分离纯化
从高温大曲中共分离纯化出15株酵母菌,编号为Y1~Y15,菌落形态如表1所示。
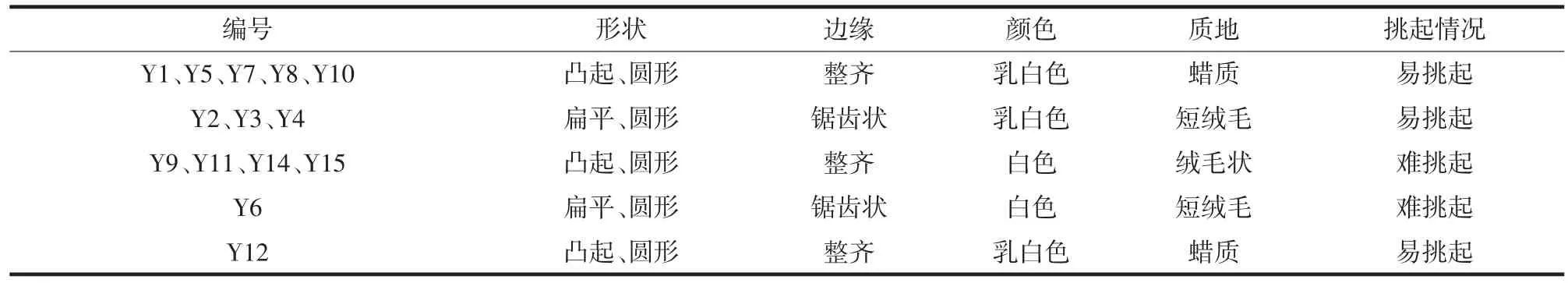
表1 酵母菌落形态描述Table 1 Description of yeast colony morphology
2.2 产香酵母的初筛
酵母产酯能力是酵母产香的重要指标,酵母发酵液总酯含量见图1。
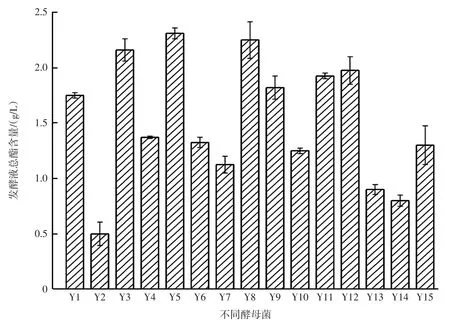
图1 酵母发酵液总酯含量Fig.1 Total ester content in yeast fermentation broth
如图1所示,通过测定酵母发酵液中的总酯含量,从中筛出7株产酯能力较强的酵母菌Y1、Y3、Y5、Y8、Y9、Y11、Y12 进行下一步复筛。
2.3 产香酵母的复筛
将初筛得到的7株酵母菌进行固态发酵,然后对发酵产物进行感官评价和顶空固相微萃取及气相色谱-质谱联用技术(headspace solid-phase microextractiongas chromatography-mass spectrometry,HS-SPME-GCMS)检测,对检出挥发性香气化合物按照类别分为醇类、酯类、酸类、芳香类、酮类、醛类和其它化合物,结果如图2和表2所示。
如图2和表2所示,菌株Y3和Y5检出的挥发性香气化合物含量最高,并且其发酵产物都呈浓郁的果香味。
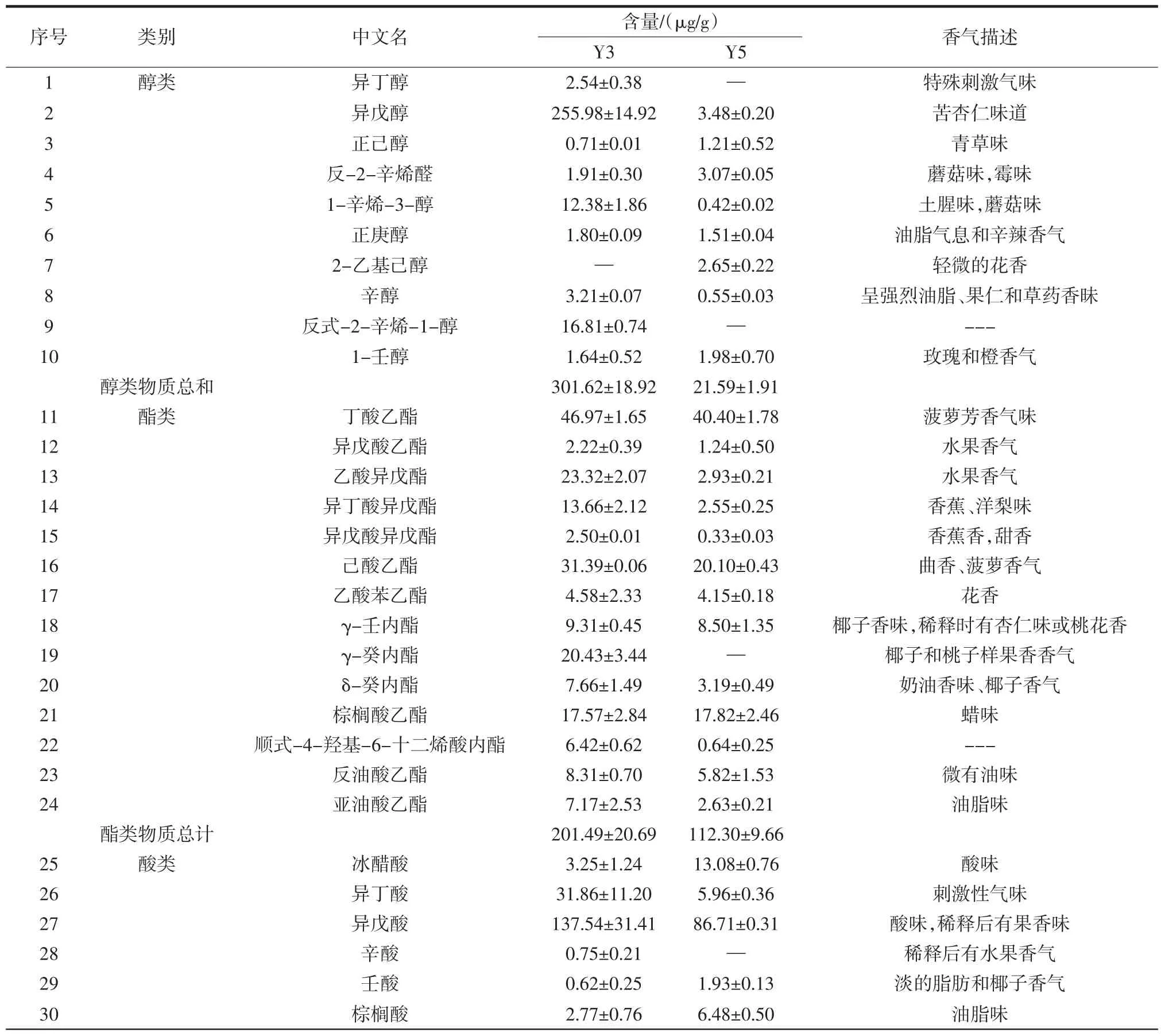
表2 菌株Y3和Y5挥发性香气化合物含量及香气描述Table 2 Strains Y3 and Y5 volatile aroma compound content and aroma description
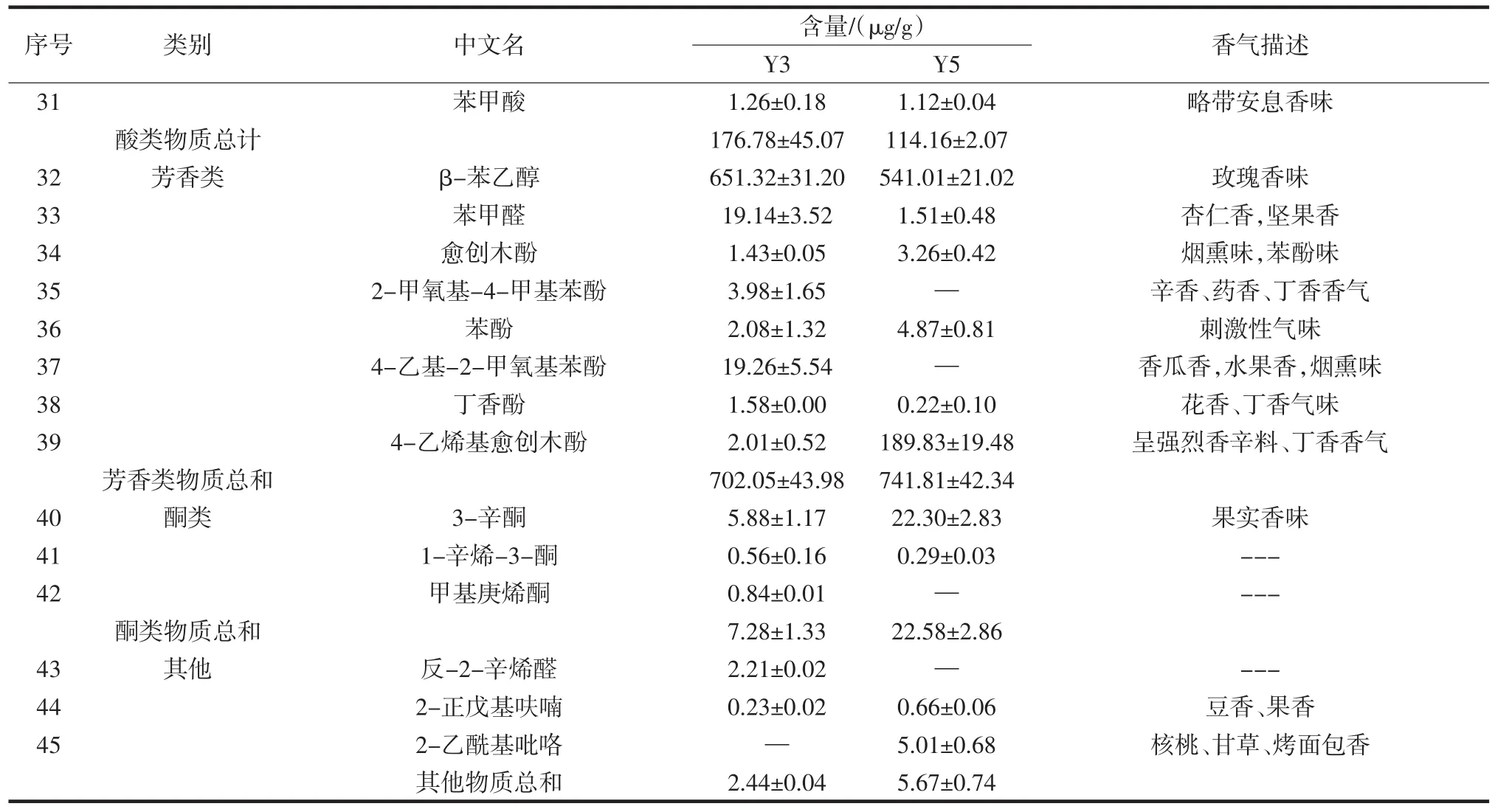
续表2 菌株Y3和Y5挥发性香气化合物含量及香气描述Continue table 2 Strains Y3 and Y5 volatile aroma compound content and aroma description
菌株Y3和Y5发酵产物共检出45种风味物质,总含量分别为 1 410.80 μg/g和 1 019.62 μg/g;从 Y3 中检出43种发酵产物,醇类物质含量较多的是异戊醇(255.98 μg/g)和 1-辛烯-3-醇,异戊醇口感微甜,适当的醇类对白酒起到助香作用[15];酯类物质较多的是丁酸乙酯(46.97 μg/g)、乙酸异戊酯、己酸乙酯(31.39 μg/g)和γ-癸内酯,丁酸乙酯和己酸乙酯属于白酒四大酯,由于其香气活性值较高,是构成白酒独特风格的重要物质[16];γ-癸内酯是较为关键的香气物质且主要是通过酵母菌代谢产生[17]。酸类物质含量较多的有异戊酸(137.54 μg/g)和异丁酸;芳香类化合物β-苯乙醇含量高达651.32 μg/g,是白酒酿造过程中大曲、酒醅、白酒的重要风味物质,赋予白酒玫瑰花香味[18-20];Y5发酵产物检出37种风味物质,其中醇类物质含量较少;酯类含量较多的有丁酸乙酯、乙酸异戊酯、己酸乙酯;酸类物质含量较多的是异戊酸(137.54 μg/g);芳香类物质最多,含量最高的是 β-苯乙醇(541.01 μg/g),其次为4-乙烯基愈创木酚,含量高达189.83 μg/g,它是酱香型白酒大曲中重要的呈香物质之一[21-22]。
2.4 产香菌株的鉴定
2.4.1 菌株形态学以及生理生化试验鉴定
菌株Y3和Y5菌落及细胞形态见图3。
对菌株Y3和Y5进行显微镜检,如图3所示,Y3生殖方式为芽殖,有假菌丝;Y5生殖方式为芽殖,无假菌丝。菌株Y3和Y5的生理生化试验结果见表3。
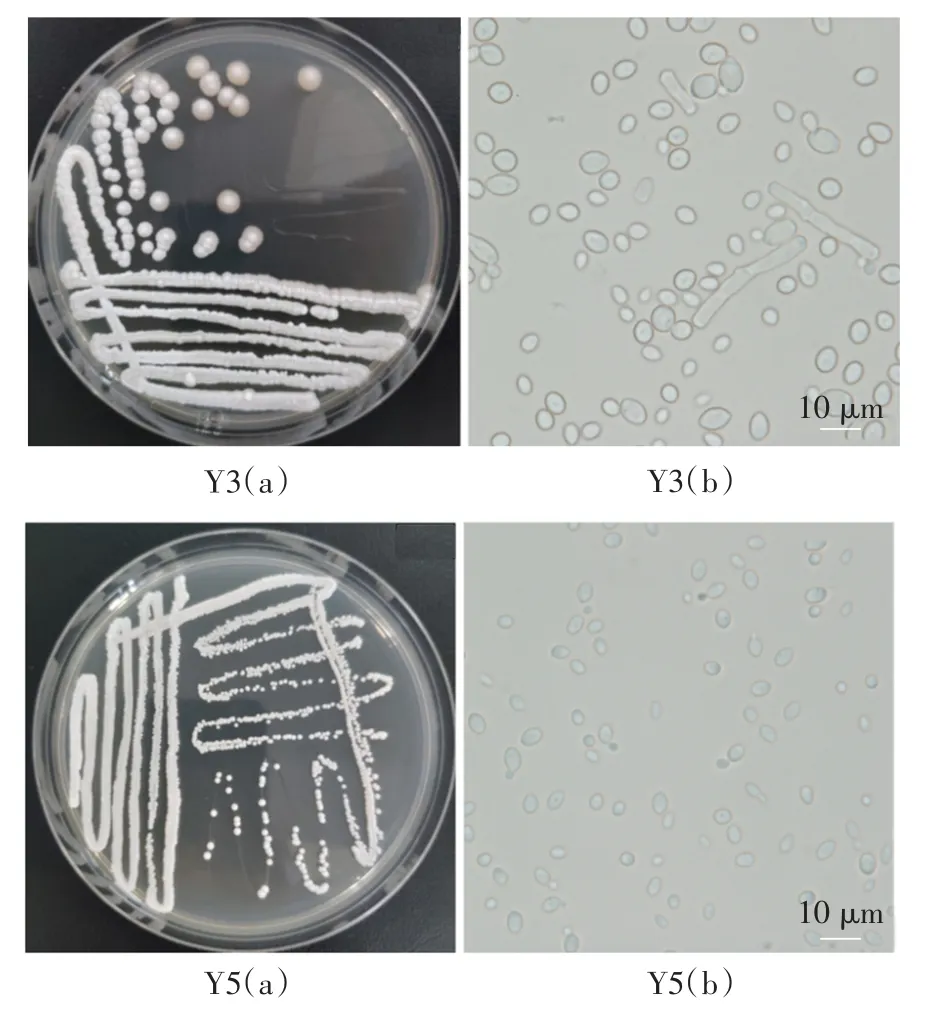
图3 菌株Y3和Y5菌落及细胞形态Fig.3 Colony and cell morphology of strains Y3 and Y5
由表3可知,菌株Y3能利用蔗糖、葡萄糖和麦芽糖,不能利用乳糖,不能利用硝酸钾和分解尿素,不能产类淀粉;菌株Y5能利用蔗糖、葡萄糖、麦芽糖、硝酸钾和尿素,不能利用乳糖,不能产类淀粉。结合显微镜检初步判断Y3属于复膜孢酵母属,Y5属于威克汉姆酵母属。
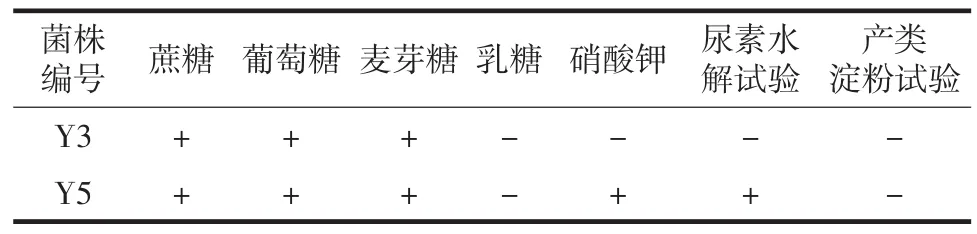
表3 菌株Y3和Y5的生理生化试验Table 3 Physiological and biochemical experiments of strains Y3 and Y5
2.4.2 菌株分子鉴定
将Y3和Y5菌株测序结果在GenBank数据库进行比对分析,选取同源性较高菌株的18S rDNA构建系统发育树,如图4、图5所示。

图4 酵母菌Y3系统发育树Fig.4 Phylogenetic tree of yeast Y3
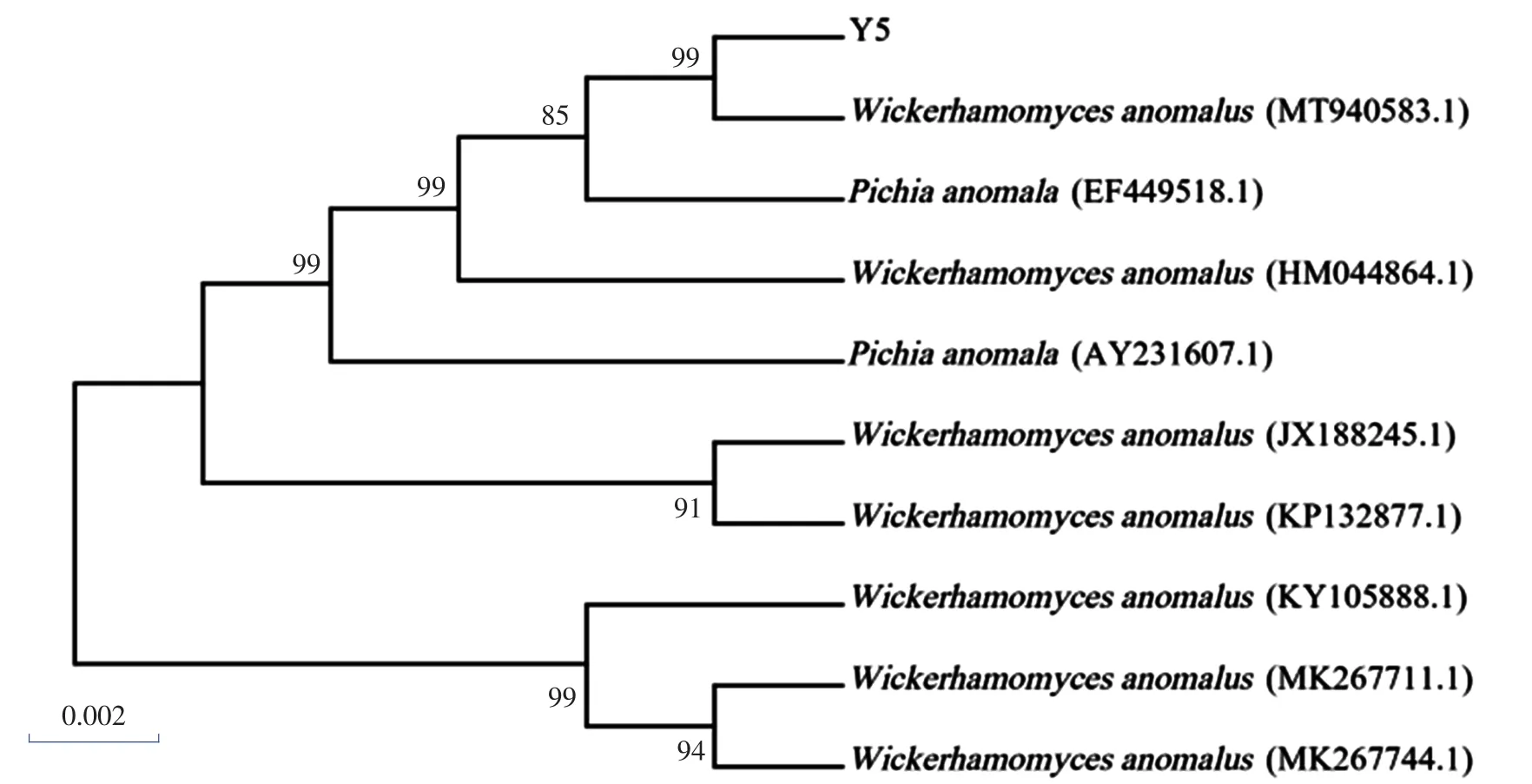
图5 酵母菌Y5系统发育树Fig.5 Phylogenetic tree of yeast Y5
菌株Y3与扣囊复膜酵母(Saccharomycopsis fibuligera KF717373.1)同源性最高,相似度为100%,由此可以确定菌株Y3为扣囊复膜酵(Saccharomycopsis fibuligera);菌株Y5与异常威克汉姆酵母(Wickerhamomyces anomalus MT940583.1)同源性最高,相似度为99%,故确定菌株Y5为异常威克汉姆酵母(Wickerhamomyces anomalus)。
2.5 产香酵母的模拟生产发酵试验
发酵酒醅蒸馏酒样化合物含量见表4。

表4 发酵酒醅蒸馏酒样化合物含量Table 4 Contents of fermented mash distilled wine-like compounds
发酵酒醅蒸馏酒样经GC检测,共测出12种骨架成分,添加酵母Y3的酒醅蒸馏酒样乙酸乙酯和乳酸乙酯含量分别增加了54.17%和43.24%,乙酸含量降低了35.08%,其它物质含量变化较小;添加酵母Y5的酒醅蒸馏酒样苯乙醇含量提高了118.33%,异戊醇含量提高了22.67%,其它物质含量变化较小,其它风味物质变化较小的原因可能是酿酒酵母对于产香酵母的生长有抑制作用[23-24];等比例添加酵母Y3和Y5的酒醅蒸馏酒样乙酸乙酯、乳酸乙酯和β-苯乙醇的含量分别提高了41.66%、56.76%、92.37%,并且感官闻香上更加协调和丰富。因此,产香酵母Y3和Y5可以用于白酒的酿造中,提高酒体中的酯类物质和芳香类物质的含量,从而提升白酒品质。
3 结论
从高温大曲中经过分离纯化、液态发酵产香初筛和固态发酵产香复筛,获得两株产香较好的酵母菌株Y3和Y5,菌株Y3、Y5固态发酵产物经HS-SPMEGC-MS分别检出43种和37种挥发性香气物质,Y3固态发酵产物主要香气物质为β-苯乙醇(651.32μg/g)、异戊醇(255.98 μg/g)、异戊酸(137.54 μg/g)和丁酸乙酯;Y5固态发酵产物主要香气物质为β-苯乙醇(541.01 μg/g)、4-乙烯基愈创木酚(189.83 μg/g)和异戊酸。经过形态学、生理生化试验以及分子鉴定确定Y3为扣囊复膜酵母(Scchromycopsis fibuliger),Y5为异常威克汉姆酵母(Wickerhamomyces anomalus)。将Y3、Y5以及Y3和Y5等比例混合的菌悬液加至酒醅中进行模拟酱香型白酒生产发酵,使用GC测定蒸馏液中骨架成分。结果表明,Y3、Y5等比例混菌发酵使酒中乙酸乙酯、乳酸乙酯和β-苯乙醇的含量分别提升41.66%、56.76%、92.37%,使酒体更加协调。验证了产香酵母对于提高白酒风味物质含量的重要作用[25],进一步展现了产香酵母在白酒酿造过程中的应用前景。
