酵母菌代谢产物对植物乳杆菌AB-1生产苯乳酸的影响
2021-07-13张成林钱怡霖刘尊英
张成林,钱怡霖,刘尊英
(中国海洋大学食品科学与工程学院,山东 青岛 266003)
苯乳酸(phenyllactic acid,PLA),也称 2-羟基-3-苯基丙酸,是一种微生物通过次级代谢产生的新型天然抗菌物质,对多种食源性致病菌和食品腐败菌有很强的抑制作用,具有安全、高效、广谱等特点。苯乳酸是传统发酵食品中植物乳杆菌的代谢产物之一,广泛存在于各种发酵食品中,在食品工业具有广阔的应用前景[1-3]。前期研究表明,培养基成分对植物乳杆菌的苯乳酸产量会产生一定的影响,优化培养基组成能够促进苯乳酸的生成[4-5];另外,酵母菌代谢产物能够促进植物乳杆菌的生长[6],向植物乳杆菌培养基中添加适量的代谢产物也有利于提高有机酸产量[7]。
本研究以植物乳杆菌AB-1(Lactobacillus plantarum AB-1)为研究对象,使用MRS培养基进行培养,通过优化培养基成分、外源添加酵母菌无细胞发酵上清液(cell-free supernatant,CFS)的方式,探究不同因素对植物乳杆菌AB-1生长代谢以及苯乳酸产量的影响,以期为苯乳酸的生物法高效制备提供基础性研究数据,为开发新型食品生物防腐剂提供参考。
1 材料与方法
1.1 材料与设备
1.1.1 材料与试剂
植物乳杆菌AB-1:内蒙古农业大学张和平教授团队馈赠;酿酒酵母Saccharomyces cerevisiae 606(E1)、酿酒酵母 Saccharomyces cerevisiae 626(E2):中国海洋大学水产品高值化利用实验室保存菌种。苯乳酸标准品(纯度≥98%):Sigma公司;苯丙氨酸、α-酮戊二酸、葡萄糖、蛋白胨、吐温80、牛肉浸粉、KH2PO4(分析纯):国药集团化学试剂有限公司;甲醇、三氟乙酸(色谱纯):Merck公司;初始MRS培养基(葡萄糖20.0 g/L、蛋白胨10.0 g/L、牛肉浸粉8.0 g/L、吐温 80 1.0 g/L、柠檬酸氢二铵2.0 g/L、乙酸钠5.0 g/L、磷酸氢二钾2.0 g/L、硫酸镁0.2 g/L)、酵母浸出粉胨葡萄糖培养基(yeast extract peptone dextrose medium,YPD)(葡萄糖 20.0 g/L、蛋白胨20.0g/L、酵母浸粉10.0 g/L)、LB培养基(蛋白胨10.0g/L、酵母浸粉5.0g/L、氯化钠10.0g/L):青岛海博生物技术有限公司。
1.1.2 仪器设备
SpectrumLabS23A紫外-可见分光光度计:上海棱光技术有限公司;LC-20AT液相色谱仪:日本岛津公司;Agilent Zorbax SB-C18反相色谱柱:美国安捷伦公司;TSQ 280恒温培养箱:上海精宏设备有限公司;SPX型智能生化培养箱:宁波东南仪器有限公司。
1.2 方法
1.2.1 苯乳酸含量测定
采用反相高效液相色谱法(reversed-phase high performance liquid chromatography,RP-HPLC)测定苯乳酸含量,参考杨小院等[8]的方法略作修改。发酵液预处理:发酵液先经过10 000 r/min离心处理10 min,将上清液用微滤膜 (0.22 μm)过膜。色谱柱为Agilent Zorbax SB-C18柱(4.6 mm×150 mm,5 μm);检测波长210 nm;柱温 30 ℃;流速 1 mL/min;进样量 10 μL;流动相:A为0.05%三氟乙酸的甲醇溶液,B为0.05%三氟乙酸的水溶液;梯度洗脱条件:0~20 min(10%A→100%A),20 min~23 min(100%A→100%A),23 min~25 min(100%A→10%A)。
1.2.2 初始MRS培养基成分优化
配制不同含量的葡萄糖(G)(20.0、22.5、25.0、27.5、30.0、35.0、40.0、50.0、60.0、100.0 g/L)、蛋白胨(P)(10.0、15.0、20.0、30.0、35.0、40.0、50.0 g/L)、 吐温 80(1.0、3.0、6.0、9.0、13.0、15.0、18.0 g/L)、牛肉浸粉(8.0、10.0、12.0、14.0、16.0、18.0、20.0 g/L)的 MRS 培养基,将植物乳杆菌AB-1按照1%接种量接种,37℃静置培养24 h,测定PLA含量。
根据结果发现,分别增加初始MRS培养基中葡萄糖和蛋白胨的含量均有利于苯乳酸产量的提高,继续探究同时增加两种组分对苯乳酸产量的影响,试验分为4组,以初始MRS培养基作为对照组Ⅰ。试验过程中其它组分的含量均与对照组Ⅰ相同,仅改变葡萄糖、蛋白胨的含量,不同组别培养基组分添加量见表1。
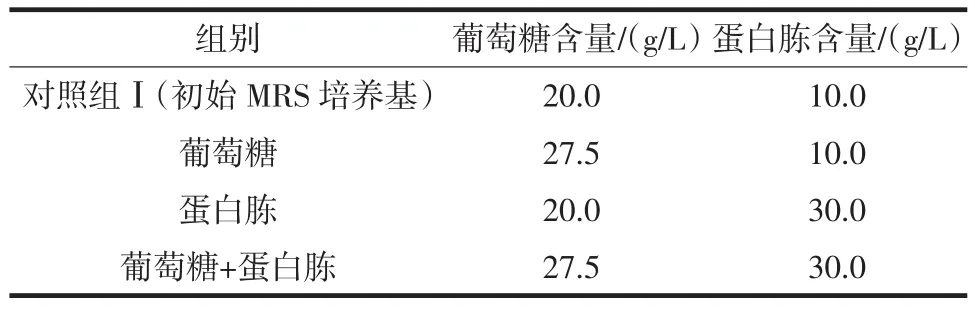
表1 不同组别培养基组分添加量Table 1 Addition of medium components in different groups
1.2.3 植物乳杆菌AB-1生长曲线绘制
采用光密度法绘制植物乳杆菌AB-1生长曲线。将菌株接种在MRS固体培养基上,37℃静置培养14 h后,挑取单菌落进行固体平板划线分离纯化,长出单菌落后接种至MRS液体培养基中,培养至稳定期,然后用移液枪吸取50 μL稳定期菌液分别接种至5 mL优化MRS培养基和初始MRS培养基中(组别见表1),静置培养,每隔2 h测定1次菌液在600 nm下的光密度值(OD600),每组3个平行,以OD值为纵坐标、培养时间为横坐标(h),绘制生长曲线,以初始MRS培养基作为对照组Ⅰ。
1.2.4 苯丙氨酸含量测定
参照杨立志等[9]的方法并略作修改,检测器:DAD检测器;流动相:流动相A为0.6%乙酸水溶液;流动相B为甲醇;柱温:30℃;流速:0.7 mL/min;进样体积:20 μL;分离柱型号:C18 Agilent ZORBAX SB-Aq(4.6×250 mm,5 μm); 检测波长:258 nm。 洗脱程序: 0~12 min(80%A→80%A),12 min~15 min(80%A→40%A),15 min~27 min(40%A→40%A),27 min~30 min(40%A→80%A)。
1.2.5 α-酮戊二酸含量测定
检测器:紫外吸收检测器;流动相:采用0.08 mol/L KH2PO4(pH 3.00);柱温:30℃;流速:0.5 mL/min;进样体积:10 μL;色谱柱:Atlantis T3色谱柱(4.6 mm×150 mm,5 μm);检测波长:210 nm。
1.2.6 酵母菌CFS的制备
将酵母菌E1、E2在YPD固体培养基中活化2代,挑取单菌落接种至YPD液体培养基中,30℃振荡培养20、40h,分别收集发酵液,10000r/min 离心 10min,再经0.22 μm滤菌器过滤除菌,得到酵母菌CFS,于-80℃保存待测[10]。
1.2.7 酵母菌CFS对植物乳杆菌AB-1生产PLA的影响
植物乳杆菌AB-1按照1%的接种量接种至优化后的MRS培养基中,保证初始菌体浓度一致,分别将YPD培养基与发酵20、40 h的两株酵母菌E1、E2的上清液按照5%、10%、15%、20%、30%的比例添加到优化后的MRS培养基中,同时以YPD培养基作为对照组Ⅱ,测定24 h后苯乳酸含量。
1.2.8 酵母菌CFS对植物乳杆菌AB-1生长的影响
植物乳杆菌AB-1按照1%的接种量接种至优化后的MRS培养基中,保证初始菌体浓度一致,然后外源添加15%经40 h发酵的酵母菌E1 CFS作为CFS组,同时以添加等量的YPD培养基作为对照组Ⅱ,分别测定植物乳杆菌AB-1的生长曲线。
1.3 数据处理
试验处理3次重复,数据处理分析及作图采用O-rigin 2017及SPSS 24.0,结果以平均值±标准偏差表示,单因素方差分析采用最小显著性差异法(least significant difference,LSD),P<0.05 为差异显著。
2 结果与分析
2.1 植物乳杆菌AB-1培养基优化研究
葡萄糖作为植物乳杆菌生长代谢中的碳源[11],在苯乳酸合成过程中发挥重要作用,因此,研究不同葡萄糖含量的MRS培养基对植物乳杆菌AB-1产生苯乳酸的影响见图1。

图1 不同培养基成分对苯乳酸产量的影响Fig.1 Effect of different medium concentrations on the phenyllactic acid production of L.plantarum AB-1
如图1(A)所示,在一定浓度范围内,随初始MRS培养基中葡萄糖含量增加,植物乳杆菌AB-1苯乳酸产量显著提高,当葡萄糖浓度达到27.5 g/L时,苯乳酸产量达到峰值96.5 mg/L。葡萄糖作为糖酵解的重要底物,适当增加葡萄糖浓度可以促进糖酵解途径[5],从而产生更多柠檬酸进入三羧酸循环,促进苯乳酸产生。随着葡萄糖浓度的进一步增加,苯乳酸产量开始降低,产生该结果的原因可能是过高的糖含量并不利于植物乳杆菌AB-1的生长,从而影响其次级代谢途径。
蛋白胨富含氨基酸,是植物乳杆菌生长代谢中的重要氮源,其中苯丙氨酸可作为苯乳酸合成的底物。如图1(B)所示,在一定浓度范围内,随着蛋白胨添加量的提高,植物乳杆菌AB-1的苯乳酸产量增加,当蛋白胨添加量为30 g/L时,苯乳酸产量达到93.0 mg/L。由此可见,适当增加蛋白胨的浓度,提供更多苯丙氨酸底物[12-13],可促进苯乳酸的产生。
吐温80作为一种表面活性剂,对培养基成分的均匀分布具有显著影响。如图1(C)所示,随着吐温80浓度的增加,苯乳酸的产量出现降低的趋势,该现象可能是由于吐温80改变了植物乳杆菌AB-1细胞壁的通透性,胞内代谢产物的流出导致苯乳酸无法正常合成[14]。
牛肉浸粉是发酵过程中的有机氮源,但牛肉浸粉浓度的增加对苯乳酸产量并未产生显著影响。如图1(D)所示,初始MRS培养基的氮源已基本达到饱和,无需更多氮源的添加。
葡萄糖和蛋白胨联合添加对植物乳杆菌AB-1生长和苯乳酸产量的影响见图2。
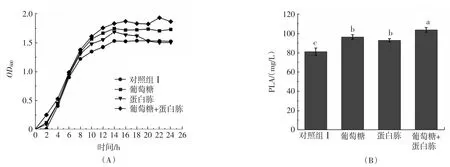
图2 葡萄糖和蛋白胨联合添加对植物乳杆菌AB-1生长和苯乳酸产量的影响Fig.2 Effects of combined glucose and peptone on the growth and PLA production of L.plantarum AB-1
如图2(A)所示,相对于单独增加葡萄糖、蛋白胨的结果,同时增加两组分的含量更能显著促进植物乳杆菌AB-1的生长;图2(B)所示,两组分的共同添加进一步提高了植物乳杆菌AB-1的苯乳酸产量,由初始的81.2 mg/L提高至103.8 mg/L,说明同时增加葡萄糖和蛋白胨可促进植物乳杆菌AB-1的生长繁殖、提高细菌总量,从而达到提高苯乳酸产量的目的,此时得到优化MRS培养基(葡萄糖浓度27.5 g/L,蛋白胨浓度30 g/L,其余组分与初始MRS培养基相同)。
2.2 不同发酵时间和酵母菌CFS添加量对植物乳杆菌AB-1生长趋势及苯乳酸产量的影响
前期研究表明,酵母菌CFS中的代谢产物对植物乳杆菌生成有机酸具有一定的促进作用,但详细机理尚未表征。在优化MRS培养基基础上,进一步探究不同培养时间和不同添加量酵母菌CFS对植物乳杆菌AB-1生产苯乳酸的影响见图3。
由图3A、图3B可知,对比相同添加量下不同发酵时间的影响,发酵40 h后的CFS均比发酵20 h的CFS更能提高总PLA含量,说明适当延长酵母菌的培养过程可积累更多的代谢产物,而这些代谢产物进一步促进了植物乳杆菌AB-1代谢生成苯乳酸;当添加量为15%时,酵母菌E1、E2 CFS对苯乳酸的促进作用均显著优于对照组Ⅱ,此时酵母菌CFS能最好的发挥作用,比例继续提高时促进作用反而减弱,推测是因为酵母菌CFS的添加稀释了原本的培养基,使得植物乳杆菌AB-1可直接利用的碳源和氮源减少,从而减少了苯乳酸的生成;由图3(C)可知,在酵母菌CFS发酵时间为40 h,添加量为15%的条件下,酵母菌E1比E2更能促进植物乳杆菌AB-1生产苯乳酸,说明酵母菌E1可能在培养过程中会产生更多有利的次级代谢产物。综上,在优化MRS培养基基础上,以15%的比例添加酵母菌E1发酵40 h的CFS,对植物乳杆菌AB-1苯乳酸的生成产生最大的促进作用,使PLA含量达到130.2 mg/L,相较于不加酵母菌CFS的优化MRS培养基和初始MRS培养基分别提高了25.4%和60.3%。
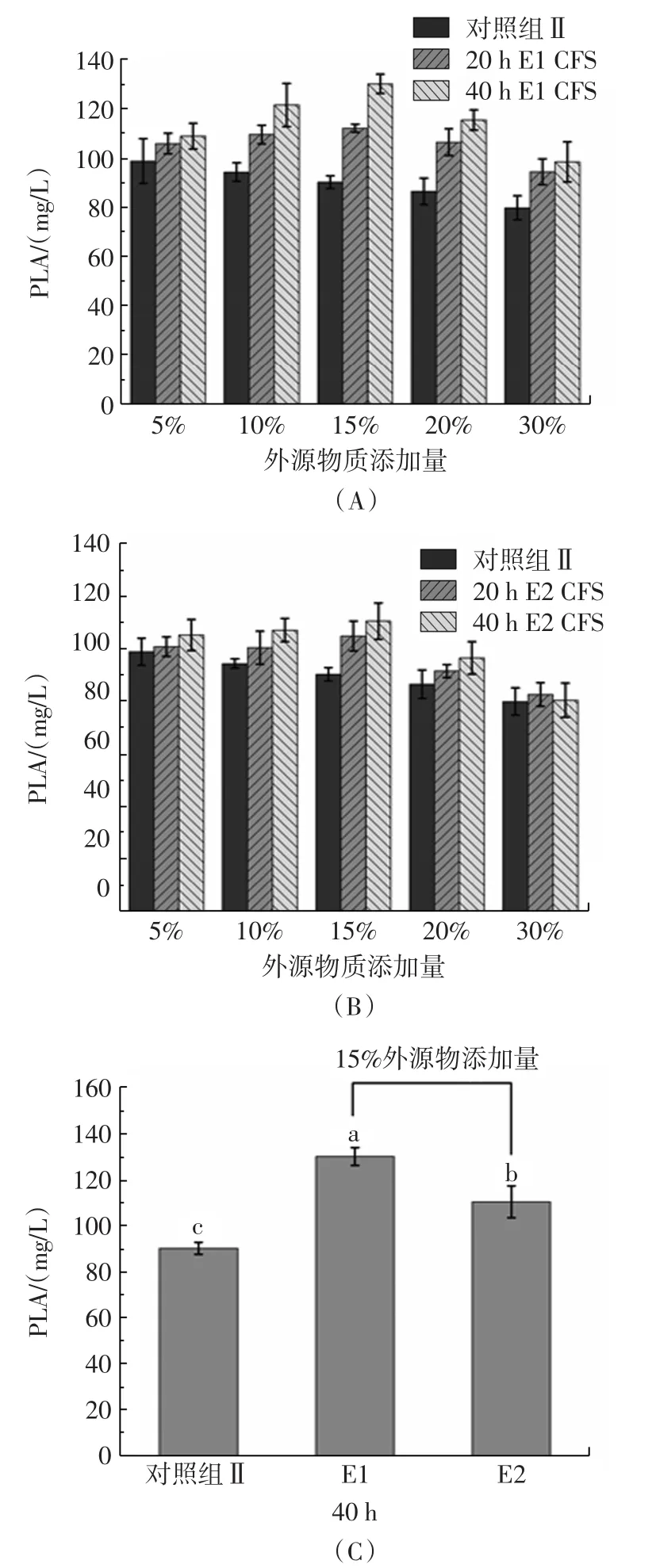
图3 不同发酵时间和酵母菌CFS添加量对植物乳杆菌AB-1苯乳酸产量的影响Fig.3 Effect of yeast CFS with different fermentation time and content on the production of PLA by L.plantarum AB-1
根据以上结果,在优化MRS培养基的基础上,以外源物添加15%经40 h发酵的酵母菌E1 CFS作为CFS组,外源添加等量的YPD培养基作为对照组Ⅱ,探究酵母菌CFS对植物乳杆菌AB-1生长趋势的影响,结果见图4。
如图4所示,从12 h起,CFS组与对照组Ⅱ的生长趋势产生差异,这种差异随着时间的增长逐渐加大,表明酵母菌CFS可通过促进植物乳杆菌AB-1的生长提高苯乳酸的产量。

图4 酵母菌CFS对植物乳杆菌AB-1生长趋势的影响Fig.4 Effects of yeast CFS on the growth of L.plantarum AB-1
2.3 酵母菌CFS促进植物乳杆菌AB-1产苯乳酸的机制探究
利用反相高效液相色谱检测酵母菌CFS中的苯乳酸,结果见图5。
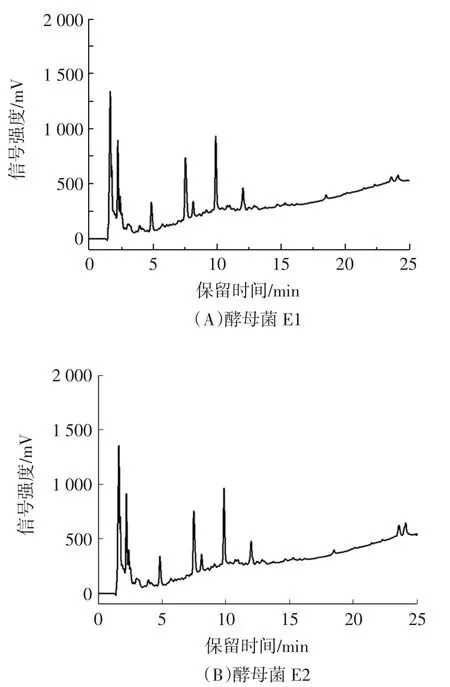
图5 酵母菌CFS苯乳酸检测Fig.5 Determination of phenyllactic acid in yeast CFS
结果表明,酵母菌E1、E2 CFS中均未发现苯乳酸在12.25 min处的特征吸收峰,说明酵母菌自身代谢不会产生苯乳酸,植物乳杆菌AB-1培养基内PLA含量的增加并不是外源引入导致的。
排除了外源引入苯乳酸的干扰,对苯乳酸的生物合成过程进行探究。苯乳酸生物合成的核心途径主要包括两个步骤:1)苯丙氨酸(phenylalanine,Phe)经过转氨作用生成苯丙酮酸 (phenylpyruvic acid,PPA),其α-氨基通过转氨酶转移到合适的受体,如α-酮戊二酸(α-KG);2)PPA 被乳酸脱氢酶(lactate dehydrogenase,LDH)进一步还原成为 PLA[8]。
TACHIBANAS等通过代谢组学的研究发现,酵母菌代谢产物中含有包括苯丙氨酸、甘氨酸、丝氨酸、谷氨酸、天冬氨酸等多种氨基酸[15],其中Phe是PLA生物合成的重要底物。因此,分别测定了酵母菌E1和E2在发酵40 h的CFS中Phe的含量,见图6。
如图6(A)所示,酵母菌E1发酵40 h的CFS中Phe的含量为379.6 mg/L,显著高于其它3组,由图6(C)可知,在一定浓度范围内,Phe的浓度与PLA的产量呈正相关。酵母菌CFS中确实含有Phe,且Phe有促进植物乳杆菌AB-1产生PLA的作用。
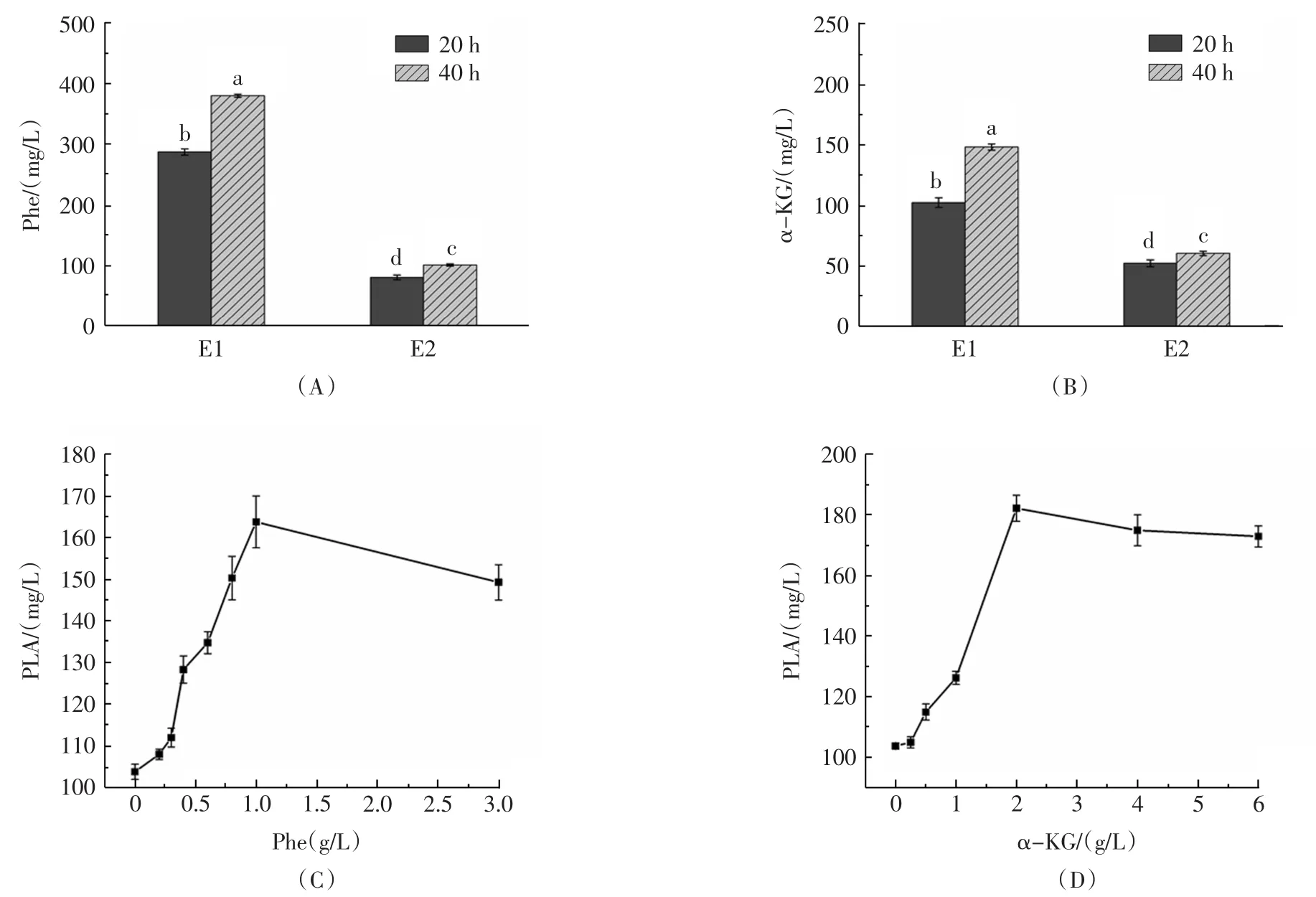
图6 酵母菌代谢产物成分分析及验证Fig.6 Analysis and validation of the yeast metabolites
房峻等[16]的研究表明,部分酵母菌具有积累α-KG的能力,累积的α-KG可以作为α-氨基的受体推动苯丙氨酸的转氨过程,从而加速苯乳酸的产生。因此,分别测定酵母菌E1和E2在发酵40 h的CFS中α-KG的含量。如图6(B)所示,酵母菌E1发酵40 h的CFS中α-KG的含量为148.3 mg/L,显著高于其它3组。由图6(D)可知,在一定浓度范围内,α-KG的浓度与PLA的产量呈正相关。这些数据表明,酵母菌CFS中确实含有α-KG,且α-KG有促进植物乳杆菌AB-1产生PLA的作用。
综上,酵母菌CFS中本身并不含有PLA,但含有一定浓度的Phe和α-KG,两者均是苯乳酸生物合成过程中的重要底物。当酵母菌CFS加入到优化MRS培养基后,Phe和α-KG浓度的增加促进了苯乳酸的快速合成,提高了植物乳杆菌AB-1代谢生成苯乳酸的效率。
3 结论
培养基组成影响植物乳杆菌AB-1生产苯乳酸,优化MRS培养基组分有助于提高苯乳酸产量,当把初始MRS培养基中的葡萄糖浓度由20 g/L提高至27.5 g/L,蛋白胨浓度由10 g/L提高至30 g/L时,植物乳杆菌AB-1的苯乳酸产量可提高27.8%。外源添加酵母菌CFS有助于提高植物乳杆菌AB-1的PLA产量,当以15%的比例向优化后的MRS培养基中添加E1酵母菌发酵40 h的CFS,PLA产量会大幅提高,由初始培养基的81.2 mg/L提高至130.2 mg/L,相较于优化MRS培养基和初始MRS培养基分别增长了25.4%和60.3%。酵母菌CFS包含较高浓度的Phe和α-KG,两者均是苯乳酸的生物合成过程的重要底物,酵母菌CFS可能通过加快PLA的生物合成过程来促使植物乳杆菌AB-1产生苯乳酸。
综上所述,本研究通过优化培养条件,显著的增加了植物乳杆菌AB-1的苯乳酸产量,为工业规模生产苯乳酸提供了参考,也为后续培养条件的优化试验提供了借鉴。
