双酶酶解驴骨泥工艺优化及酶解液抗氧化性、氨基酸含量分析
2021-07-13于智慧郭艳周丽媛朱迎春
于智慧,郭艳,周丽媛,朱迎春
(山西农业大学食品科学与工程学院,山西 太谷 030801)
骨是肉加工中的副产物,大多被抛弃或作为加工饲料的原料,占动物体质量的15%左右,含有丰富的蛋白质(胶原蛋白)、脂肪、矿物质(如钙、磷、铁)等人体所需的营养物质。骨中蛋白质和脂肪含量可与鲜肉媲美,并且其含有构成蛋白质的所有氨基酸[1]。因此,骨资源利用对于提高动物性食品附加值具有重要的指导意义。
国内外针对动物性骨再加工利用已有许多报道。国外已率先开发出骨泥和骨蛋白粉等制品以及可溶性蛋白制品。在我国也出现了一批研制骨泥加工机械的单位,研制出骨头专用成套碎骨机、骨泥磨、超微粉碎设备、超微研磨设备,并且开发出骨髓粉、骨精、钙磷制剂和食用明胶,其主要用于食品调味剂和添加剂。近年来,国内众多研究者致力于通过酶解法和微生物发酵法降解骨资源,以期开发出生物态补钙制品。
我国是世界上养驴最多的国家,驴的饲养量和屠宰量以每年11%~12%的速度递增[2]。随着驴肉生产和屠宰加工的快速发展,驴骨作为其主要副产物数量也在不断增加。据报道,驴骨营养价值较高,富含蛋白质、脂肪和丰富矿物质等,具有很高的开发利用价值[3-4]。缪福俊等[5]将新鲜驴骨经过预处理后采用木瓜蛋白酶进行水解确定出制备驴骨多肽的最佳酶解条件。刘楚怡等[3]以驴骨粉为原料,采用风味蛋白酶酶解制备不同分子量驴骨肽,确定具有抗骨质疏松活性的不同分子量驴骨肽的制备方法。由于酶法水解温和,大量骨矿化的钙磷存在于骨渣中,对骨钙的转化效果仅为1/6[6-7]。且由于酶的专一性,单酶水解方法并不适用于完整的蛋白质大分子。
为了提高底物的转化率,本试验根据不同蛋白酶的特定催化位点不同,采用双酶分段水解的方法,将蛋白质水解成更多的氨基酸和多肽,从而达到酶解蛋白质的效果。随后以水解度、可溶性多肽得率为评价指标,从5种不同的蛋白酶中筛选出水解驴骨泥蛋白效果较好的两种酶,进行双酶分段水解驴骨泥,通过正交试验优化双酶酶解工艺,并测定其氨基酸的组成和抗氧化性能,从而为驴骨蛋白的综合利用和深度开发提供理论依据。
1 材料与方法
1.1 材料与试剂
新鲜完整的剔肉驴骨:山西太谷县小常驴肉厂家;酚酞、甲醛、三氯乙酸、三氯化铁、铁氰化钾、邻苯三酚、硫酸亚铁、水杨酸、牛血清蛋白、蛋白胨、牛肉膏、无水乙酸钠、吐温80、柠檬酸二铵:天津化学试剂一厂;复合蛋白酶(120 U/mg)、风味蛋白酶(2 000 U/mg):上海金穗生物科技有限公司;木瓜蛋白酶(800 U/mg)、胰蛋白酶(250 U/mg)、胃蛋白酶(1 200 U/mg):四川乐山井研食品有限公司;无水葡萄糖、磷酸氢二钾、酵母粉、硫酸锰、氯化钠、铬黑T、三乙醇胺、钙标准溶液:天津市科密欧化学试剂有限公司。以上化学试剂均为分析纯。
1.2 仪器与设备
PGJ-850强力破骨机:廊坊市惠友机械有限公司;GN-130不锈钢骨泥磨:荥阳市恒盈建筑机械厂;LD5-2B低速离心机:北京雷勃尔医疗器械有限公司;JM-L胶体磨:温州市龙湾永兴华威机械厂;HY-2调速多用振荡器:常州国华电器有限公司;DHG-9243BS-Ⅲ电热恒温鼓风干燥箱:上海新苗医疗器械制造有限公司;BSA-124S-CW电子天平:上海精密科学仪器公司;ZKW-4电热恒温水浴锅:常熟市天量仪器有限责任公司;YE4D350189移液枪:上海求精生化试剂仪器有限公司;PB-10酸度计:瑞典Sartorius公司;WFJT200可见分光光度计:尤尼科仪器有限公司;YXQ-LS-S2立式压力蒸汽灭菌器:上海博迅实业有限公司;L-8800氨基酸自动分析仪:日立(中国)有限公司。
1.3 方法
1.3.1 驴骨泥的制备
将驴骨洗干净后按固液比1∶3(g/mL)加水,放入灭菌锅中经121℃蒸煮30 min,取出后沥干,剔除骨头上的碎肉,去除骨髓,加沸水煮制弃掉上层油脂,沥干。用强力破骨机将驴骨块破碎至直径5 mm~10 mm的骨块;将碎骨块投入骨泥磨进行磨制,制得骨泥,磨制过程中加入冰屑,使骨泥处于低温;将制得的骨泥投入胶体磨再次磨制,得到超微粉碎的骨泥,手感细腻柔滑,冷冻贮存备用。
1.3.2 骨泥酶解工艺流程
冷冻骨泥→解冻→加水匀浆→加酶→调pH值→恒温酶解→100℃灭酶15 min→冷却→5 000 r/min离心20 min→蛋白酶解液
1.3.3 最适蛋白酶的筛选
称取适量骨泥,按固液比为1∶2(g/mL)加入蒸馏水,在恒温水浴中不断搅拌,分别添加胰蛋白酶、复合蛋白酶、胃蛋白酶、风味蛋白酶和木瓜蛋白酶,加酶量1.5%,在各自最佳酶解温度和pH值下,酶解3 h测水解度、可溶性多肽得率,选出合适的蛋白酶。风味蛋白酶、木瓜蛋白酶、复合蛋白酶、胰蛋白酶、胃蛋白酶的最适温度分别为50、45、50、55、37℃,最适pH值分别为7.0、6.5、7.0、8.0、3.0。
1.3.4 双酶添加顺序的选择
从1.3.3中选出水解度和可溶性多肽得率最高的两种酶A和B。设定双酶添加方式为:先加A后加B;先加B后加A;A与B同时加入。计算水解度、可溶性多肽得率,比较不同双酶组合酶解的效果。
双酶酶解时,先利用酶A进行酶解,其最佳条件已有许多研究报道,本文通过预试验也得以证实,故不再做深入分析。但是酶A酶解结束后再加入酶B进行酶解时,由于酶解的介质已经发生改变(是以酶A作用之后的酶解液为基础),因此需研究酶B的最适酶解条件。
本试验以水解度、可溶性多肽得率为指标,首先对酶B的加酶量、酶解时间、固液比进行单因素试验,之后采取正交试验进一步优化酶解工艺。
1.3.5 水解度的测定
采用凯氏定氮法(GB 5009.5—2010《食品安全国家标准食品中蛋白质的测定》)[8]测定总氮含量。酶解液中游离氨基酸态氮测定采用甲醛电位滴定法[9]。水解度[10]的计算公式如下。

1.3.6 可溶性多肽得率的测定
采用三氯乙酸法结合双缩脲法测定可溶性多肽得率[11]。样液与10%的三氯乙酸等体积混合,4 000 r/min离心10 min,取上清液测540 nm处的吸光值。可溶性多肽得率计算公式如下。

1.3.7 DPPH自由基清除率的测定
参考Pedro等[12]的方法并稍作改进。用无水乙醇制备1×10-4mol/L的DPPH溶液,避光保存。将2 mL的待测液和2 mL的DPPH溶液加入同一试管中。摇匀后,避光反应30 min,测定517 nm处的吸光度Ai。同时测定2 mL DPPH溶液与2 mL无水乙醇溶液混合后的吸光度A0和2 mL试样溶液与2 mL无水乙醇溶液混合后的吸光度Aj。计算公式如下。
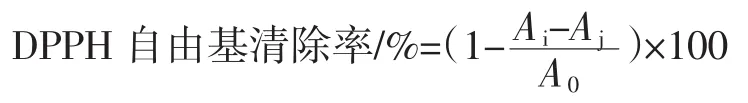
1.3.8 羟自由基清除率的测定
采用邻二氮菲-Fe2+氧化法测定羟自由基清除率[13-14]。将2 mmol/L FeSO4溶液、6 mmol/L水杨酸溶液、6 mmol/L H2O2等体积(1 mL)混合振荡,测定在510 nm处的吸光度A0。向反应体系中加入1 mL酶解液,摇匀后立即测定吸光度Ai。计算公式如下。
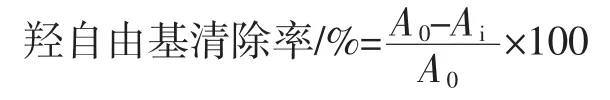
1.3.9 超氧阴离子自由基清除率的测定
采用赵涛等[15-16]的方法,略有改进。取0.05 mol/L Tris-HCl(pH 8.2)5.0 mL ,置于 25℃水浴 20 min,加入0.5 mL蒸馏水和0.5 mL 2.5 mmol/L邻苯三酚溶液,混合均匀,在25℃水浴反应5 min,用1 mL 8 mmol/L HCl溶液立即终止反应,在299 nm处测吸光度A0,向反应体系中加入不同浓度待测液0.5 mL,摇匀后立即测定吸光度Ai。计算公式如下。

1.3.10 总还原能力的测定
采用文献[17-20]的方法并稍作改进。取2 mL待测溶液,依次加入2 mL 0.2 mol/L磷酸盐缓冲液(pH 6.6)和2 mL 1.0% K3[Fe(CN)6]溶液,放置在试管中,混合,迅速放入50℃水浴锅中反应20 min,用蒸馏水代替空白样品液。冰水降温后加入2 mL 10%三氯乙酸,混匀,去除2 mL上清液,加入2 mL蒸馏水和0.4 mL 0.1% FeCl3溶液,混匀,静置10 min后,在700 nm下测定吸光值。
1.3.11 游离氨基酸含量的测定
采用氨基酸自动分析仪测定驴骨泥蛋白水解液中的氨基酸成分及含量。
1.4 数据处理
试验均设3次重复,结果用平均值±标准差表示,采用Microsoft Excel 2007软件对试验数据进行统计分析,Sigma plot 10.0绘图软件绘图,并应用statistics 8.1中Turkey HSD程序进行显著性差异分析,显著水平为0.05。
2 结果与分析
2.1 不同蛋白酶酶解效果比较
图1为不同蛋白酶酶解效果比较。

图1 不同蛋白酶酶解效果比较Fig.1 The comparison of the hydrolysis effects by different proteases
由图1可知,5种蛋白酶在各自最适反应条件下,水解度差异显著(P<0.05)。在加酶量相同的条件下,根据5种蛋白酶的酶解效果按由弱到强的顺序排列为:胃蛋白酶<木瓜蛋白酶<胰蛋白酶<风味蛋白酶<复合蛋白酶。其中风味蛋白酶和复合蛋白酶有较高的水解度(5.01%、5.28%)和可溶性多肽得率(5.89%、6.23%)。因此,综合考虑酶解效果,选择风味蛋白酶和复合蛋白酶进行下一步试验。
2.2 双酶添加顺序对酶解效果的影响
表1为双酶添加顺序对酶解效果的影响。
由表1可知,方案2的酶解效果显著高于方案1和方案3(P<0.05),在此条件下水解度和可溶性多肽得率分别达到(15.12±0.36)%和(14.82±0.28)%,结合图1可知,双酶酶解比单酶酶解驴骨泥蛋白效果要好。因此,选择先添加风味蛋白酶,再添加复合蛋白酶的酶解方法用于后续试验。
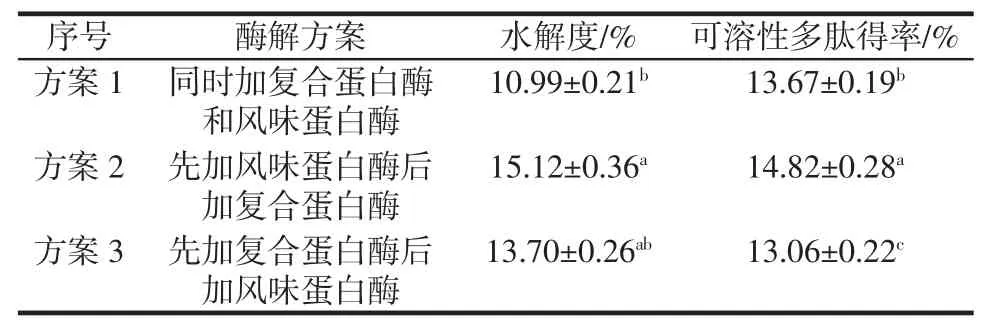
表1 双酶添加顺序对酶解效果的影响Table 1 The effects of added sequence of proteases on protein hydrolysis
2.3 双酶酶解时复合蛋白酶酶解条件优化
基于前期单因素试验结果,固定复合蛋白酶酶解温度为50℃、pH7.0,以加酶量、酶解时间、固液比为因素,以水解度、可溶性多肽得率作为评价指标设计正交试验,正交试验的因素与水平见表2,结果与分析见表3。
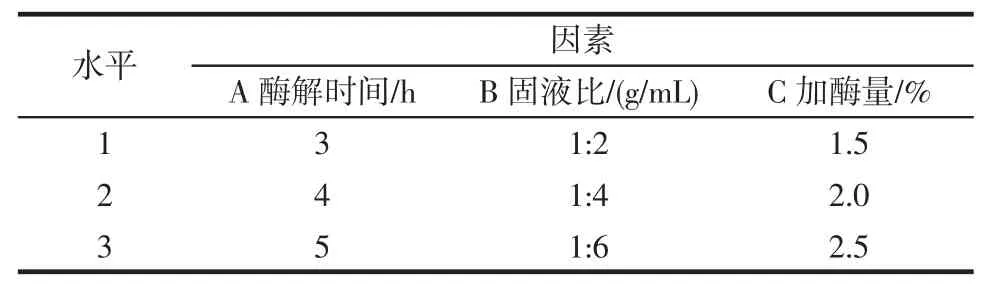
表2 正交试验的因素与水平Table 2 Factors and levels of orthogonal experiment
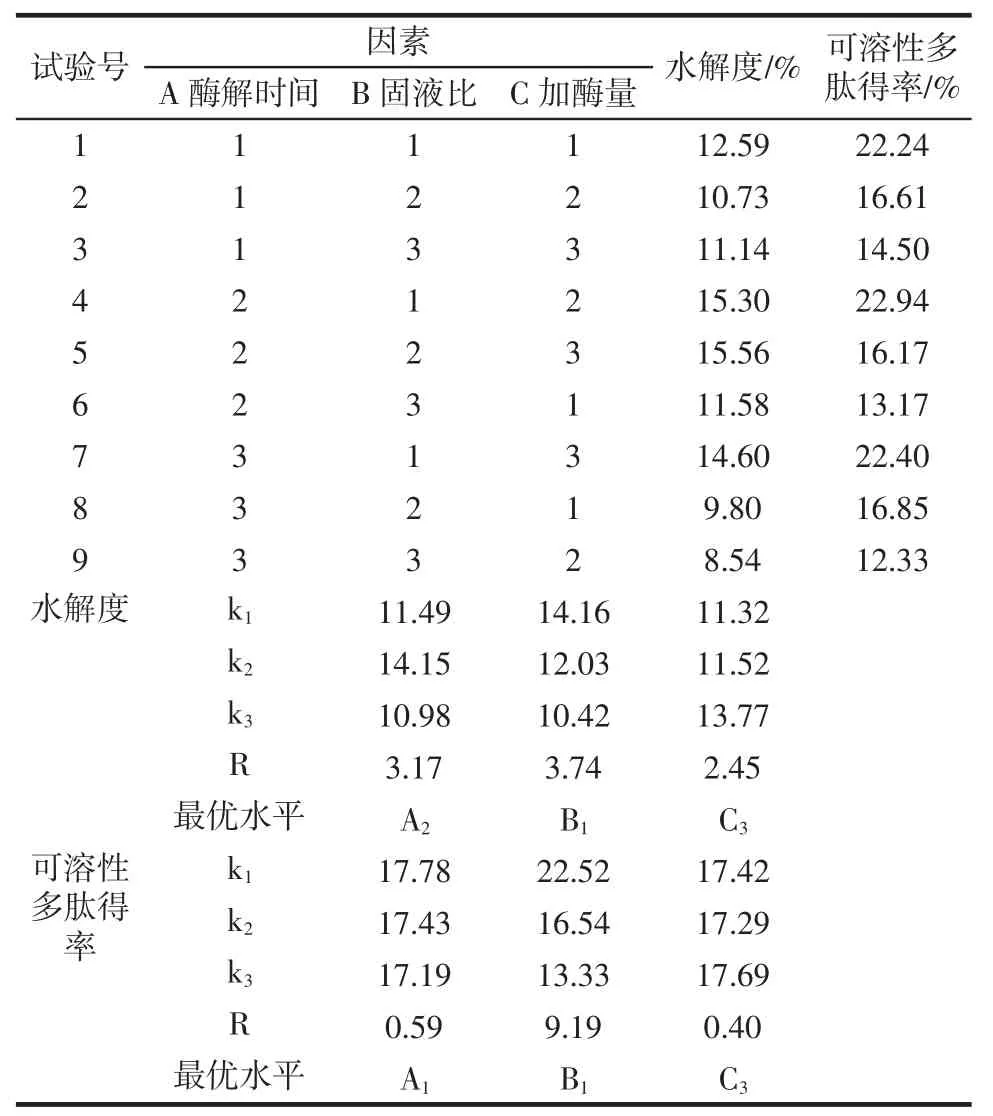
表3 正交试验结果Table 3 Results and analysis of orthogonal experiment
从表3可以看出,以水解度为评价指标,影响酶解效果因素的主次关系为B>A>C,也就是固液比>酶解时间>加酶量,最优组合是A2B1C3,即酶解时间4 h、固液比1∶2(g/mL)和加酶量2.5%。以可溶性多肽得率为评价指标,影响酶解效果的主次因素为B>A>C,也就是固液比>酶解时间>加酶量。可溶性多肽得率最高的酶解工艺为A1B1C3,即酶解时间3 h、固液比为1∶2(g/mL)和加酶量2.5%。
在正交设计的9组试验中,第5组(A2B2C3)的水解度最高,达到15.56%,第4组(A2B1C2)的可溶性多肽得率最高,达到22.94%。通过验证试验,结果表明组合A2B1C3的水解度达到15.74%,可溶性多肽得率为20.34%;组合A1B1C3的水解度为14.50%,可溶性多肽得率为24.12%。为了得到最优组合,选取组合A2B1C3和组合A1B1C3进行后续抗氧化性及游离氨基酸测定试验。
2.4 驴骨泥酶解前后游离氨基酸含量测定结果
酶解液和酶解前的驴骨泥原液中游离氨基酸的种类和含量如表4所示。
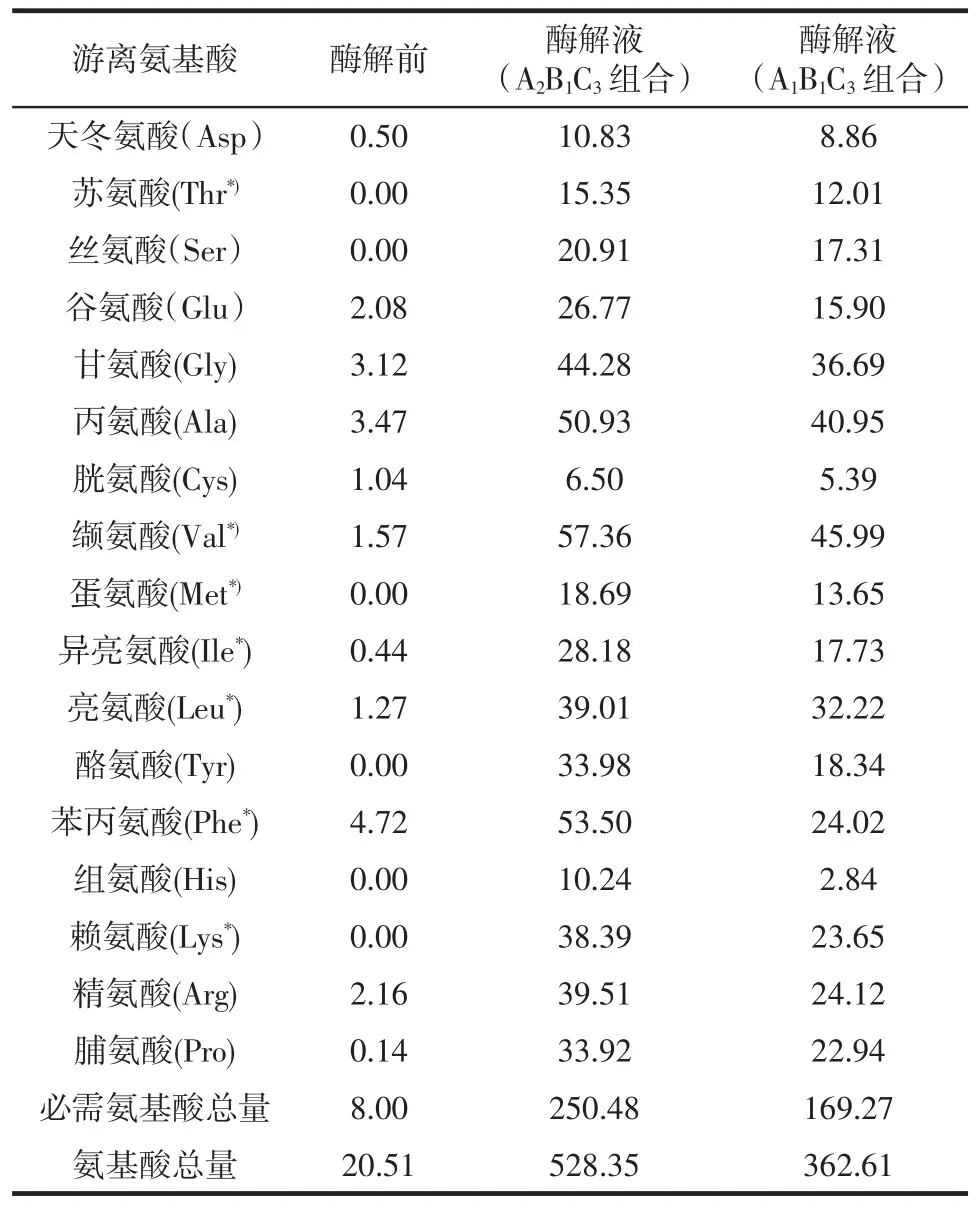
表4 酶解液中的游离氨基酸含量Table 4 The content of free amino acids of enzymatic hydrolysis solution mg/100 mL
从表4可以看出,A2B1C3组合的酶解液与酶解前的驴骨泥原液比较,氨基酸总量增加至528.35 mg/100 mL,酶解后的驴骨泥所含的游离氨基酸总量高于酶解前的游离氨基酸总量。且经酶解后的骨泥几乎含有构成蛋白质的所有氨基酸,构成胶原蛋白的重要组成氨基酸如甘氨酸和脯氨酸在酶解液中含量较高,分别为44.28 mg/100 mL和33.92 mg/100 mL,这表明酶解后的驴骨泥含有丰富的氨基酸,可作为制备氨基酸螯合物良好的氨基酸源[21];与A1B1C3组合的酶解液相比,A2B1C3组合的酶解液中所有氨基酸的含量均较高,说明酶解时间延长至4 h时酶解效果更为理想。
2.5 驴骨泥蛋白酶解物抗氧化能力测定
2.5.1 不同浓度的驴骨泥酶解液的DPPH自由基清除率
不同浓度的驴骨泥酶解液的DPPH自由基清除率见图2。
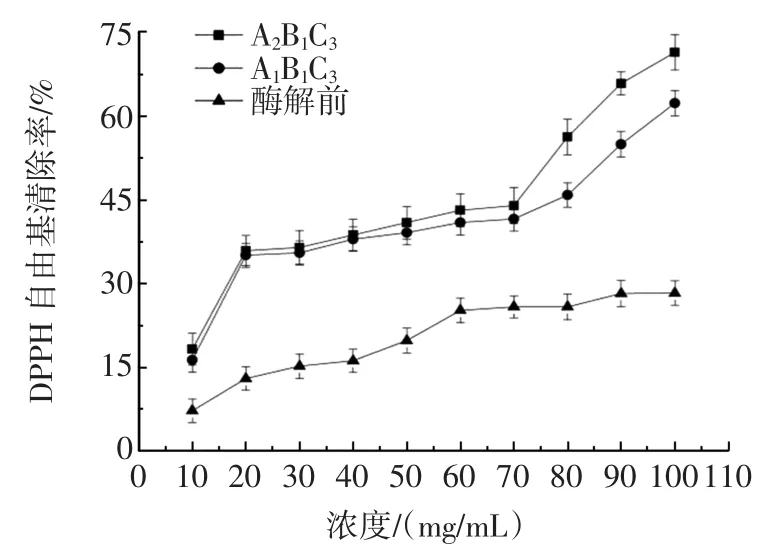
图2 不同浓度酶解液DPPH自由基清除率Fig.2 The clearance rate of DPPH radical of different concentration of enzymatic solution
从图2可以看出,与酶解前相比,同浓度下酶解液对DPPH自由基清除能力皆显著高于酶解前;浓度在10 mg/mL~100 mg/mL时,随着酶解液浓度的增加,对DPPH自由基清除能力增强,其中浓度在20 mg/mL~70 mg/mL,酶解液的DPPH自由基清除能力呈较缓上升趋势。之后,两组酶解液DPPH自由基清除率均随着浓度的继续升高呈直线上升趋势,且A2B1C3组合酶解液增幅较大,当浓度为100 mg/mL时,A2B1C3组合的酶解液的DPPH自由基清除率为71.43%。因此,驴骨泥酶解物对DPPH自由基具有较强的清除能力。
2.5.2 不同浓度的驴骨泥酶解物总还原能力的测定
不同浓度的驴骨泥酶解液的总还原能力见图3。
由图3可知,酶解液的总还原能力均随浓度的升高而增大,但酶解前的总还原能力随着浓度的增大基本呈平缓趋势(P>0.05),且酶解液的总还原能力显著高于酶解前。与A1B1C3组合的酶解液相比,A2B1C3组合的酶解液的总还原能力更强,呈现明显的量效关系。
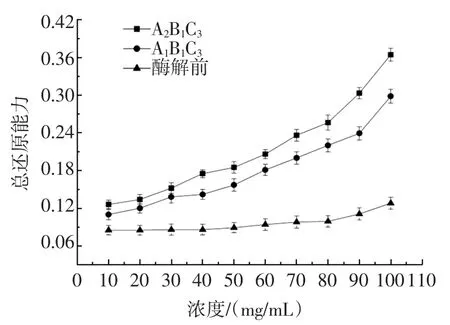
图3 不同浓度酶解液总还原能力Fig.3 The total reducing capacity of enzymatic hydrolysates at different concentrations
2.5.3 不同浓度驴骨泥酶解液的羟自由基清除率
不同浓度驴骨泥酶解液的羟自由基清除率见图4。
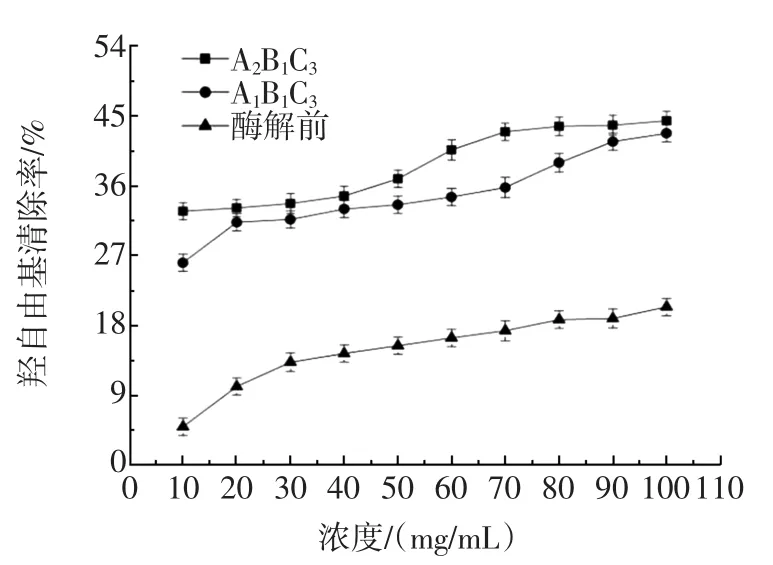
图4 不同浓度酶解液羟自由基清除率Fig.4 The clearance rate of hydroxyl radical of different concentration of enzymatic solution
从图4中可以看出,在10 mg/mL~100 mg/mL的浓度范围内,酶解液的羟自由基清除率显著高于酶解前,当浓度为100 mg/mL时,A2B1C3组合的酶解液对羟自由基清除率是酶解前的2.18倍,说明酶解液的抗氧化性有极大提高。
2.5.4 不同浓度驴骨泥酶解液的超氧阴离子自由基清除率
不同浓度驴骨泥酶解液的超氧阴离子自由基清除率见图5。

图5 不同浓度酶解液超氧阴离子自由基清除率Fig.5 The scavenging rate of superoxide anion radical of different concentration of enzymatic solution
由图5可知,酶解液对超氧阴离子自由基清除能力明显高于酶解前。A2B1C3组合酶解液的清除能力略高于A1B1C3组合酶解液,当浓度为100 mg/mL时,A1B1C3组合酶解液和A2B1C3组合酶解液对超氧阴离子自由基清除率分别31.28%和31.65%,与酶解前相比,酶解液对超氧阴离子自由基的清除能力有所提高。
综上所述,A2B1C3组合的酶解液具有更高的DPPH自由基清除率、总还原能力、羟自由基清除率,且游离氨基酸含量及种类丰富,因此,最优的酶解条件为酶解时间 4 h、固液比 1∶2(g/mL)、加酶量 2.5%。
3 结论
通过驴骨泥蛋白的酶解试验优化,获得最佳的双酶复合酶解工艺:首先添加风味蛋白酶,在50℃,pH值7.0,加酶量1.5%,固液比1∶2(g/mL)条件下酶解3 h后,然后添加复合蛋白酶,固液比为 1∶2(g/mL),加酶量2.5%,酶解时间4 h,水解度、可溶性多肽得率分别可以达到15.74%和20.34%;抗氧化试验表明,酶解液对羟自由基、超氧阴离子自由基和DPPH自由基具有良好的清除能力,并具有较强的总还原能力。驴骨泥酶解液中含有丰富的游离氨基酸,氨基酸总量由酶解前的20.51mg/100mL增加到酶解后的528.35 mg/100 mL。结果表明,风味蛋白酶结合复合蛋白酶双酶复合酶解工艺可用来制备高氨基酸含量和高抗氧化性的驴骨泥酶解液。
