钾长石矿物的微生物法解钾过程
2021-07-13薛永萍肖春桥张琰图池汝安
薛永萍 ,肖春桥 ,张琰图 ,池汝安
(1.武汉工程大学 兴发矿业学院,武汉 430073;2.武汉工程大学 邮电与信息工程学院,武汉 430073;3.武汉工程大学 环境与生物工程学院,武汉 430073;4.延安大学 化学与化工学院,陕西 延安 716000)
农作物的生长离不开氮、磷、钾等微量元素,其中钾元素对植物的生长起着至关重要的作用[1]。我国土壤中可溶性钾含量极其贫乏,仅占世界钾总储量的0.4%。由于我国是农业大国,钾肥消耗量大,每年钾肥进口量占总用量的60%左右[2]。虽然我国可溶性钾资源严重匮乏,但富含难溶性钾的硅酸盐矿物资源如钾长石矿物却极为丰富且分布广泛[3]。已有研究表明,采用物理法和化学法均可高效地从钾长石矿物中提取难溶性钾,但大量化肥的使用严重破坏了土壤结构,造成了环境污染[4]。因此,众多科学家将研究热点转移至利用微生物法提取难溶性矿物中的有效元素,以实现低能耗、无污染和资源的循环利用。
硅酸盐细菌具有一定的解钾能力,例如根瘤菌属(Sinorhizobium sp.)、固氮菌属(Azotobacter sp.)、芽胞杆菌属(Bacillus sp.)、微杆菌属(Microbacterium sp.)、假单孢菌属(Pseudomonas sp.)等[5]。张成省等[6]在烟草根系土壤中筛选得到27 株具有一定解钾能力的菌株,其中被鉴定为克雷伯菌属(Klebsiella sp.)的优势菌解钾活性为4.4 mg/L。该菌株可促进烟草的生长,利用菌液处理烟株20 d 后,烟株明显增高,烟叶亦显著增大。杨柳等[7]从菜园土壤中筛选分离得到一株具有解钾功能的菌YJ09,被鉴定为地衣芽孢杆菌(Bacillus licheniformis),主要靠代谢所产生的多糖分解钾长石,解钾能力为2.42 mg/L。Panda 等[8]从印度盐场分离得到一株土壤不动杆菌,该菌以廉价的葡萄糖、果糖为碳源,在 37 ℃、pH 值为 6.5 的条件下培养 120 h,发酵液中可溶性钾可达68 mg/L。
目前,见诸报道的解钾菌大多数是从农作物根系土壤筛选而得,最为常见的有大豆、小麦和土豆等[8-10];同时,也可从苹果树、茶树、梨树、枣树周围土壤以及烟草根系土壤中分离筛选获得。但是,以矿区土壤为来源分离解钾菌的报道较少。究其原因,可能是矿区土壤较贫瘠,微生物含量较少导致难以分离筛选所需微生物。然而,自然界中微生物都有其赖以生存的环境,如果能从矿区土壤中筛选得到硅酸盐菌,则该菌不仅生命力强,且对钾矿环境适应能力也强。鉴于此,为利用微生物法分解钾长石,制备环境友好型生物有机肥,并应用于农业生产,提高土壤有机质,实现生态友好型农业,本文从湖北省随州市某钾长石矿区土壤中分离筛选具有解钾功能的菌,并对其解钾过程进行探讨,以期将存在于钾长石中的缓效钾和难效钾转化为速效钾,从而解决我国土壤缺钾的瓶颈问题。
1 实验部分
1.1 原料与设备
所用原料:土壤,采集自湖北省随州市某钾长石矿区油菜根系土壤;钾长石,随州市某钾长石矿区提供,经粉碎过筛,依次用去离子水、3 mol/L 盐酸分别浸泡24、72 h,以去除矿粉中的可溶性离子,最后用去离子水清洗3~5 次,至pH 呈中性,烘干保存备用[11];基础培养基,由葡萄糖10 g、磷酸氢二钾0.2 g、氯化钠0.2 g、硫酸镁 0.2 g、硫酸亚铁 0.002 g、硫酸锰 0.2 g、氯化钙0.2 g、硫酸铵0.4 g、二次蒸馏水1 000 mL 配制而成,pH 值为7.0~8.0;解钾培养基,将基础培养基中的磷酸氢二钾0.2 g 改为钾长石矿粉2 g,其他试剂不变,配制而成,pH 值为7.0~8.0。
所用设备:ML51 型光学显微镜,广州市明美光电技术有限公司产品;JSM5510LV 型扫描电子显微镜,日本株式会社产品;50529v1.26 型原子吸收光谱仪,上海圣科仪器设备有限公司产品;PF-16R 型高速离心机,湖南来科技有限公司产品;VS-1300L-U 型无菌净化工作台,苏州安泰空气技术有限公司产品;YXQ-30SⅡ型立式压力蒸汽灭菌锅,上海东亚压力容器制造有限公司产品;S210 型pH 酸度计,梅特勒-托利多仪器有限公司产品;UP-850 型恒温振荡培养箱,上海优普实业有限公司产品。
1.2 解钾菌的分离、筛选及鉴定
在菌株的分离、筛选和分解矿物过程中,所用培养基必须经过灭菌方可使用。将配置好的培养基分装于三角瓶,密封后放入立式压力蒸汽灭菌器,于121 ℃灭菌20 min,待冷却后取出备用[12]。
(1)多次富集培养:准确称取油菜根系土壤100 g,加入1 000 mL 无菌水,搅拌均匀后用纱布过滤。用移液管准确吸取5 mL 土壤悬液,加入装有5 mL 基础培养基的三角瓶中,放入恒温摇床,于170 r/min、30 ℃下第1 次富集培养2 d;从第1 次富集培养液中再次吸取5 mL 的发酵液,且减少培养基中磷酸氢二钾的用量,同等条件下培养2 d,即为第2 次富集培养;按相同方法,进行多次富集培养,直至溶液澄清。在此过程中切记务必将磷酸氢二钾的用量依次减少,以提高微生物在解钾培养基上的适应能力。
(2)菌种分离纯化:用移液枪吸取200 μL 经多次富集后的澄清菌液,均匀涂布于平板解钾培养基上,于30 ℃恒温培养箱内倒置培养。观察菌落形态及解钾能力,并多次进行菌落的分离纯化。将不同形态的单菌落斜面培养,于4 ℃保藏[12]。
(3)基因测序鉴定:对筛选得到的具有解钾能力的菌株,通过显微镜观测其形态,并进行生理生化特性分析,由上海美吉生物有限公司进行基因测序鉴定。测序引物分别为SN1:5′-CCAACCTGGTTGATcc-TGCCAGTA-3′,SN2:5′-CCTTGTTACGACTTCACCTT-CCTCT-3'。经与NT 数据库比对,鉴定其种属。
1.3 微生物菌株溶解钾矿实验
对已分离、筛选、鉴定且具有较高解钾能力的菌株进行溶矿实验。首先配置解钾液体培养基,调节pH值为6.0~8.0(不同微生物取值不同)。量取60 mL 培养基分装于250 mL 三角瓶,按设定实验要求分别加入一定量的钾长石矿粉作为唯一钾源,于121 ℃灭菌20 min。在无菌净化操作台中,将已活化制备的菌悬浮液按一定体积比接入三角瓶,置于恒温振动摇床上,以不同培养温度、转速和时间条件下发酵培养。每2 d取样测定发酵液中的可溶性钾含量及其pH 值。每组平行实验3 次,且以不接种为对照组。发酵液经普通漏斗过滤,分别收集滤渣和滤液。将滤渣经洗涤、烘干后对其进行扫描电镜(SEM)分析。而滤液则依次置入台式高速离心机,9 000 r/min 离心 30 min,0.45 μm 微孔膜过滤2 次,最后采用原子吸收法测定溶液中的有效钾含量。采用单因素法,探讨培养时间、温度及转速等因素对解钾菌的生长和解钾能力的影响,以优化解钾工艺。
2 结果与分析
2.1 解钾菌的分离筛选及鉴定
通过大量实验,从矿区土样中筛选得到了4 株具有解钾功能的真菌,其中命名为JX-14 的真菌为一新型解钾真菌。该菌平板菌落形态和显微镜压片所得照片如图1 所示。
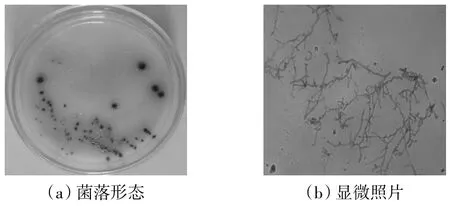
图1 JX-14 菌的菌落形态和显微照片Fig.1 Colony morphology and microscopic observation of JX-14 strain
由图1 可知,JX-14 菌株为一蓝色真菌,其菌丝相互交错,较细且无分隔。通过基因测序鉴定,该菌系统发育进化比对结果可知,没有相似度高的菌株,由此可认为该菌为一新菌。
2.2 JX-14 菌的解钾工艺优化
2.2.1 培养时间对解钾能力的影响
矿物表面经JX-14 菌溶蚀16 d 前后的扫描电镜照片如图2 所示。

图2 经JX-14 菌溶蚀前后钾长石矿物表面的扫描电镜图Fig.2 SEM photos of potassium feldspar before and after decomposed by JX-14 fungus
由图2 可知,未经菌体溶蚀的钾长石矿物表面棱角清晰,当培养16 d 后,矿粉表面出现明显坑洞,些许棱角亦被磨平。这一现象表明矿物结构被破坏,晶格被破坏致使其中的钾离子得以释放。
在培养温度为40 ℃、转速为170 r/min、培养基pH值为7.0~8.0、钾长石质量浓度为2 g/L 且粒度为0.03~0.04 mm、接种体积分数为30%、硫酸铵质量浓度为0.4 g/L 的条件下,考察培养时间对JX-14 真菌解钾能力的影响,结果如图3 所示。
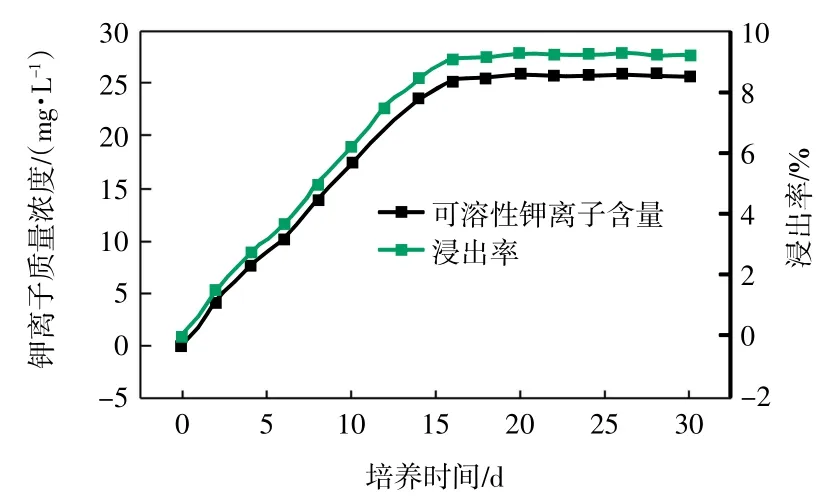
图3 培养时间对溶液中可溶性钾离子含量的影响Fig.3 Effect of culture times on content of soluble potassium in solution
由图3 可知,随着培养时间的增加,溶液中可溶性钾离子含量先快速增加后趋于不变。当培养时间超过16 d 时,钾离子质量浓度变化很小,可达25.28 mg/L,其浸出率为9.06%。分析原因,有机酸的分泌量随着碳源的减少而减少,从而降低了细菌的解钾能力[13-15]。
2.2.2 培养温度对解钾能力的影响
在转速为170 r/min、培养基pH 值为7.0~8.0、钾长石质量浓度为2 g/L 且粒度为0.03~0.04 mm、接种体积分数为30%、硫酸铵质量浓度为0.4 g/L 的条件下发酵培养16 d,考察培养温度对JX-14 解钾能力的影响,结果如图4 所示。
由图4 可知,随着培养温度的增加,溶液中可溶性钾离子含量先增加后减少,最适宜培养温度为40 ℃。由此可见,该菌极耐高温。此时溶液中钾离子质量浓度为26.01 mg/L,浸出率高达9.32%。究其原因,温度过高或过低均不利于微生物的生长和繁殖,使其分泌有机酸的量减少,从而降低了菌体分解矿物的能力[16-18]。
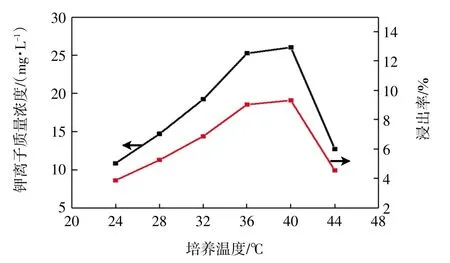
图4 培养温度对溶液中可溶性钾离子含量的影响Fig.4 Effect of cultivation temperature on content of soluble potassium in solution
2.2.3 培养转速对解钾能力的影响
在温度为40 ℃、培养基pH 值为7.0~8.0、钾长石质量浓度为2 g/L 且粒度0.03~0.04 mm、接种体积分数为30%、硫酸铵质量浓度为0.4 g/L 的条件下发酵培养16 d,探讨培养转速对JX-14 解钾能力的影响,结果如图5 所示。
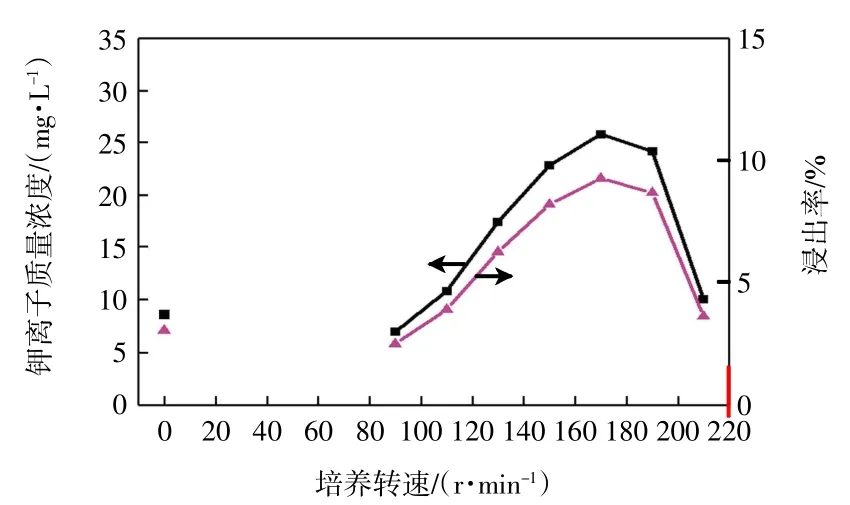
图5 培养转速对溶液中可溶性钾离子含量的影响Fig.5 Effect of shaking speed during cultivation on content of soluble potassium in solution
由图5 可知,随着培养转速的增加,溶液中可溶性钾离子含量先快速增加后下降。当转速达170 r/min时,溶液中钾离子质量浓度最大,为25.84 mg/L,此时浸出率为9.26%,明显高于静止培养时溶液中的钾离子含量。究其原因,转速较高会产生较大的剪切力,一方面降低了微生物的数量,另一方面也不利于微生物和矿粉接触,使其解钾能力下降;而转速过低,则没有足够的氧容量维持细菌的生长和繁殖,其解钾能力也下降[19]。
2.2.4 培养基初始pH 值对解钾能力的影响
在温度为40 ℃、转速为170 r/min、钾长石质量浓度为2 g/L 且粒度为0.03~0.04 mm、接种体积分数为30%、硫酸铵质量浓度为0.4 g/L 的条件下发酵培养16 d,考察培养基初始pH 值对JX-14 真菌解钾能力的影响,结果如图6 所示。

图6 培养基初始pH 值对溶液中可溶性钾离子含量的影响Fig.6 Effect of pH value of culture medium on content of soluble potassium in solution
由图6 可知,随着培养基初始pH 值的增加,溶液中可溶性钾离子含量先增加后下降。pH 值为7.0~8.0时,溶液中钾离子质量浓度较大,为25.33~24.72 mg/L,浸出率可达9.08%~8.86%。究其原因,和温度一样,过高或过低的pH 值都不利于微生物的生长和繁殖,致其解钾能力下降[20]。
2.2.5 钾长石矿粉浓度对解钾能力的影响
在温度为40 ℃、转速170 r/min、培养基pH 值为7.0~8.0、钾长石粒度0.03~0.04 mm、接种体积分数为30%、硫酸铵质量浓度为0.4 g/L 的条件下发酵培养16 d,分析矿粉浓度对浸出率的影响,结果如图7 所示。
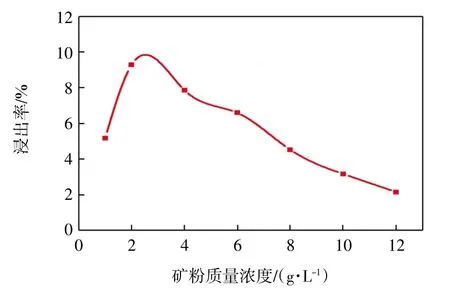
图7 矿粉浓度对溶液中可溶性钾离子浸出率的影响Fig.7 Effect of K-feldspar concentration on corrosion efficiency of soluble potassium in solution
由图7 可知,随着矿粉浓度的增加,溶液中可溶性钾离子含量先缓慢增加后极速下降。当矿粉质量浓度为2 g/L 时,浸出率可高达9.28%。分析其原因,随着矿粉浓度的增加,没有足够多的微生物来溶解钾长石以释放钾。
2.2.6 钾长石矿粉粒度对解钾能力的影响
在温度为40 ℃、转速为170 r/min、培养基pH 值为7.0~8.0、钾长石质量浓度为2 g/L、接种量为30%、硫酸铵质量浓度为0.4 g/L 的条件下发酵培养16 d,考察矿粉粒度对溶液中可溶性钾离子含量的影响,如图8 所示。
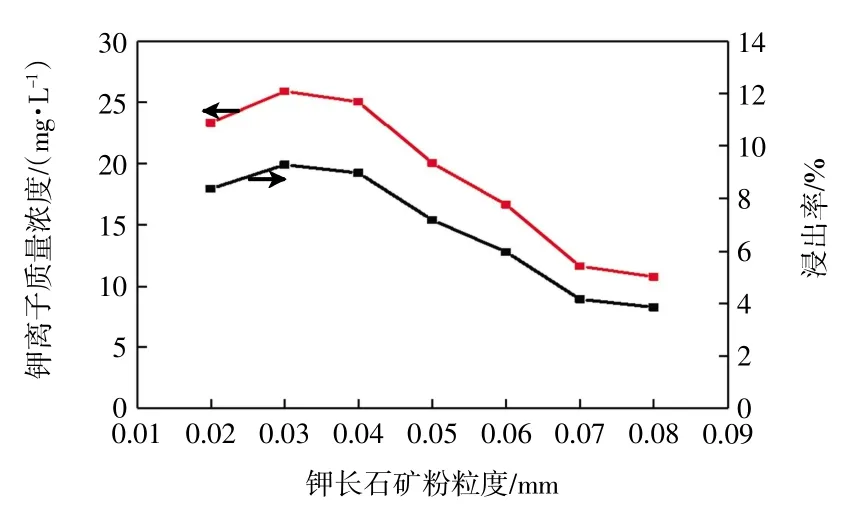
图8 矿粉粒度对溶液中可溶性钾离子含量的影响Fig.8 Effect of K-feldspar granularity on content of soluble potassium in solution
由图8 可知,随着矿粉粒度的增加,钾离子含量先增加后下降。当粒径为0.03~0.04 mm 时,溶液中可溶性钾离子质量浓度可达25.89~25.03 mg/L,浸出率为9.28%~8.97%。分析其原因,矿粉粒径越小,与培养液中的菌体接触则越频繁,更有利于微生物破坏矿物结构,以释放更多的钾离子。但是当矿物粒径小于0.03 mm 时,矿物颗粒间易发生团聚现象,使其颗粒粒径增大,减小了矿粉与溶液中菌体的接触面,从而导致钾离子难以释放。
2.2.7 接种量对解钾能力的影响
在温度为40 ℃、转速为170 r/min、培养基pH 值为7.0~8.0、钾长石质量浓度为2 g/L 且粒度为0.03~0.04 mm、硫酸铵质量浓度为0.4 g/L 的条件下发酵培养16 d,探讨接种量对溶液中可溶性钾离子含量的影响,结果如图9 所示。
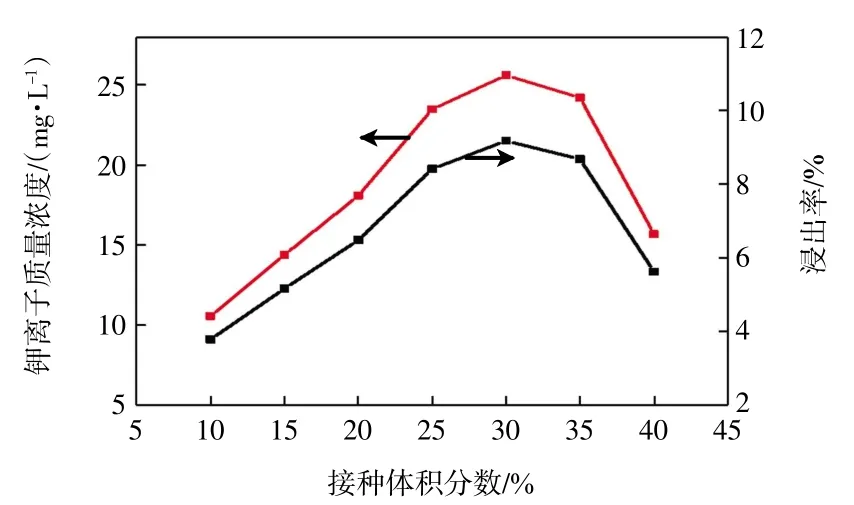
图9 接种量对溶液中可溶性钾离子含量的影响Fig.9 Effect of inoculation volume on content of soluble potassium in solution
由图9 可知,当菌液接种体积分数小于25%时,溶液中可溶性钾离子含量随接种量的增加而快速增加。当接种体积分数超过25%时,溶液中可溶性钾离子含量变化不明显,其最优接种体积分数为30%,钾离子质量浓度可达25.61 mg/L,浸出率为9.18%。究其原因,菌液浓度过低时,没有足够量的微生物分解钾长石以破坏其晶体结构,进而释放钾离子。
2.2.8 氮源及其浓度对解钾能力的影响
在温度为40 ℃、转速为170 r/min、培养基pH 值为7.0~8.0、钾长石质量浓度为2 g/L 且粒度为0.03~0.04 mm、接种体积分数为30%、硫酸铵质量浓度为0.4 g/L 的条件下发酵培养16 d,考察不同氮源对溶液中可溶性钾离子含量的影响,结果如图10 所示。
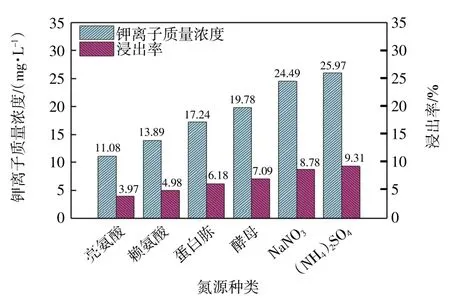
图10 氮源对溶液中可溶性钾离子含量的影响Fig.10 Effect of nitrogen source on content of soluble potassium in solution
由图10 可知,氮源对溶液中钾离子含量也有一定影响。同等条件下硫酸铵为最佳氮源,此时,钾离子质量浓度为25.97 mg/L,浸出率为9.31%。由此表明,硫酸铵的加入能够促进微生物的生长和繁殖,更有利于释放钾离子。
同等条件下考察不同硫酸铵质量浓度对溶液中可溶性钾离子含量的影响,结果如图11 所示。

图11 硫酸铵浓度对溶液中可溶性钾离子含量的影响Fig.11 Effect of ammonium sulfate dose on content of soluble potassium in solution
由图11 可知,随着硫酸铵质量浓度的增加,溶液中可溶性钾离子的含量先增加后减少。当硫酸铵质量浓度为0.4 g/L 时,钾离子质量浓度最高为25.96 mg/L,浸出率为9.32%;而不加硫酸铵进行对照实验,溶液中可溶性钾离子质量浓度仅为11.08 mg/L,浸出率为3.77%。由此可见,加入硫酸铵明显提高了菌分解矿物的能力。究其原因,无机氮的加入,不仅能促进细菌的生长,也有利于细菌产生更多的有机酸[21-23]。但当硫酸铵浓度过高时,则和培养基中的钙、镁等离子形成沉淀,降低了微生物赖以生长和繁殖的微量元素,使其解钾能力下降。
2.2.9 碳源对解钾能力的影响
在温度为40 ℃、转速为170 r/min、培养基pH 值为7.0~8.0、钾长石质量浓度为2 g/L 且粒度为0.03~0.04 mm、接种体积分数为30%、硫酸铵质量浓度为0.4 g/L 的条件下发酵培养16 d,考察碳源对溶液中可溶性钾离子含量的影响,结果如图12 所示。
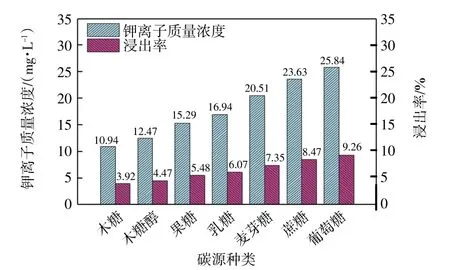
图12 碳源对溶液中可溶性钾离子含量的影响Fig.12 Effect of carbon source on content of soluble potassium in solution
由图12 可知,碳源对溶液中钾离子含量有一定的影响,同等条件下葡萄糖为最佳碳源,此时,钾离子质量浓度为25.84 mg/L,浸出率为9.26%。
2.3 JX-14 菌解钾优势分析
为验证最优工艺条件下该菌株分解钾矿的能力,再次将该菌株与筛选得到的另一菌株JX-10 细菌类微生物在一定培养温度和不同接种量条件下对钾长石矿粉进行溶蚀,对比两菌株溶解钾矿的能力,结果如图13—图14 所示。
由图13 可以看出,在不同培养温度下两菌株分解钾矿浸出率都随培养时间的增加先快速达到其最大值,其后基本维持不变。对比JX-14 和JX-10 两菌株分解钾矿的能力,当两菌株在各自最优化培养温度40 ℃和36 ℃时,钾浸出率最高,依次为9.36%和8.36%。由图14 可知,当接种体积分数分别为30%和25%时,钾浸出率最高,为9.16%和8.22%。由此可见,在最优工艺条件下JX-14 菌株分解矿物能力高于JX-10 菌株。这一结果不仅说明JX-14 菌株解钾能力较强,同时也进一步说明解钾类微生物种类不局限于细菌类,真菌类微生物也具有较强的分解钾矿能力,且耐高温,更宜于高温条件下利用微生物分解实际矿物。此外,也为后续研究微生物分解矿物热、动力学奠定了基础。因此,可以说本文筛选得到的JX-14 菌株为一种可有效分解钾矿的新菌。

图13 不同温度条件下JX-14 真菌和JX-10 细菌的解钾能力对比Fig.13 Comparison of potassium releasing ability between JX-14 fungus and JX-10 bacterium under different temperatures
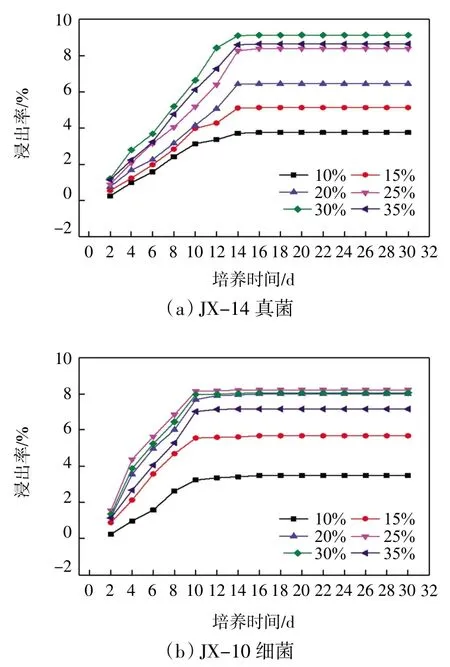
图14 不同接种体积分数条件下JX-14 真菌和JX-10细菌的解钾能力对比Fig.14 Comparison of potassium releasing ability between JX-14 fungus and JX-10 bacterium under different inoculation volume fractions
3 结 论
从湖北省随州市钾长石矿区土壤中分离出的JX-14 菌株可以有效地溶解钾长石矿物,以释放其中的难溶性钾,研究结果表明:
(1)该菌株为一新型耐高温解钾真菌,其最优解钾工艺为温度40 ℃、转速170 r/min、培养基pH 值7.0~8.0、钾长石质量浓度2 g/L 且粒度0.03~0.04 mm、接种体积分数30%、硫酸铵质量浓度为0.4 g/L 的条件下发酵培养16 d 后,溶液中可溶性钾离子质量浓度可达26.12 mg/L,浸出率为9.36%。
(2)随着培养温度、转速、培养基pH 值、钾长石质量浓度及粒度、接种量、硫酸铵质量浓度的增加,JX-14 菌株分解钾矿的浸出率先增加后减小,随着培养时间的增加先迅速增加,其后维持不变。
(3)本文研究成果可为微生物有机肥的制备提供一定的理论依据和技术指导,为推进以提高土壤有机质为核心任务的“沃土工程”添砖加瓦,为实现农业可持续发展奠定基础,最终实现土壤安全、粮食安全、食品安全与生态安全。
