复合益生菌对K99引起的犊牛腹泻小肠结构及肠胶质细胞分泌亚硝基谷胱甘肽的影响
2021-07-13徐春生祁凤华袁晓凤宋思佳
刘 彤,徐春生,祁凤华,袁晓凤,宋思佳
(石河子大学动物科技学院,新疆 石河子 832003)
0 引言
腹泻是犊牛常见的一种消化道疾病,常发生在犊牛三周龄左右,多发季节为初春、夏末和秋初,其危害犊牛的健康,治疗不及时往往导致犊牛死亡率增加,严重影响养牛的经济效益。生产中常用抗生素治疗犊牛腹泻,而抗生素易产生耐药性,同时又会杀灭肠道有益菌群,引起肠道功能的紊乱。益生菌预防治疗腹泻是一种安全有效的选择,益生菌可抑制部分肠道有害菌群,改善肠道内环境稳态,达到治愈腹泻的作用,且使用安全无残留。
复合益生菌由嗜酸乳杆菌、枯草芽孢杆菌、布拉迪酵母菌按比例3∶3∶1组成。嗜酸乳杆菌可通过动物胃肠道中微生物的竞争排斥作用,帮助动物建立有益的宿主胃肠道微生物区系,促进动物生长、预防动物疾病。殷金玲等[1]制成的免疫康可以从体液免疫、细胞免疫和单核巨噬细胞系统方面改善小鼠的机体免疫力。枯草芽孢杆菌可以促进动物采食、提高饲料利用率、改善动物胃肠道平衡、增加动物健康等。Lee等[2]研究表明,饲粮中添加枯草芽孢杆菌可以促进小肠上皮细胞的生长,增加小肠绒毛高度,提高营养物质的吸收。布拉迪酵母菌可降低畜禽料重比、改善家禽生产性能、降低腹泻的发生,可促进畜禽肠道有益菌的增殖,产生乳酸从而降低肠道致病菌的含量,进而调节肠道菌群平衡,促进畜禽机体免疫因子的释放和免疫器官的发育,进一步增强畜禽机体免疫力[3]。
肠胶质细胞(EGCs)是肠神经胶质系统的重要组成部分,其分泌的亚硝基谷胱甘肽(GSNO)具有较好地促进肠黏膜屏障的作用。有关犊牛小肠EGC 分泌GSNO 的研究未见有报道,本试验应用益生菌作用于K99 感染犊牛,探究益生菌及K99 对犊牛小肠GSNO 分泌的影响,为益生菌在犊牛腹泻中的应用提供参考资料,亦为EGC 的研究提供理论基础。
1 材料与方法
1.1 试验材料
1.1.1 试验动物试验在新疆军垦曙瑞奶牛场完成,选择健康,胎次、胎龄相近的荷斯坦公犊牛22头,体重约为40kg。
1.1.2 试验试剂无水乙醇、95%乙醇、二甲苯(天津化工有限公司);石蜡、中性树胶(上海万辉仪器有限公司);牛GSNO 试剂盒(上海酶连生物科技有限公司);4%的多聚甲醛(赛国科技有限公司);伊红、苏木精(北京索莱宝科技有限公司)。大肠杆菌K99(含菌量为1×109CFU·g-1)和复合益生菌(由嗜酸乳杆菌、枯草芽孢杆菌和布拉迪酵母菌按3∶3∶1 比例组成,含菌量为1×109CFU·mL-1)来自石河子大学动物科技学院。
1.1.3 试验仪器灭菌高压锅(江明市东华器械有限公司);电热恒温鼓风干燥箱、电子天平(沈阳龙腾电子有限公司);莱卡石蜡切片机(RM2235);载玻片、盖玻片(天津化工科技有限公司);KD-T电脑生物组织摊烤片机(浙江科迪仪器设备有限公司)。
1.2 试验方法
1.2.1 试验设计与饲养管理
犊牛自出生后饲喂足量的初乳及鲜乳。将选择的22 头犊牛随机分为3 组:对照组8 头,常规饲喂,每日灌服10mL 磷酸缓冲盐溶液(PBS);益生菌组6 头,在试验开始第一天饲喂K99 10mL,之后每天饲喂复合益生菌;感染组8 头,常规饲喂基础上,每天灌服K99 10mL。试验期分别为7d、14d和21d,试验到期之时,于次日清晨晨饲前宰杀。
1.2.2 石蜡切片制作及病理观察
犊牛颈动脉放血宰杀后,剖开腹腔分别取小肠各段组织样2cm,PBS 清洗管腔后将组织样置于中性甲醛固定液中12h,脱水,透明,包埋,切片,苏木精-伊红(HE)染色,显微镜观察摄片。
1.2.3 酶联免疫吸附法(ELISA)法测定犊牛小肠内GSNO的含量
1.2.3.1 样品采集
分别从对照组、益生菌组、感染组随机选取5头牛,分离小肠,截取十二指肠、空肠和回肠段,冲洗掉肠道内容物,于-20℃冰箱保存待测。
1.2.3.2 组织样品处理
取小肠新鲜组织,用手工或匀浆器将其匀浆充分,4℃条件下3000r离心20min,仔细收集上清液用于分析。
1.2.3.3 ELISA方法
(1)标准品的加样:设置标准品孔和样品孔,标准品孔各加不同浓度的标准品50uL。
(2)加样:分别设空白孔、待测样品孔。
(3)加酶:每孔加入酶标试剂100uL,空白孔除外。
(4)温育:用封板膜封闭后置37℃温育60min。
(5)配液:用蒸馏水将20 倍浓缩洗涤液稀释20倍后备用。
(6)洗涤:每孔加满洗涤液,静置30s弃去,重复5次,拍干。
(7)显色:加入显色剂,37℃避光显色15min。
(8)终止:每孔加终止液50uL,终止反应。
(9)测定:以空白孔调零,450nm 下依序测量各孔吸光度(OD 值)。测定应在加终止液后15min 内进行。
(10)数据转换:测量各孔的吸光度(OD 值)转换成各孔的浓度。
1.3 统计分析
用EXCEL 对数据进行预处理,用SPSS 20.0 对数据进行单因素方差分析,并做多重比较,数据以“均值±标准差”表示。
2 结果
2.1 犊牛小肠病理切片观察
2.1.1 十二指肠
如图1中A1~A3所示可知,对照组犊牛肠绒毛比较完整,无出血现象,有个别绒毛断裂的情况出现;感染组犊牛肠绒毛结构不完整,绒毛断裂、脱落,并且有变短、水肿现象,如图中箭头所示为绒毛断裂情况较多,并且较短;益生菌组犊牛肠绒毛较完整,排列比较紧实,结构较为正常。

图1 犊牛十二指肠病理切片图Figure 1 Pathological sections of duodenum of calves
2.1.2 空肠
如图2中B1~B3所示,对照组犊牛肠绒毛比较完整,有个别绒毛断裂的情况出现;感染组犊牛肠绒毛结构不完整,绒毛断裂、脱落,并且有变短、水肿现象,箭头所示为断裂绒毛,并且较短;益生菌组犊牛肠绒毛较完整,排列较紧实,结构较为正常。

图2 犊牛空肠病理切片图Figure 2 Pathological sections of jejunum of calves
2.1.3 回肠
如图3 中C1~C3 所示可知,对照组犊牛肠绒毛结构比较完整;感染组犊牛肠绒毛结构不完整,绒毛断裂、脱落,并且有变短、水肿现象,图中箭头标示为绒毛断裂情况,并且较短;益生菌组犊牛肠绒毛较完整,断裂较少,排列较紧实,结构正常。
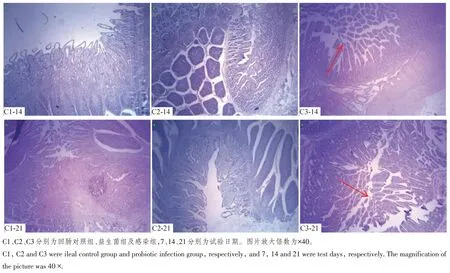
图3 犊牛回肠病理切片图Figure 3 Pathological sections of ileum of calves
2.2 犊牛小肠内GSNO的含量变化
由表1 所列可知,三组犊牛小肠中GSNO 的含量各有差异,其中十二指肠中GSNO 含量三组处理间无显著差异;空肠中益生菌组GSNO 含量虽高于对照组,但两者间无显著差异(P>0.05),对照组和益生菌组均显著高于感染组(P<0.05);回肠中益生菌组GSNO 含量高于对照组,但两者间无显著差异(P>0.05),对照组和益生菌组均极显著高于感染组(P<0.01)。


表1 犊牛小肠GSNO含量变化(单位:mmol·L-1)Table 1 Changes of GSNO content in small intestine of calves(unit:mmol· L-1)
3 讨论
3.1 复合益生菌及大肠杆菌K99 对犊牛小肠形态的影响
大肠杆菌是造成犊牛腹泻的主要原因之一,已有研究证实犊牛从7 日龄起灌服大肠杆菌K99,其腹泻率从30%上升到70%,犊牛的腹泻率显著提高[4]。张雪[5]研究得出饲粮添加枯草芽孢杆菌可以提高肉鸡后期(22—42日龄)生长性能,且全期(1—42 日龄)效果不低于抗生素杆菌肽锌。卢奇成等[6]的试验中,在犊牛早期(1—21d)饲粮中补充不同剂量的布拉氏酵母可以降低犊牛的腹泻率,提高机体的抗氧化能力和免疫力,减少犊牛的腹泻。罗波文等[7]研究得出一定浓度的嗜酸乳杆菌可以提高细胞的抗氧化能力。邵青玲等[8]研究认为肠绒毛高度是检验小肠吸收能力的一个重要指标。
从本试验HE 染色结果可以看出,对照组犊牛十二指肠、空肠及回肠肠绒毛完整,无出血现象;感染组肠绒毛有明显的出血现象,绒毛断裂、脱落,说明大肠杆菌K99在一定程度上会对犊牛肠道造成损伤,引起犊牛腹泻;而益生菌组肠绒毛结构较完整,无绒毛断裂、脱落现象,表明益生菌一定程度上促进肠道发育,对肠道有一定的保护作用。在十二指肠、空肠和回肠中,益生菌组的肠绒毛长度高于对照组和感染组,感染组的肠绒毛长度低于对照组,本试验中感染大肠杆菌K99可导致肠粘膜屏障结构发生变化,引起犊牛腹泻。而益生菌组肠绒毛较完整,结构正常,说明复合益生菌对肠道有一定的保护作用。
3.2 复合益生菌及大肠杆菌K99 对犊牛小肠内GSNO的影响
GSNO 是 EGCs 中的重要组成成分,而 EGCs 是肠神经系统的重要组成部分,EGCs 的缺失,反映了肠上皮组织屏障的损害,不利于肠道的发育[9]。吕健[10]研究指出源自EGCs 的S-GSNO 是一种新的肠屏障功能诱导物。S-GSNO 对上皮屏障功能的调节,可能是通过对连接体周围F 肌动蛋白的巯基亚硝基化和改变其表达来完成。本试验中,与对照组相比,益生菌组小肠中GSNO含量升高,而感染组小肠中GSNO 含量显著降低,一定程度上反映复合益生菌具有促进犊牛肠道发育的作用。
4 小结
本试验中,犊牛感染大肠杆菌K99 导致腹泻发生,而复合益生菌组小肠绒毛较完整,结构正常,说明复合益生菌对肠道有一定的保护作用。并且感染组的GSNO 含量显著下降,而益生菌组中含量增加,说明GSNO 可在一定程度上保护肠黏膜结构的完整,抑制大肠杆菌K99的致病作用。
Referencesiversity
[1]殷金玲.免疫康的制备及增强免疫力功能实验研究[D].长春:吉林大学,2013.Yin J L. Preparation of Mianyikang and its immunomodulato⁃ry activity experiment [D]. Changchun: Jinlin University,2013.(in Chinese)
[2]Lee M Y,Suh S J,Lee J H,et al.Expression patterns ofBa⁃cillus subtilisdiacylglycerol kinase gene induced by physio⁃logical stimuli [J].Korean Journal of Applied Microbiology and Biotechnology Letters,2002,30(1):15-20.
[3]Shams Z,Tahamtan Y,Pourbakhsh A,et al.Detection of en⁃terotoxigenic K99(F5)and F41 from fecal sample of calves by molecular and serological methods [J].Comparative Clini⁃cal Pathology,2012,21(4):475-478.
[4]刘文慧,阿拉腾珠拉,马露,等.丁酸钠与丝兰对大肠杆菌K99攻毒哺乳犊牛生长性能及血清抗氧化指标的影响[J].动物营养学报,2020,32(9):4177-4184.Liu W H,Alateng Z,Ma L,et al.Effects of sodium butyrate and yucca on growth performance and serum antioxidant indi⁃ces of sucking salves challenged with escherichia coli K99[J].Chinese Journal Of Animal Nutrition,2020,32(9):4177-4184.(in Chinese)
[5]张雪,张珊,钟光,等.枯草芽孢杆菌对肉鸡生长性能、肠道组织形态和盲肠微生物组成的影响[J].动物营养学报,2020,32(11):5195-5208.Zhang X,Zhang S,Zhong G,et al.Effects ofBacillus subtil⁃ison growth performance,intestinal morphology and cecal microbial composition of broilers [J].Chinese Journal of Ani⁃mal Nutrition,2020,32(11):5195-5208.(in Chinese)
[6]卢奇成,吴妍妍,张文举.布拉氏酵母菌对哺乳犊牛腹泻率、血清免疫、抗氧化指标及粪便微生物的影响[J].饲料工业,2020,41(9):23-30.Lu Q C,Wu Y Y,Zhang W J. Effect ofSaccharomyces bou⁃lardiiondiarrhea rate,serum immunity,antioxidant index,and fecal microorganism in sucking calves[J].Feed Industry,2020,41(9):23-30.(in Chinese)
[7]罗波文,邹田德,陈丽玲,等.嗜酸乳杆菌对氧化应激仔猪小肠上皮细胞抗氧化能力和紧密连接蛋白表达的影响[J].动物营养学报,2020,32(5):2108-2115.Luo B W,Zou T D,Chen L L,et al. Effects ofLactobacillus acidophiluson antioxidative ability and expression of tight junction protein in intestinal epithelial cells of piglets under oxidative stress [J].Chinese Journal Of Animal Nutrition,2020,32(5):2108-2115.(in Chinese)
[8]邵青玲,杨艳君,杜秀平.多糖对断奶仔猪肠道菌群、绒毛形态和免疫功能的影响[J].中国饲料,2020(8):46-50.Shao Q L,Yang Y J,Du X P. Effects of polysaccharides on intestinal flora,villi morphology and immunity in weaned pig⁃lets[J].China Feed,2020(8):46-50.(in Chinese)
[9]肖卫东,彭科,杨桦.肠胶质细胞在肠稳态调控中的作用机制与研究展望[J].世界华人消化杂志,2016,24(25):3657-3665.Xiao W D,Peng K,Yang H.Enteric glial cells:An emerging key player in intestinal homeostasis modulation under physio⁃logical and pathological conditions [J].World Chinese Journal of Digestology,2016,24(25):3657-3665.(in Chinese)
[10]吕健.肠神经胶质细胞研究进展[J].医学综述,2008(19):2904-2907.Lyu J.Research progress of enteric glia cells[J].Medical Re⁃capitulate,2008,14(19):2904-2907.(in Chinese)
