便携式细胞趋化迁移分析系统的研制与应用
2021-07-12李慧来洪承刚潘井宇
李慧来, 洪承刚, 潘井宇, 朱 灵, 刘 勇, 杨 柯*
(1.中国科学院合肥物质科学研究院安徽光学精密机械研究所, 合肥 230031; 2.中国科学技术大学, 合肥 230026)
细胞趋化性是指细胞朝着特定的化学浓度梯度发生迁移运动。许多细胞都具有感知的外部化学信号并朝向化学引诱物发生迁移运动的能力,如T淋巴细胞、癌细胞、白细胞等[1]。这种现象已被证明在胚胎发育[2],伤口愈合[3],肿瘤转移[4]中发挥了重要作用。
细胞趋化性研究依托能形成稳定趋化因子浓度梯度装置和评价细胞迁移方法。经典的梯度发生器,如博伊登室[5]、Install室[6]等已经被用于细胞趋化性研究多年,目前仍然活跃在实验室中,但是其消耗的试剂量大且操作烦琐,实验成本过于高昂。目前的评价细胞迁移方法有划痕实验法和Transwell实验法[7-8],但是这两种方法都有明显的不足。划痕实验法重复性较差,且损伤细胞。Transwell实验法则操作复杂且不适合动态观测,为此,人们发展了以微流体芯片为基础的微流体梯度发生器。微流体芯片的管道尺寸在微米量级,与细胞的大小相当,消耗的细胞和试剂量少,且能较好的模拟体内环境,不损伤细胞,适合动态观察[9]。微流体芯片为研究细胞生命科学的平台搭建提供了良好的选择。基于微流体芯片的细胞趋化性研究需要依托专业的活细胞成像设备,且在定时采集一系列的细胞图像之后,需要专业的科研人员使用ImageJ图像处理软件手动追踪细胞运动轨迹并分析细胞趋化性,检测方法较为烦琐且时间和实验成本较高。幸运的是,各种廉价的图像传感器模块,如电行耦合元件(charge-coupled device,CCD)和互补金属氧化物半导体(compementary metal oxide semiconductor,CMOS)图像传感器已经广泛应用于数码相机、网络摄像头和智能手机。有鉴于此,近年来研究人员已经致力于开发便携式的细胞趋化迁移系统。Chen等[10]利用手机开发了一款可观测细胞形态和蛋白质光谱的光谱成像系统。Liao等[11]利用无透镜图像传感技术和全整数量化算法构建了一套卷积神经网络(convolutional neural networks,CNN)镜头硬件系统来进行细胞图像采集和分析。Go等[12]将基于智能手机的数字在线全息显微(digtal in-line holographic microscopy,DIHM)系统和机器学习算法相结合,开发了一款不需要人工解读的便携式设备,用来对微粒子进行感知和分类。但这些研究成果均不是专业的细胞趋化性研究设备。
针对细胞趋化性研究领域对便携式研究设备的需求,拟基于USB显微镜设计一套便携式细胞趋化迁移分析系统并应用于人体中性粒细胞对细胞趋化因子——白细胞介素(interleukin 8,IL8)的趋化性研究和高血糖对人体中性粒细胞趋化性的影响研究。该系统首先使用USB显微镜在实验过程中以10 s的间隔时间采集90幅细胞图像,再使用基于美国国家仪器公司(National Instruments, NI)的IMAQ Vision图像处理软件包开发的集成软件处理细胞运动图像。系统一方面可通过将第一幅和最后一幅细胞图像的宽度像素均分为10份,采用细胞分区计数和数字得分方法对细胞趋化性进行简单分析。此外,还可通过识别细胞的中心坐标并结合最小距离法追踪细胞运动追迹,进而计算细胞的趋化性指数CI、总迁移距离LAD、运动速度VMS和梯度位移LGD,从而评估细胞趋化性以及不同物质对其的影响。通过该迁移分析系统,可实现自动采集,分析细胞迁移轨迹,避免手工操作时出现的误差,保障了实验的重复性;且该系统结构结构简单,集成度较高,无需专业人员进行操作,有利于该系统的应用推广。
1 系统的工作原理
便携式细胞趋化迁移分析系统的结构示意图如图1所示。整个装置包含计算机、USB显微镜、微流体芯片、温控单元、发光二极管(light-emitting diode,LED)光源等。检测原理是:①LED光源通过透明加热片为微流体芯片提供照明,LED光源由多个LED发光二极管组成,可以实现不同的光源照射角度;②温控单元由数字温度控制器和透明加热片组成,加热片与微流体芯片贴合以保证芯片温度维持在(37±0.5) ℃;③USB显微镜每间隔10 s采集一幅细胞图像,实验时间15 min。图像存储于计算机硬盘并用于分析。

图1 便携式细胞趋化性实验装置Fig.1 Portable experimental apparatus for cell chemotaxis for cell chemotaxis
2 细胞趋化性分析方法
2.1 分析系统
便携式细胞趋化迁移分析系统如图2所示。趋化因子浓度梯度测试结果如图2(b)所示,微流体芯片如图2(c)所示。芯片主通道深度为60 μm,宽度为300 μm。芯片具有4个小腔,1为高浓度趋化因子入口,2为培养液注入口,3为细胞溶液入口,4为废液口。实验时,首先在趋化因子入口1和细胞培养液入口2分别注入10 nmol/L趋化因子50 μL IL8和0.4%牛血清白蛋白(bovine serum albumin,BSA)溶液50 μL。趋化因子和BSA溶液通过连续层流和扩散机制在主通道显微镜检测区域5形成稳定的化学浓度梯度。如图2(b)所示,化学浓度梯度平滑,可用于细胞趋化性检测。

图2 细胞趋化性检测装置图Fig.2 Physical graph of cell chemotactic deterction devices
2.2 集成软件开发
2.2.1 LabVIEW开发平台
NI公司的IMAQ Vision软件包为图像处理提供了完整的功能,它将4种功能整合到应用软件中,为实现强大的图像处理功能提供了可能,如灰度、彩色及二值化图像的显示、处理、形状匹配、分析计算等[13]。界面图如图3(a)所示。
2.2.2 图像采集和预处理
由于照明光线等因素的影响,图像在采集、传输过程中,质量会变差,为了便于图像分析和处理,需要对图像进行预处理,使图像更加清晰,凸显几何特征。USB显微镜采集的图像是彩色图像,图像数据量较大。因此,首先利用NI公司的IMAQ Vision图像处理软件包中的相关函数将彩色图像转化为灰度图像,即二值化处理。一幅灰度图像就是一个对应大小的数字矩阵,矩阵中的0代表黑色,255代表白色,中间的数值部分代表灰色。二值化处理后,再进行高斯滤波去噪操作。二值化和滤波操作程序框图如图3(b)、图3(c)所示,图像处理结果如图4(b)所示。

IMAQ Extract Single Color Plane:IMAQ提取单色平面;Red:红色;IMAQ Create:IMAQ生成;IMAQ ReadFile:IMAQ读取文件;Error in 2:错误输入2;IMAQ MathLookup:IMAQ数学查找;IMAQ Write File 2:IMAQ写文件2;Power 1/X:1/X次幂;Flie Path 3:文件路径3;Progressing:进展;Pclose:关闭进程;Dilate:膨胀;Erode:腐蚀;IMAQ Morphology:IMAQ形态学;IVA Circle Image %gf:IVA中心图像%gf;IMAQ Find Circles:IMAQ 发现中心;Image out:图像输出;Error out:错误输出;Circles Detaction 1:中心探测1;Binary:二进制;Palette Type:选项板类型图3 图像处理程序框图Fig.3 Blocking diagram of image processing program
噪声处理后,随即进行细胞图像分割处理。图像分割,即识别目标物体,根据图像的一些特性对图像像素进行分门归类,然后根据类别划分图像区域,使其后的图像分析、识别等高级处理阶段所处理的数据量减少,同时又保留有关图像结构特征的信息[14]。Canny边缘检测算法是较为理想的图像分割算法,其基本原理是:首先采用二维高斯函数在任一方向上的一阶导数作为噪声滤波器,接着通过与图像f(x,y)卷积进行滤波,最后寻找图像梯度的局部放大值,对图像边缘进行判断[15]。图像边缘检测程序框图如图3(c)所示,图像处理结果如图4(c)所示。结果表明Canny算子边缘检测算法较好地区分了细胞,并将彼此不相连的细胞很好地划分开来。
Canny算子分割细胞图像后,可继续使用形态学方法进行图像后处理,进一步提高后期细胞计数的精度。形态学操作主要是对图像进行膨胀、腐蚀等运算处理,完成去除图像边界干扰等任务。腐蚀和膨胀是最基本的形态操作,腐蚀收缩图像,膨胀扩大图像,它们互为对称。利用这两种运算可以分离相互粘接颗粒图像[16]。形态学操作程序框图如图3(d)所示。形态学处理之后,可以得到细胞中心坐标等信息并用于后期细胞分区计数分析。细胞中心坐标信息提取的程序框图如图3(e)所示。
2.2.3 细胞图像分区计数算法
图像预处理之后,可以得到细胞的中心坐标,随即可以根据细胞中心坐标评估细胞在微流体芯片主通道中的位置分布情况。具体操作过程为:①将微流体通道在宽度方向的像素值平均分为10等份;②依次扫描所有细胞的中心坐标,在扫描过程中,将每个细胞的坐标y值与芯片宽度像素均值作求取整数商运算,并根据细胞中心坐标位置将其划分在10个区域之中。搜索窗扫描细胞图像和每一区域的细胞数分布分别如图4(d)、图4(e)所示。

图4 图像处理结果Fig.4 Image processing results
2.2.4 实时细胞运动轨迹追踪分析算法
细胞分区计数程序框图如图5(a)所示,其中row1-row10代表10个分区,num表示细胞个数,PER/%表示细胞占总数的百分比,Tab为绘制表格,sum为总和,ROW_1和ROW_2为例,表示区域1,2。在得到细胞的中心坐标后,可以根据细胞中心坐标计算细胞在实验过程中的运动轨迹。由于在实验中使用的细胞溶液浓度较低,在进行细胞迁移实验时,细胞间的干扰很小。将每幅图片中所有细胞的中心坐标提取出来,将相邻两幅图片中的细胞中心坐标依次进行比较,计算坐标之间的距离,距离最小的两个坐标即为同一个细胞在这两幅图片中的轨迹坐标。按此方法计算出90幅细胞图片中所有细胞的轨迹坐标,以x坐标为横坐标,以y坐标为纵坐标,绘制出细胞的移动轨迹曲线。细胞追迹程序框图如图5(b)所示。
在确定了细胞的移动轨迹后,即可根据运动轨迹计算细胞的趋化性指数CI和趋化性速度。CI指细胞朝向梯度的位移(梯度位移)与总迁移距离之间的比值;趋化性速度指总迁移距离与总迁移时间的比值。由细胞在第一幅图片和最后一幅图片中的y坐标计算其梯度方向位移,细胞的运动轨迹坐标计算其总迁移距离,两者比值即为趋化性指数CI;再将总迁移距离比上总实验时间即得趋化性速度。细胞CI和趋化性速度计算程序框图如图5(c)所示。

图5 细胞趋化性分析程序框图Fig.5 Block diagram of chemotaxis analysis program

(1)

(2)
式中:CI为趋化性指数;LGD为细胞朝向梯度的位移(梯度位移);LAD为总迁移距离;VMS为运动速度;T为总迁移时间。
3 实验验证
3.1 微流体芯片
微流体芯片通过标准的光刻技术来制[17]。首先,利用AutoCAD设计光掩膜并使用高分辨率打印机打印光掩模。随后将图案化的光掩模与旋涂有SU-8光刻胶、直径为80 mm的硅片相接触,经过紫外曝光后产生约60 μm的光刻胶厚度。光刻基板制作好之后,将硅片放入细胞培养皿后倒入聚二甲基硅氧烷(polydimethysioxane,PDMS)胶水,并将培养皿放入200 ℃烤箱烘烤1 h。最后,采用氧气等离子体处理PDMS芯片和玻璃基片60 s,改善PDMS和玻璃表面活性,然后贴合放置,使芯片永久性黏合[18]。实验开始前,首先在微流体芯片中注入0.25 mg/mL纤连蛋白,静置1 h后再注入0.4%的牛血清蛋白,以帮助细胞黏合在微流体通道上。
3.2 细胞制备与实验
中性粒细胞通过人体全血经梯度密度离心法分离并存储在37 ℃保温箱中[19]。实验时,先将中性粒细胞注入预先形成有白细胞介素化学梯度的单通道芯片,并每间隔10 s采集一幅细胞图像,实验时间为15 min。如图6所示,实验进行15 min后,中性粒细胞朝向白细胞介素浓度较高的区域发生了明显地迁移运动。
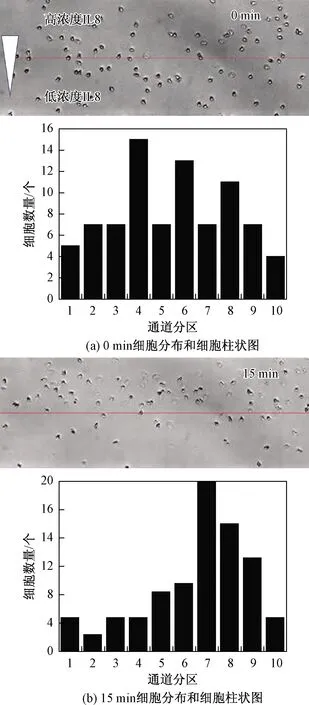
图6 不同时刻不同区域的细胞分布和细胞柱状图Fig.6 Cell distribution and histogram of different regions at different times
3.3 基于细胞分区计数及数字评分法的细胞趋化性能评估
为了更加简便地分析细胞趋化性,基于分区计数方法开发了数字评分法。数字评分法原理:①计算2副图像中每一个划分区域中细胞数量;②根据实验开始和结束时,同一区域中细胞数量的增减来评分。如果同一分区中的细胞数量在实验开始和结束时的差值大于0,则得1分,表明有细胞进入这一区域;如果差值小于0,则得-1分,表明有细胞远离这一区域;如果差值为0,则得0分;③分别计算1~5分区(低浓度白细胞介素)和6~10分区(高浓度白细胞介素)所有得分的总和。数字评分表如表1所示。表1表明6~10分区的细胞趋化性得分为16,明显高于1~5分区的细胞趋化性得分-20;④将1~5分区得分的绝对值和6~10分区得分的值相加,以确定最后的趋化性得分为36。数字评分法将提供一种简单的方法来评估细胞趋化运动能力。

表1 不同时刻不同区域的细胞数及数字得分分析
3.4 基于实时细胞运动轨迹的细胞趋化性能评估
通过分析采集的90幅细胞图像,对部分细胞进行追踪后绘制的轨迹曲线如图7所示,图7中曲线的坐标已经过归一化处理。如图7所示,中性粒细胞的移动轨迹都是朝向白细胞介素浓度较高的区域延伸。根据细胞的运动轨迹计算了它们的总迁移距离LAD和梯度位移LGD,进而计算了这些细胞的趋化性指数CI和平均运动速度VMS,如表2所示。从表2中可以看到,中性粒细胞在从低浓度白细胞介素区向高浓度白细胞介素区的移动过程中,其平均总迁移距离LAD为157.379 μm,平均梯度位移LGD为78 μm,CI为0.491,平均运动速度VMS为0.175 μm/s。

表2 细胞追迹数据

图7 细胞移动轨迹曲线Fig.7 Cell trajectory curve
3.5 高血糖对中性粒细胞趋化性的影响实验研究
脓毒症是糖尿病常见的并发症,研究表明脓毒症会导致糖尿病患者体内中性粒细胞趋化性异常[20]。而糖尿病的典型症状就是血液葡萄糖含量过高。为探究高血糖和中性粒细胞迁移的关系,使用浓度分别为0(对照组)、1、5 mmol/L(人体血液中正常血糖浓度),25 mmol/L的葡萄糖溶液孵育中性粒细胞,孵育时间设定为1 h。随后使用便携式细胞趋化迁移分析系统分析中性粒细胞运动情况,获取CI和VMS数据。实验结果如图8所示。
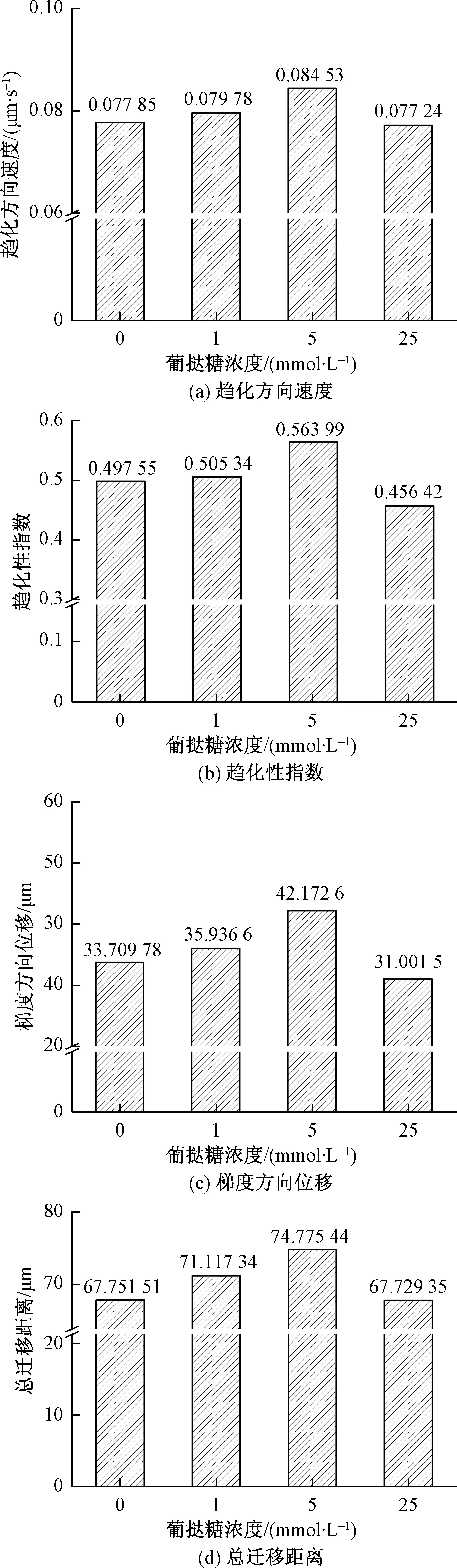
图8 不同浓度葡萄糖处理下的中性粒细胞迁移情况Fig.8 Neutrophil migration under different glucose concentrations
实验结果显示,经过5 mmol/L葡萄糖溶液处理过的中性粒细胞,VMS最大,LAD最大,CI最大,LGD最大;经过25 mmol/L葡萄糖溶液处理过的中性粒细胞,VMS最小,LAD最小,CI最小,LGD值最小; 1 mmol/L葡萄糖溶液处理过的中性粒细胞,其VMS、LAD、CI、LGD比没经过葡萄糖处理的中性粒细胞略高。
实验结果表明,低浓度葡萄糖会促进细胞趋化性,但是当葡萄糖浓度达到一定值时,葡萄糖反而会抑制细胞趋化性。在正常人体血糖浓度情况下,中性粒细胞的趋化性指数最佳,趋化性最好。在高血糖浓度下,中性粒细胞的趋化性指数最差,趋化性最差。
分析原因在于:低浓度葡萄糖会给细胞提供趋化能量,提高细胞趋化能力。但是当细胞处于高浓度葡萄糖时,细胞由于渗透压等因素,影响了中性粒细胞活性,使得中性粒细胞趋化性变差。
4 结论
在USB显微镜、微流体芯片、计算机等构成的硬件基础上,基于LabVIEW开发了便携式细胞趋化迁移分析系统。使用NI公司的IMAQ Vision软件包开发了一套集成软件,其具有细胞运动图像采集和预处理、细胞分区计数、细胞运动速度和趋化性指数分析功能。通过采集和分析中性粒细胞的运动图像验证了便携式细胞趋化性检测系统的检测性能。同时,运用该系统探究了不同葡萄糖浓度对中性粒细胞趋化性能的影响,得出如下结论。
(1)高血糖环境会影响中性粒细胞的迁移运动能力,便携式细胞趋化迁移分析系统提高了整个细胞趋化性研究装置的集成化和便携性。
(2)目前制约实验效果的是LED光源和USB显微镜的分辨率,相信随着采用新型的LED光源和高分辨率的USB显微镜,该系统会有更大的发展潜力。目前研究还停留在实验室阶段,还有待进一步完善,使得该装置的应用范围更广,将其运用到如癌细胞的趋化研究中。
