GPR30受体拮抗对大豆异黄酮降低ox-LDL诱导的EA.hy926细胞氧化损伤的影响
2021-07-11郭金洲陈海宁马晶鑫田维毅蔡琨
郭金洲 陈海宁 马晶鑫 田维毅 蔡琨

【摘 要】 目的:研究G蛋白偶联雌激素受体GPR30在大豆异黄酮降低ox-LDL导致的EA.hy926细胞氧化损伤时发挥的作用。方法:体外培养EA.hy926细胞,随机分为空白组、模型组(ox-LDL)、雌二醇组(ox-LDL+E2)、大豆异黄酮组(ox-LDL+SIF)、GPR30受体拮抗剂组(G-15预先干预2 h,ox-LDL+SIF)。采用CCK-8法检测细胞生存率,二硝基苯肼显色法檢测LDH活性,ELISA法检测ET-1水平,WST-1法检测SOD活力,TBA法检测MDA含量,qPCR检测HO-1mRNA表达,Western Blot检测GPR30受体蛋白表达情况。结果:与模型组相比,在SIF干预下,细胞存活率升高,LDH活性、ET-1水平和MDA含量均降低,SOD活力和HO-1mRNA表达升高(P<0.01),拮抗GPR30受体后,与SIF组相比,细胞存活率显著下降,LDH活性、ET-1水平和MDA含量均显著增高,SOD活力和HO-1mRNA表达下降(P<0.01或P<0.05),GPR30蛋白表达明显降低。结论:大豆异黄酮可以显著降低ox-LDL引起的EA.hy926细胞氧化损伤,其作用机制可能与结合G蛋白偶联雌激素受体后发挥类雌激素作用有关。
【关键词】 大豆异黄酮;GPR30;ox-LDL;氧化损伤;内皮细胞;植物雌激素
【中图分类号】R285.5 【文献标志码】 A 【文章编号】1007-8517(2021)08-0017-06
Abstract:Objective To studythe role of GPR30 in soy isoflavones(SIF) on human umbilical vein cell fusion cell (EA.hy926) by oxidative damage.Methods EA.hy926 cells were cultured in vitro and oxidized low density lipoprotein (ox-LDL) was induced to form oxidative damage cell model.The cells divided randomly into control group, model group (ox-LDL), estradiol group (ox-LDL +E2),soy isoflavonesgroup (ox-LDL +SIF), GPR30 receptor antagonist group(G-15 pre-intervention for 2h, ox-LDL+SIF) .Cell survival rate was detected by cck-8 method, LDH activity was detected by dinitrophenylhydrazine chromography,ET-1 level was detected by ELISA method, SOD activity was detected by WST-1 method, and MDA content was detected by TBA method.mRNA expression of ho-1 was detected by qrt-pcr,protein expression of GPR30 was detected by Western Blot.Results Compared with the model group, under SIF intervention, cell survival rate was increased, LDH activity, ET-1 level and MDA content were all reduced, and SOD activity andHO-1mRNA was increased (P<0.01 );Compared with the SIF group,the GPR30 receptor is antagonized,cell survival rate was reduced, LDH activity, et-1 level and MDA content were all increased, and SOD activity andHO-1mRNA was reduced (P<0.01 ),protein expression of GPR30 wasreduced (P<0.01 ) Conclusion The SIFcan significantly reduce oxidative damage of EA.hy926 cells caused by ox-ldl, and the mechanism of action may be related to the GPR30receptor.
Key words:SIF;GPR30;ox-LDL;Oxidative Damage; The Endothelial Cells
现代医学认为动脉粥样硬化(Atherosclerosis,AS)是多因素共同作用引起的疾病,虽然其发病机制尚不明确。但研究发现,氧化应激是AS发生发展的重要因素[1],而ROS蓄积增多引起的血管内皮氧化损伤是 AS发病机制的关键环节[2-3]。
G蛋白偶联雌激素受体(G protein-coupled estrogen receptor,GPER/GPR30)作为一种新型的7次跨膜G蛋白偶联雌激素膜受体[4],在雌激素非基因组效应中发挥主要作用[5]。有报道称,通过调节GPR30降低动脉粥样硬化的发生[6]。以往的研究发现,大豆异黄酮(soy isoflavones,SIF)具有良好的抗氧化损伤作用[7-8],SIF是植物雌激素的一种,具有类雌激素作用。因此我们推测大豆异黄酮可能通过GPR30介导的类雌激素效应降低内皮细胞氧化损伤。为验证我们的猜想,实验选用ox-LDL诱导EA.hy926细胞构建内皮氧化损伤模型,使用SIF干预损伤模型,观察其抗氧化作用,并观察使用GPR30受体拮抗剂G-15干预后,SIF抗氧化损伤效应的变化,进而探讨SIF抗氧化损伤及其与GPR30的关系。
1 材料与方法
1.1 材料
1.1.1 细胞株 人脐静脉内皮细胞融合细胞(Human umbilical vein cell fusion cell,EA.hy926),购自中国科学院昆明细胞库(编号:KCB2014049YJ)。
1.1.2 试剂与仪器 大豆异黄酮标准品购自上海源叶生物有限公司; ox-LDL购自广州奕源有限公司;RIPA裂解液购自索莱宝科技有限公司;CCK-8试剂购自尚宝生物科技有限公司;ET-1Elisa试剂盒购自深圳子科;LDH检测试剂盒、MDA检测试剂盒、SOD检测试剂盒均购自南京建成有限公司;SDS-PAGE凝胶制备试剂盒购自BIO-RAD公司;RNA提取试剂盒购自Thermo公司;PrimeScriptTM RTreagent Kit with gDNA Eraser、TB GreenTM Premix Ex TaqTM Ⅱ(Tli RNaseH PLUS)购自Takara公司;β-actin antibody、山羊抗兔荧光Ⅱ抗购自Absin公司;GPR30 antibody购自购自CST公司。CO2细胞培养箱、多功能酶标仪购自Therom公司;倒置显微镜购自OLYMPUS公司。
1.2 实验方法
1.2.1 细胞分组及处理 取对数生长期的EA.hy926细胞,随机分为:空白对照组(Control)、模型组(ox-LDL)、雌二醇组(E2)、大豆异黄酮组(SIF)、GPR30受体拮抗剂组(G-15)。模型组加入终浓度40 mg·L-1ox-LDL ;雌二醇组、大豆异黄酮组在加入ox-LDL 的同时再分别给予终浓度为10 μmol·L-1E2和80 μg·L-1SIF,GPR30受体拮抗剂组预先使用10-7 mol·L-1G-15干预2 h,然后加入终浓度40 mg·L-1ox-LDL和80 μg·L-1SIF,置于37 ℃、5%CO2条件下培养24 h。
1.2.2 CCK-8检测细胞存活率 将细胞以5×103个/孔,接种于96孔板中,分组及处理方式参照2.1进行,干预结束后,吸弃细胞培养上清,每孔加入90 μL基础培养基和10μL CCK-8试剂,孵育2 h,酶标仪450 nm波长测定各孔吸光值(OD)并计算细胞存活率,并按试剂说明书公式计算各组细胞存活率。
1.2.3 LDH、ET-1检测 取对数生长期的EA.hy926细胞以1×106个/孔,接种于T25瓶中,按照2.1分组并处理细胞,吸取细胞培养上清,分装于1.5 mLEP管中,于-20 ℃保存。细胞上清中LDH、ET-1檢测参照各自试剂盒说明书进行。
1.2.4 SOD、MDA的检测 按照2.3收集细胞培养上清后,使用预冷的PBS冲洗细胞2次,加入适当预冷PBS于冰上使用细胞刮刀,收集细胞转存于1.5 mLEP管中,1000×g,4 ℃离心5 min,弃上清后,加入含有1%蛋白酶抑制剂的细胞裂解液,超声粉碎后,于冰上裂解30 min,12000×g,4 ℃离心取上清,即得细胞蛋白,采用BCA法测定各组蛋白含量。SOD、MDA检测参照各试剂盒说明书进行。
1.2.5 qRT-PCR检测 HO-1 mRNA表达水平
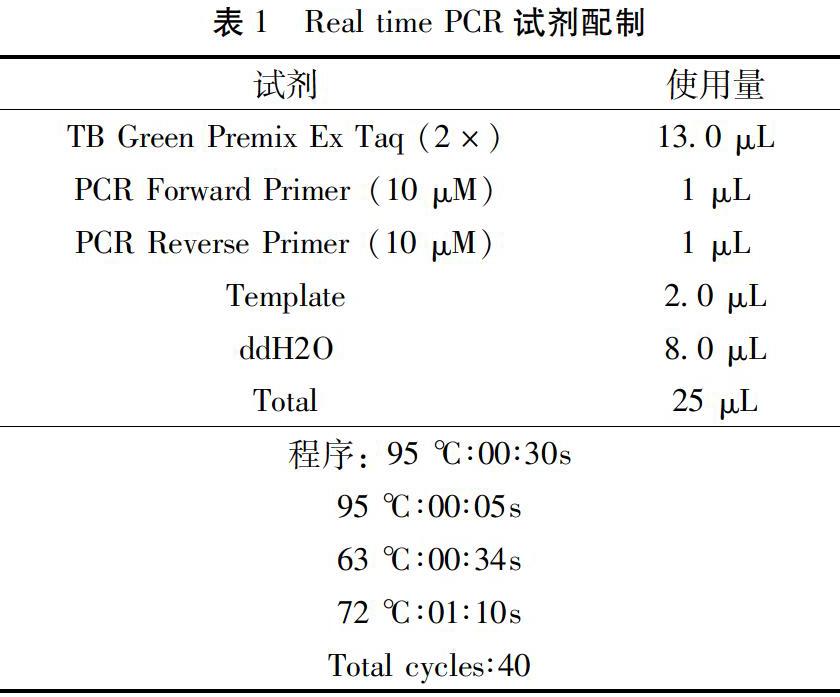
按RNA提取试剂盒说明书进行RNA的提取,RNA样品以OD260/OD280的比值在1.8~2.0之间为佳。RNA反转录按试剂盒进行,cDNA保存在-20 ℃。以cDNA作为模板进行PCR,反应体系及条件见表1。按2-ΔΔct法计算各基因相对表达水平。引物由上海生工生物工程有限公司设计合成,序列见表2。
1.2.6 Western Blot检测GPR30蛋白表达 细胞核蛋白提取按照核蛋白提取试剂盒说明书进行,细胞总蛋白提取及蛋白定量参照1.2.4进行,蛋白上样量统一为30 μg,使用10%SDS-PAGE凝胶进行电泳,湿转法于冰上转膜1 h。5%脱脂奶粉封闭,分别加入一抗GPR30(1∶[KG-*3/5]300)β-actin(1∶[KG-*3/5]1000),4℃孵育过夜。用TBST洗涤3次,加入二抗(1∶[KG-*3/5]10000)室温孵育1h,用TBST洗涤3次。采用ECL显色,使用ImageJ软件进行分析。
1.2.7 统计学处理 应用SPSS19.0软件进行统计分析,数据以(x±s)表示,当满足正态性及方差齐性时,多组间比较采用单因素方差分析、两两比较采用LSD,以P<0.05为差异有统计学意义。
3 结果
3.1 不同处理方式对EA.hy926细胞存活率的影响 模型组细胞存活率较空白组显著下降(P<0.01);E2和SIF干预的细胞存活率较模型组显著增高(P<0.01),拮抗GPR30受体后,SIF干预细胞存活率与模型组相比无差异,与E2和SIF干预组相比细胞存活率显著下降。结果见表3。
3.2 不同处理方式对EA.hy926细胞培养上清中LDH、ET-1影响 与空白组相比,模型组、雌二醇组和大豆异黄酮组细胞上清中LDH活性、ET-1显著升高(P<0.01);与模型组相比,雌二醇组和大豆异黄酮组,细胞上清中LDH活性、ET-1水平明显降低均有显著性差异(P<0.01);GPR30受体拮抗剂组与大豆异黄酮组相比,细胞上清中LDH活性、ET-1显著升高(P<0.01)。结果如图1所示。
3.3 不同处理方式对EA.hy926细胞中SOD、MDA影响 与空白组相比,模型组细胞SOD活力有显著下降(P<0.01)MDA水平均显著升高(P<0.01),雌二醇组和大豆异黄酮组SOD活力、MDA水平亦无显著性差异;与模型组相比,雌二醇组和大豆异黄酮组细胞SOD活力有显著升高(P<0.01)MDA水平均显著下降(P<0.01);与雌二醇组组相比,大豆异黄酮组SOD活力及MDA水平无显著性差异;GPR30受体拮抗剂组与大豆异黄酮组相比,细胞SOD活力显著下降(P<0.01)MDA水平均显著升高(P<0.01);与模型组相比,SOD活力及MDA水平无显著性差异。结果如图2所示。
3.4 各组细胞中HO-1 mRNA表达水平 与空白组相比,模型组、雌二醇组和大豆异黄酮HO-1 mRNA表达显著升高(P<0.01);与模型组相比,雌二醇组和大豆异黄酮组HO-1 mRNA表达显著升高(P<0.01);与雌二醇组组相比,大豆异黄酮组HO-1 mRNA表达无显著性差异;GPR30受体拮抗剂组与大豆异黄酮组相比,HO-1 mRNA表达显著显著下降(P<0.01)。结果见表4。
3.5 各组细胞中GPR30受体蛋白表达情况 正常组细胞中,GPR30蛋白表达较低,在ox-LDL干预后,细胞内GPR30蛋白表达显著增多,与正常组相比增多具有显著性差异;ox-LDL分别与雌二醇和大豆异黄酮共同干预后,与正常组相比,GPR30蛋白表达显著增多,与模型组相比,GPR30受体蛋白表达明显降低;使用GPR30特异性阻断剂G-15预先处理后,ox-LDL和大豆异黄酮共同干预,GPR30蛋白表达与正常组相比,无显著差异,与大豆异黄酮组相比,显著下降。结果如图5所示。
4 讨论
ROS氧化修饰低密度脂蛋白(LDL)生成的氧化型低密度脂蛋白(ox-LDL)[9]可导致内皮细胞中gp91吞噬细胞氧化酶表达增加,使NADPH氧化酶活性增强进而导致ROS生成增多[10],引起血管内皮氧化损伤并进一步导致AS发生发展。在本次实验中,使用ox-LDL干预EA.hy926细胞后,细胞生存率明显下降,并出现了明显的氧化损伤,证明模型制备成功。
女性绝经后,LDL-C水平急剧上升,而HDL-C水平则适度下降。同样,HDL-C的下降伴随着apoA-I水平的升高,进而导致动脉粥样硬化和CAD发病率和死亡率升高,因此,有理由推测内源性腺激素起到了重要作用[11]。研究[12]发现,SIF可影响女性激素水平,其作为植物雌激素的一种,具有类雌激素作用,同时也是一种优良的天然抗氧化剂,对心血管疾病表现出良好的积极作用[13]。本次研究结果中,尽管SIF组中的LDH活性和ET-1水平相比正常组明显升高,但相比于模型组细胞,SIF可以显著提高其存活率,并且增加了抗氧化酶SOD的活性以及抗氧化化酶HO-1的mRNA表达水平,氧化损伤指标显著降低。值得注意的是,实验结果显示,SIF降低氧化损伤的作用效果与雌二醇效果相当。使用雌二醇干预氧化损伤引起的动脉粥样硬化在临床应用中已早有报道,但有报道称,长期暴露于大剂量雌二醇中会引起恶性癌症[14]发生。同时有研究[15]表明,染料木素可降低由雌二醇引起的内皮损伤。SIF主要物質为染料木素、大豆黄素等,因此,笔者认为SIF在起到雌激素作用的同时,或许还可以降低雌激素过量引起的机体损伤。这为SIF在临床中作为雌激素的替代品或作为应用雌激素时的辅助品提供了可能。
G蛋白偶联雌激素受体GPR30在二十年前的人类乳腺癌细胞中发现,随后在许多其他细胞中被发现。有报道称,GPR30无处不在,具有多种生物学作用,包括调节内分泌,免疫,神经元和心血管功能[16],以往的实验[17]发现,GPR30可以减少绝经后的动脉粥样硬化和炎症的发生,揭示了GPR30的抗动脉粥样硬化功能。有研究[18]表明,雌二醇可通过GPR30预防动脉粥样硬化的发生。因此,笔者推测具有类雌激素作用的SIF或许可以作用于心血管系统中的GPR30受体降低内皮细胞氧化损伤,并进一步降低动脉粥样硬化的发生。本实验结果显示,在使用GPR30受体特异性阻断剂干预后,SIF降低内皮细胞氧化损伤的作用显著降低,这也证实了笔者的推测。但有趣的是,在本次实验结果中,正常组细胞GPR30蛋白表达很低,但在ox-LDL引起氧化损伤后,GPR30表达显著升高,或许二者之间存在着某种特殊关系,本次实验并未深入研究,这或将成为接下来的关注重点。但GPR30受体特异性阻断后,与SIF组相比GPR30蛋白表达显著降低,这至少证明了GPR30受体在SIF抗氧化损伤中起着重要作用。
综上,笔者认为SIF对血管内皮细胞具有抗氧化损伤的作用,并可能是通过调节GPR30受体完成。不足之处,在于本研究仅仅通过体外实验证明了GPR30拮抗在SIF降低氧化损伤的中作用,对其深层的作用机制未涉及,这将会是接下来的工作重点。
参考文献
[1]LOZHKIN A, VENDROV A E, PAN H, et al. NADPH oxidase 4 regulates vascular inflammation in aging and atherosclerosis[J]. Journal of Molecular & Cellular Cardiology, 2017(102):10-21.
[2]GRAZIA T,GIOVANNA V,ELENA G, et al. Aquaporin Membrane Channels in Oxidative Stress, Cell Signaling, and Aging: Recent Advances and Research Trends[J]. Oxidative Medicine & Cellular Longevity,2018:1-14.
[3]SALAZAR G. NADPH Oxidases and Mitochondria in Vascular Senescence[J]. International journal of molecular sciences,2018,19(5):1327.
[4]KELLY M J, LEVINn E R. Rapid actions of plasma membrane estrogen receptors[J]. Trends in Endocrinology & Metabolism, 2001, 12(4):152-156.
[5] PPOP M,Maggiolini Marcello,Musti Anna Maria. GPER Mediates Non-Genomic Effects of Estrogen[J]. Methods in molecular biology (Clifton, N.J.),2016(1366):471-488.
[6]JING Y, CAI D, CHEN Q, et al. Liuwei Dihuang soft capsules attenuates endothelial cell apoptosis to prevent atherosclerosis through GPR30-mediated regulation in ovariectomized ApoE-deficient mice[J]. Journal of Ethnopharmacology, 2017(208):185-198.
[7] 郑峰,金芳多,金梅花,等.大豆异黄酮对H2O2致L02细胞损伤的保护作用[J].大豆科学,2020,39(3):458-463.
[8]LUO Q, LI Y, HUANG C, et al. Soy Isoflavones Improve the Spermatogenic Defects in Diet-Induced Obesity Rats through Nrf2/HO-1 Pathway[J].Molecules,2019,24(16):2966.
[9] YUAN X S,CHEN J J,DAI M. Paeonol promotes microRNA-126 expression to inhibit monocyte adhesion to ox-LDL-injured vascular endothelial cells and block the activation of the PI3K/Akt/NF-κB pathway[J]. International journal of molecular medicine,2016,38(6):1871-1878.
[10] LI N, LI B, BRUN T, et al. NADPH Oxidase NOX2 Defines a New Antagonistic Role for Reactive Oxygen Species and cAMP/PKA in the Regulation of Insulin Secretion[J]. Diabetes, 2012, 61(11):2842-2850.
[11] BARRETT C E. Menopause, atherosclerosis, and coronary artery disease[J]. Current Opinion in Pharmacology, 2013,13(2):186-191.
[12] 劉鹿,吕春健,张新胜,等.大豆异黄酮干预对围绝经期女性综合征及性激素水平的影响研究[J/OL].中国食物与营养:1-4[2020-08-23].https://doi.org/10.19870/j.cnki.11-3716/ts.20200716.003.
[13]李硕,王建.大豆异黄酮临床应用的研究进展[J/OL].大豆科学:1-11[2020-08-23][BF].http://kns.cnki.net/kcms/detail/23.1227.S.20200713.1037.012.html.[BFQ]
[14] PUPO M, MAGGIOLINI M, MUSTI AM. GPER Mediates Non-Genomic Effects of Estrogen[J].Methods Mol Biol, 2016(1366):471-488.
[15] LIU B, XU L, YU X, et al. Genistein Inhibited Estradiol-Induced Vascular Endothelial Cell Injury by Downregulating the FAK/Focal Adhesion Pathway[J].Cell Physiol Biochem, 2018,49(6):2277-2292.
[16] FELDMAN R D, LIMBIRD L E. GPER (GPR30): A Nongenomic Receptor (GPCR) for Steroid Hormones with Implications for Cardiovascular Disease and Cancer[J].Annu Rev Pharmacol Toxicol, 2017(57):567-584.
[17] [JP3]MEYER MATTHIAS R,Fredette Natalie C,Howard Tamara A, et al. G protein-coupled estrogen receptor protects from atherosclerosis[J].Sci Rep,2014(4):7564. [JP]
[18]RESANOVIC I, RIZZO M, ZAFIROVIC S, et al. Anti-atherogenic effects of 17β-estradiol[J]. Hormone and Metabolic Research, 2013,45(10):701-708.
(收稿日期:2020-09-15 编辑:刘 斌)
