乙酰半胱氨酸微生物限度方法学验证
2021-07-10王淑玲
王淑玲
(1.扬子江药业集团南京海陵药业有限公司,江苏南京 210000;2.南昌大学,江西南昌 330000)
N-乙酰半胱氨酸(N-acetylcysteine,NAC)是含巯基(-SH)的还原型谷胱甘肽(Glutathione,GSH)前体,曾用作黏液溶解剂和对乙酰氨基酚中毒的治疗[1]。其在调节免疫、抗感染、抗毒素等领域中也具有独特优势。本文基于《中国药典》2015 版对该药品的微生物限度检查方法进行了验证。
1 材料与方法
1.1 仪器与试剂
LRH-150、MJ150-1 生化培养箱,上海索谱仪器有限公司;XG1.G 脉动真空灭菌器,山东新华医疗器械股份有限公司;1384-A2 生物安全柜,赛默飞;PL202-L 电子天平,METTLER TOLEDO;EZ 自动微生物过滤检验装置,密理博。
乙酰半胱氨酸(批号201904014、201905008、201908005),武汉远大弘元股份有限公司。
1.2 菌种与培养基
金黄色葡萄球菌[CMCC(B)26003]、铜绿假单胞菌[CMCC(B)10104]、枯草芽孢杆菌[CMCC(B)63501]、白色念珠菌[CMCC (F)98001]、黑曲霉[CMCC(F)98003]、大肠埃希菌[CMCC(B)44102],北京三药科技开发公司。
胰酪大豆胨液体培养基、沙氏葡萄糖琼脂培养基,北京三药;胰酪大豆胨琼脂培养基、沙氏葡萄糖液体培养基,青岛日水生物技术有限公司;麦康凯液体培养基、麦康凯琼脂培养基,BD;pH 7.0 无菌氯化钠-蛋白胨缓冲液(以下简称缓冲液),扬子江药业集团。
1.3 溶液制备
接种金黄色葡萄球菌、枯草芽孢杆菌、铜绿假单胞菌培养物至胰酪大豆胨液体培养基中,于30~35 ℃培养18~24 h;接种大肠埃希菌液体培养物胰酪大豆胨液体培养基中,于30~35 ℃培养18~24 h,接种白色念珠菌液体培养物至沙氏葡萄糖液体培养基,于20~25 ℃培养18~24 h,分别将金黄色葡萄球菌、枯草芽孢杆菌、铜绿假单胞菌、白色念珠菌培养物用缓冲液制成含菌数≤10 000 cfu/mL 的菌悬液,将大肠埃希菌培养物制成含菌数≤100 cfu/mL 的菌悬液。接种黑曲霉培养物至沙氏葡萄糖琼脂培养基,于20~25 ℃培养5~7 d,加入含0.05%的聚山梨酯80 的缓冲液,制成含菌数≤10 000 cfu/mL 的菌悬液。
取样品10 g,加90 mL 缓冲液,再加入6 mol/L 的氢氧化钠溶液10 mL,充分混匀,制成1 ∶10 的供试液,用缓冲液稀释制成1 ∶50 的供试液。
1.4 需氧菌总数检查验证(薄膜过滤法)
1.4.1 试验组
取1 ∶50 的供试液9.9 mL 和≤10 000 cfu/mL的金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌、白色念珠菌等菌悬液、黑曲霉孢子悬液0.1 mL 混匀后,取1 mL 加入约50 mL 缓冲液过滤(滤膜已用50 mL 缓冲液润湿),冲洗5 次,每次100 mL。取出滤膜,菌面朝上,贴于胰酪大豆胨琼脂培养基上,于30~35 ℃倒置培养不超过3 d,过滤白色念珠菌菌悬液、黑曲霉孢子悬液的平皿于30~35 ℃倒置培养不超过5 d,点计菌落数。
1.4.2 菌液组
取缓冲液9.9 mL,其他均同试验组操作方法。
1.4.3 供试品对照组
取缓冲液50 mL 和1 ∶50 供试液1 mL,过滤、冲洗5 次,每次100 mL。取出滤膜,菌面朝上,贴于胰酪大豆胨琼脂培养基上,于30~35 ℃倒置培养不超过3 d(操作方法同试验组),点计菌落数。
1.4.4 阴性对照组
取缓冲液50 mL,过滤、冲洗5 次,每次100 mL。取出滤膜,菌面朝上,贴于胰酪大豆胨琼脂培养基上,于30~35 ℃倒置培养不超过3 d(操作方法同试验组),点计菌落数。
1.5 霉菌和酵母菌总数检查验证(平皿法)
1.5.1 试验组
取1 ∶10 的供试液9.9 mL 分别和白色念珠菌悬液(含菌数≤10 000 cfu/mL)及黑曲霉孢子悬液(含孢子数≤10 000 cfu/mL)各0.1 mL 混匀,吸取1 mL 加入平皿中,加入45 ℃的沙氏葡萄糖琼脂培养基15~20 mL,混匀,凝固,于20~25 ℃倒置培养不超过5 d,点计菌落数。
1.5.2 菌液组
取缓冲液9.9 mL,其他均同试验组操作方法。
1.5.3 供试品对照组
取1 ∶10 的供试液1 mL 加入平皿中,加入45 ℃的沙氏葡萄糖琼脂培养基15~20 mL,混匀,凝固,于20~25 ℃倒置培养不超过5 d,点计菌落数。
1.5.4 阴性对照组
取缓冲液1 mL 加入平皿中,加入45 ℃的沙氏葡萄糖琼脂培养基15~20 mL,混匀,凝固,于20~25 ℃倒置培养不超过5 d,点计菌落数。
1.6 控制菌-大肠埃希菌检查验证(薄膜过滤法)
1.6.1 阳性对照组
取1 ∶10 的供试液10 mL 和缓冲液50 mL,用已润湿滤膜过滤、冲洗(每次100 mL,冲洗3 次),在最后一次冲洗液中加入不大于10 000 cfu/mL 的菌悬液1 mL,冲洗结束后,取出滤膜,接种至100 mL 胰酪大豆胨液体培养基中,于30~35 ℃培养18~24 h,备用。
1.6.2 供试品对照组
取1 ∶10 的供试液10 mL 和缓冲液50 mL,用滤膜(已用50 mL 的缓冲液润湿)过滤、冲洗(每次100 mL,冲洗3 次),冲洗结束后,取出滤膜,接种至100 mL 胰酪大豆胨液体培养基中,于30~35 ℃培养18~24 h,备用。
1.6.3 阴性对照组
取缓冲液50 mL,用滤膜(已用缓冲液润湿)过滤、冲洗(每次100 mL,冲洗3 次),冲洗结束后,取出滤膜,接种至100 mL 胰酪大豆胨液体培养基中,于30~35 ℃培养18~24 h,备用。
1.7 回收率计算
根据公式(1)计算回收率。

2 结果与分析
需氧菌总数检查验证(薄膜过滤法)结果见表1,霉菌和酵母菌总数检查验证(平皿法)结果见表2,控制菌-大肠埃希菌检查验证(薄膜过滤法)结果见表3。回收率数据表明,需氧菌检查、控制菌检查采用薄膜过滤法,霉菌和酵母菌数检查采用平皿法,试验菌的回收率均在0.5~2.0,方法准确度高。
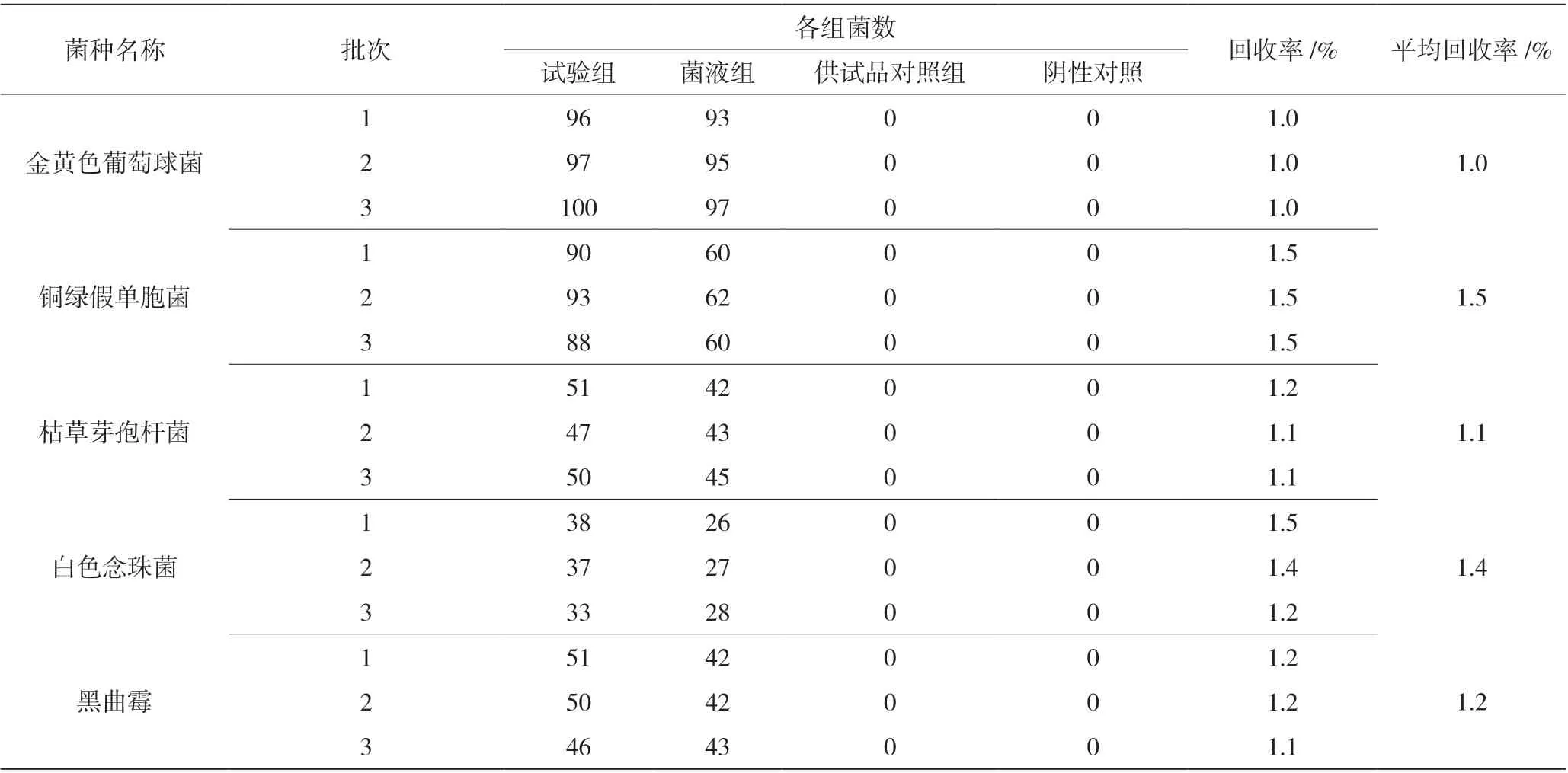
表1 需氧菌总数检查验证结果
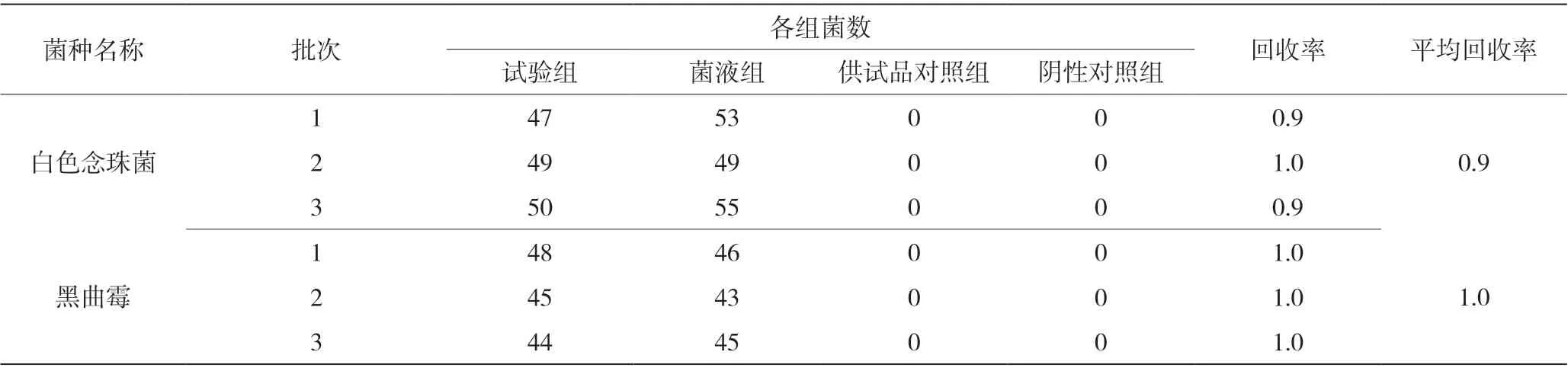
表2 霉菌和酵母菌总数检查验证结果
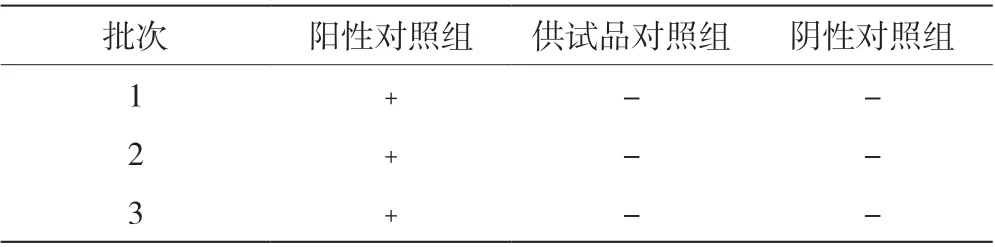
表3 大肠埃希菌检查验证结果
3 结论
乙酰半胱氨酸的需氧菌检查、控制菌检查采用薄膜过滤法,霉菌和酵母菌数检查采用平皿法,试验菌的回收率均在0.5~2.0,方法可行。
