水杨酸和吲哚丁酸对冬季山椒子幼苗生长及抗逆生理的影响
2021-07-09宋子琪邓荣艳刘世男
宋子琪,邓荣艳,杨 梅,王 磊,刘世男
(广西大学 林学院,广西 南宁 530000)
关键字:山椒子;水杨酸;吲哚丁酸;生理;生长
山椒子Uνaria grandiflora是番荔枝科Annonaceae紫玉盘属Uνaria的一种攀援状灌木植物,主要分布于中国广东南部及其附近岛屿,生长于山地丘陵密林或者低海拔灌木林中。山椒子为中国民间的一种传统药物,多用于治疗风湿病、腰腿痛等疾病[1],具有重要的栽培及开发利用前景。目前,国内山椒子基本上处于野生状态,自然状态下山椒子种子发芽率相对较低,幼苗生长缓慢。国内关于山椒子的研究多从其化学成分入手,部分学者对山椒子种子发芽进行了研究[2],而关于山椒子幼苗生长及培育的研究报道较为鲜见。为了提高山椒子的开发利用率,为其大规模的人工种植提供参考,研究如何促进山椒子幼苗生长及其处于不同生长环境下的抗逆生理响应具有一定的必要性。
植物生长调节物质作为一类能够显著高效调节植物细胞分化[3]、生长发育、抗逆性以及衰老过程的化学物质,可以作用于植物从种子发芽到幼苗生长、开花[4]、结实和成熟等整个生命周期[5]。水杨酸(SA)是一种植物体内产生的简单酚类物质,广泛存在于高等植物体内,已被认为是一种生长调节剂。多数研究结果表明,SA 在植物生长、发育、成熟、衰老及抗逆诱导等方面,具有广泛的生理作用。叶面喷施适当浓度的外源SA 有利于提高植株幼苗叶片抗氧化酶活性,促进游离脯氨酸、可溶性蛋白含量增加,减缓低温胁迫对植株幼苗造成的伤害[6]。同时,施以一定浓度的外源SA 可以显著降低植物叶片内丙二醛(MDA)含量,从而增加其叶片膜系统的稳定性,提高植物幼苗生长过程中的抗逆能力,达到促进植物生长发育的效果[7]。吲哚丁酸(IBA)是一种人工合成的植物生长调节剂,可促进植物细胞生长分裂,并提高植物的光合效率,增强抗氧化酶活性。IBA 处理对植株幼苗生长产生的影响,主要体现在其对幼苗高和地径生长的促进作用上[8]。在对一串红[9]、关苍术[10]、木薯[11]、牛膝[12]等的研究中还发现,适当浓度的IBA 能够有效提高植物体内叶绿素含量,从而促进植物的生长发育。除此之外,IBA也具有潜在的抗氧化能力,适当浓度的IBA 可以提高植株幼苗体内的超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和抗坏血酸过氧化物酶(APX)活性,降低植株体内MDA 含量,从而达到提高植物抗逆能力的效果[13]。
我国较多地区冬季气温低且气候干旱,植物在自然生长过程中容易受到冬季不良环境因子的影响,出现生长发育缓慢等现象[14]。为给山椒子的人工栽培及壮苗培育提供理论参考,文中分析了冬季喷施SA 和IBA 对山椒子幼苗的越冬生长及抗性生理的影响,筛选适宜的SA 和IBA浓度。
1 材料与方法
1.1 试验地概况
试验地位于广西南宁市广西大学林学院苗圃(108°17′28″E,22°51′09″N),年平均气温21.6 ℃,年均降雨量达1 304.2 mm。
1.2 试验材料
试验材料均由良凤江国家森林公园提供。选取长势一致、无病虫害的1年生山椒子幼苗作为研究对象,以10 cm×10 cm×15 cm 塑料育苗杯为栽培容器,以森林土、泥炭土、椰糠的混合物(质量比5∶3∶2)为育苗基质,森林土取自马尾松林下。
1.3 试验设计
采用完全随机设计,进行单因素多水平试验。分别于2018年12月23日、2019年1月8日 及2019年1月23日,使用生长调节剂SA 和IBA,共设置5 个质量浓度梯度(0、50、100、150、200 mg/L),对山椒子幼苗进行喷施处理,其中0 mg/L 为空白对照(CK)。每个处理设置3 个重复,每个重复5 株苗木。处理时,将溶液均匀喷施于叶片表面,喷施过程不宜过快,可分次进行,至叶面水滴欲滴即可,以便植株能够充分吸收。2019年3月23日,测定山椒子幼苗的生长和生理指标。
1.4 指标测定
使用钢卷尺测定山椒子幼苗高,使用游标卡尺测定幼苗地径。
采集山椒子幼苗第3 轮叶片,测定各生理指标。MDA 含量采用硫代巴比妥酸法测定[15],SOD活性采用氮蓝四唑(NBT)法测定[16],过氧化物酶(POD)活性采用愈创木酚法测定[17],CAT 和APX 活性采用紫外分光法测定[18],可溶性蛋白含量采用考马斯亮蓝染色法测定[19],叶绿素含量采用丙酮-乙醇提取法测定[20],游离脯氨酸含量采用茚三酮显色法测定[21]。
1.5 数据分析
使用Microsoft Excel、SPSS 软件进行数据统计分析,采用Duncan 法对不同质量浓度处理下山椒子幼苗的生长和生理指标进行差异显著性检验。
2 结果与分析
2.1 SA 和IBA 对山椒子幼苗生长的影响
不同质量浓度SA 和IBA 溶液处理下山椒子幼苗高如图1所示。从图1可以看出,不同质量浓度SA 和IBA 处理下,山椒子幼苗高有显著变化。随着SA 溶液质量浓度的增加,山椒子幼苗高呈先升后降的趋势。150 mg/L 的SA 溶液处理下,山椒子苗高的增幅达到最大,高出对照组43%。与SA 处理不同的是,随着IBA 溶液质量浓度的增加,山椒子幼苗高呈持续升高趋势,在200 mg/L 的IBA 溶液处理下苗高增幅最大,显著高出对照44%。
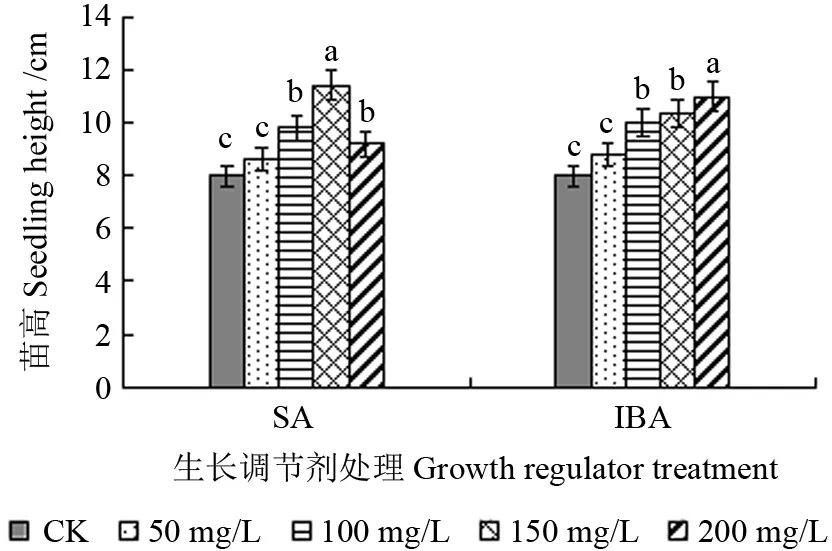
图1 不同质量浓度水杨酸(SA)和吲哚丁酸(IBA)溶液处理下山椒子幼苗高Fig.1 Height of U.grandiflora seedlings under different concentrations of SA and IBA treatments
不同质量浓度SA 和IBA 溶液处理下山椒子幼苗地径如图2所示。从图2可以看出,不同质量浓度SA 和IBA 溶液处理下,山椒子幼苗的地径有显著变化。随着SA 溶液质量浓度的增加,山椒子幼苗的地径呈先升后降的趋势。150 mg/L 的SA 溶液处理下,山椒子地径的增幅达到最大,高出对照组53%。与SA 处理不同的是,随着IBA溶液质量浓度的增加,山椒子幼苗地径呈先升后降的趋势,在100 mg/L 的IBA 溶液处理下达到最大,显著高出对照38%。

图2 不同质量浓度水杨酸(SA)和吲哚丁酸(IBA)溶液处理下山椒子幼苗地径Fig.2 Ground diameter of U.grandiflora seedlings under different concentrations of SA and IBA treatments
2.2 SA 和IBA 对山椒子幼苗叶片叶绿素含量的影响
不同质量浓度SA 和IBA 溶液处理下山椒子幼苗叶片叶绿素含量如图3所示。从图3可以看出,外源SA 和IBA 处理有利于山椒子幼苗叶片叶绿素含量的增加,均显著高于对照组,但随着SA 和IBA 溶液质量浓度增加,叶绿素含量均呈先升后降的趋势。叶片叶绿素含量在150 mg/L 的SA 溶液和100 mg/L 的IBA 溶液处理下达到最大,之后随生长调节剂质量浓度的增加呈下降趋势。由此可以看出,适宜质量浓度的SA 和IBA 溶液可以促进山椒子幼苗叶片叶绿素含量的升高,但过高质量浓度的SA、IBA 溶液处理对叶绿素合成有一定的抑制作用。
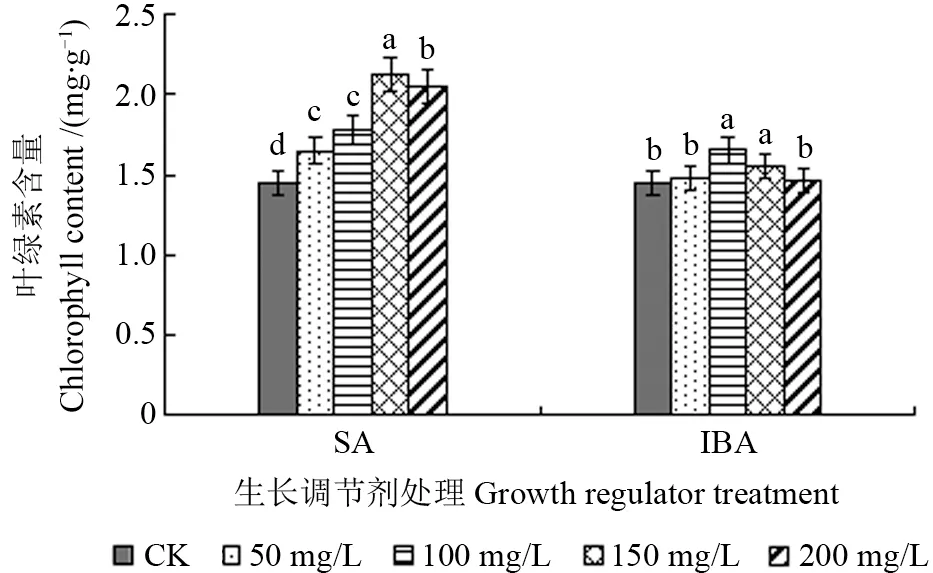
图3 不同质量浓度水杨酸(SA)和吲哚丁酸(IBA)溶液处理下山椒子幼苗叶片叶绿素含量Fig.3 Chlorophyll content of U.grandiflora seedlings under different concentrations of SA and IBA treatments
2.3 SA 和IBA 对山椒子幼苗叶片MDA 含量的影响
不同质量浓度SA 和IBA 溶液处理下山椒子幼苗叶片MDA 含量如图4所示。从图4可以看出,不同质量浓度的SA 和IBA 溶液均使山椒子幼苗叶片MDA 含量发生了显著变化。随着SA 和IBA 溶液质量浓度的增加,MDA 含量呈先降后升的趋势。其中,当SA 和IBA 溶液质量浓度分别为150、100 mg/L 时,MDA 含量最低,分别为对照组的61%和48%。适宜质量浓度的SA、IBA 溶液处理可以显著降低山椒子叶片的MDA 含量。

图4 不同质量浓度水杨酸(SA)和吲哚丁酸(IBA)溶液处理下山椒子幼苗叶片丙二醛含量Fig.4 MDA content of U.grandiflora seedlings under different concentrations of SA and IBA treatments
2.4 SA 和IBA 对山椒子幼苗叶片抗氧化酶活性的影响
不同质量浓度SA 和IBA 溶液处理下山椒子幼苗叶片抗氧化酶活性如图5所示。从图5可以看出,不同质量浓度SA 和IBA 溶液处理对山椒子幼苗叶片中抗氧化酶活性的变化具有显著影响,且随着SA 和IBA 质量浓度增加,SOD、CAT、APX、POD 的活性均呈现先升后降的趋势,但不同生长调节剂对不同抗氧化酶活性的影响程度有所不同。
从图5A 可以看出,SOD 活性在150 mg/L 的SA 溶液和100 mg/L 的IBA 溶液处理下达到最高,分别为对照组的164%和126%,而在50 mg/L 的SA 溶液和50 mg/L 的IBA 溶液处理下SOD 活性最小,且显著低于对照处理。
从图5B 可以看出,在100、150 mg/L 的SA溶液处理下CAT 活性均显著高于对照组,分别为对照组的129%和128%。在100 mg/L 的IBA溶液处理下,CAT 活性达到最大值,为对照组的127%。过高质量浓度(200 mg/L)和过低质量浓度(50 mg/L)的生长调节剂处理下,CAT 活性均与对照组无显著差异。
从图5C 可以看出,不同质量浓度的SA 和IBA 溶液处理下,APX 活性变化显著,且均在150 mg/L 质量浓度处理达到最大,分别达到相应对照的317%、347%,而在200 mg/L 的生长调节剂处理下,APX 活性显著下降。
从图5D 可以看出,不同质量浓度的SA 溶液处理间POD 活性变化幅度大于IBA 溶液的处理效果,分别在150 mg/L 的SA 溶液和100 mg/L 的IBA 溶液处理下,POD 活性达到最高。

图5 不同质量浓度水杨酸(SA)和吲哚丁酸(IBA)溶液处理下山椒子幼苗叶片抗氧化酶活性Fig.5 Antioxidant enzyme activities of U.grandiflora seedlings under different concentrations of SA and IBA treatments
2.5 SA 和IBA 对山椒子幼苗叶片游离脯氨酸含量的影响
不同质量浓度SA 和IBA 溶液处理下山椒子幼苗叶片游离脯氨酸的含量如图6所示。从图6可以看出,不同质量浓度的SA 和IBA 处理下,山椒子幼苗叶片游离脯氨酸含量均显著高于对照处理,且随着生长调节剂质量浓度的增加,游离脯氨酸含量呈先升后降的趋势。在150 mg/L 的SA溶液和100 mg/L 的IBA 溶液处理下,游离脯氨酸含量达到最大,分别为对照组的137%和142%。

图6 不同质量浓度水杨酸(SA)和吲哚丁酸(IBA)处理下山椒子幼苗叶片游离脯氨酸含量Fig.6 Free proline content of U.grandifolra seedlings under different concentrations of SA and IBA treatments
2.6 SA 和IBA 对山椒子幼苗可溶性蛋白含量的影响
不同质量浓度SA 和IBA 溶液处理下山椒子幼苗叶片可溶性蛋白含量如图7所示。从图7可以看出,SA 促进可溶性蛋白含量提高的作用显著大于IBA。不同质量浓度的SA 溶液处理下,可溶性蛋白含量均显著高于对照处理。在150 mg/L 的SA 溶液处理下,可溶性蛋白含量达到最高,为对照组的223%。除100 mg/L 的IBA 溶液处理外,其他质量浓度的IBA 溶液处理下可溶性蛋白含量与对照组差异均不显著。

图7 不同质量浓度水杨酸(SA)和吲哚丁酸(IBA)溶液处理下山椒子幼苗叶片可溶性蛋白含量Fig.7 Soluble protein content of U.grandifolra seedlings under different concentrations of SA and IBA treatments
3 结论与讨论
本研究结果表明,不同质量浓度的SA 和IBA溶液均能促进山椒子幼苗高和地径的增长,促进叶片叶绿素含量提高,促使叶片MDA 含量下降,促进叶片SOD、POD、CAT、APX 活性提高,促进叶片渗透调节物质游离脯氨酸、可溶性蛋白含量增加,以150 mg/L 的SA 溶液处理和100 mg/L的IBA 溶液处理对山椒子幼苗越冬生长和各生理指标的促进效果最为显著,其中150 mg/L 的SA溶液处理效果略优于100 mg/L 的IBA 溶液处理。在栽培山椒子时,可使用150 mg/L 的SA 溶液或100 mg/L 的IBA 溶液来调控苗木质量,从而提高山椒子的品质和产量及其抗逆能力。
苗高和地径是判断植物幼苗质量及其生长情况最直观且简易的指标。孙晓梅等[22]在使用IBA处理杂交落叶松时发现,100 mg/L 的IBA 溶液处理对落叶松幼苗高和地径生长的促进效果最佳。黄放等[23]经研究发现,适当质量浓度的SA 处理同样表现出对侧柏幼苗生长的显著促进作用。本研究结果表明,150 mg/L 的SA 溶液和100 mg/L的IBA 溶液处理对山椒子幼苗生长和叶片叶绿素含量的促进效果最明显。叶绿素是植物正常进行光合作用的重要色素,其含量会直接影响植物光合作用的水平,从而影响植物的生长状况[9,24]。150 mg/L 的SA 溶液和100 mg/L 的IBA 溶液处理可促进叶绿素合成,有利于光合产物的积累,从而有效促进山椒子的生长发育。
山椒子幼苗生长缓慢,一般培育2 a 左右才能进行栽培,在冬季提高其抵抗不良环境的能力是培育壮苗的重要措施。MDA 含量作为衡量植物受胁迫程度的重要指标,是植物细胞过氧化的产物,参与细胞中各种反应,降低细胞内各种酶的活性,损坏细胞膜系统。使用IBA 处理细叶云南松[25]、使用SA 处理丁香[26]均可使植株体内MDA 含量显著下降,提高其抗逆性,但不同植物种类所需生长调节剂的浓度略有不同。本研究结果表明,经150 mg/L 的SA 溶液和100 mg/L 的IBA 溶液处理后,山椒子幼苗叶片的MDA 含量显著下降,分别为对照组的61%和48%,这有助于减轻冬季较低温度条件下细胞膜脂的过氧化水平,降低低温对细胞造成的伤害。
当植物处于逆境时,其体内的活性氧代谢失调,活性氧的积累会对植物体内细胞的生命活动造成影响。植物可以通过诱导合成渗透调节物质(游离脯氨酸、可溶性蛋白),提高抗氧化酶(SOD、POD、CAT、APX)活性等来应对逆境,以此减轻逆境对植物的伤害。已有研究结果表明,施用SA和IBA 有利于提高植物的抗逆性[27-29]。本研究结果表明,适宜质量浓度的SA、IBA 溶液处理下,山椒子幼苗叶片中游离脯氨酸、可溶性蛋白含量均有显著提高,抗氧化酶活性显著增强,从而有利于清除细胞内有毒害作用的过氧化氢,并提高细胞膜的渗透能力,减轻植株所受的伤害。在150 mg/L 的SA 溶液和100 mg/L 的IBA 溶液处理下,山椒子幼苗叶片中SOD、POD、CAT、APX活性有显著提高,使山椒子幼苗在越冬环境下表现出良好的耐低温能力和生长效果。
本试验中主要对SA 和IBA 2 种生长调节剂进行了单因素研究,应对多种生长调节剂组合使用及其与冬季施肥协同作用下植物幼苗生长生理的响应效果进行更加深入的研究,也应进一步对喷施生长调节剂的山椒子幼苗在翌年春季复苏后的生长效果进行后续研究。
