吉西他滨增强HUVEC疫苗抗胰腺癌作用实验研究
2021-07-09赵晓雨徐茂磊
周 玲,杨 晨,高 艳,赵晓雨,徐茂磊
(1.滨州医学院药学院,山东 烟台 264003;2.山东国际生物科技园发展有限公司,山东 烟台 264670)
胰腺癌是消化道肿瘤中恶性程度极高的一种,其解剖位置的特殊性导致早期症状不明显、病情恶变快、预后极差,且在癌症早期就发生转移,80%的胰腺癌患者确诊时已失去手术切除的时机,所以胰腺癌的非手术治疗在延长胰腺癌患者生命、改善患者预后方面起着重要作用[1-2]。内科药物治疗是胰腺癌患者主要的非手术治疗手段,包括化疗和靶向治疗。然而,化疗药物毒副作用大,而现有的分子靶向药物如吉非替尼、厄洛替尼等很容易产生耐药,因此临床上亟需探索新的胰腺癌治疗药物。
随着肿瘤免疫学的发展及对肿瘤发生发展机理的不断深入认识,肿瘤疫苗已成为肿瘤免疫治疗的研究热点之一。肿瘤疫苗即利用肿瘤抗原,通过调节机体的免疫应答反应以抑止肿瘤的发生、发展,从而实现肿瘤治疗的目的[3]。我们前期对人脐静脉内皮细胞(human umbilical vein endothelial cell,HUVEC)疫苗进行了持续研究,证实HUVEC疫苗可以诱发特异性的靶向肿瘤新生血管的免疫应答,通过阻断血管新生可以产生良好的抗肿瘤效应。但跟其它抗原形式的肿瘤疫苗面临类似的问题,即HUVEC疫苗虽然在预防性免疫中显示了良好的抗肿瘤作用,但其在治疗性免疫中的抗肿瘤作用仍有待提升[4-7]。
吉西他滨(gemcitabine,GEM)是一种脱氧嘧啶类似物,可通过抑制细胞DNA的合成以发挥抗肿瘤作用,已广泛应用于胰腺癌、非小细胞肺癌等恶性肿瘤的临床治疗[8]。研究证实低剂量GEM可以降低细胞因子诱导的杀伤细胞(cytokine induced killer cells,CIK细胞)培养体系中CD4+CD25+调节性T细胞的比例,提高CIK细胞的抗肿瘤效应[9]。含有GEM的胰腺癌细胞培养基能有效刺激树突状细胞成熟,诱导T细胞增殖,诱发细胞毒性T淋巴细胞(cytotoxic lymphocyte,CTL)抗肿瘤免疫应答[10],这都提示我们小剂量GEM可以提升疫苗诱导的抗肿瘤免疫应答。在本实验中,我们将小剂量GEM引入HUVEC疫苗方案,以Pan02胰腺癌作为研究对象,考察小剂量GEM能否提升HUVEC疫苗在治疗性免疫中的抗胰腺癌作用,并研究可能的机制,为优化HUVEC疫苗临床治疗方案提供新思路。
1 材料与方法
1.1 材料
1.1.1动物和细胞株 ♂ C57BL/6小鼠,4-5周龄,购自济南朋悦实验动物有限公司,许可证号:SCXK(鲁)20190003,SPF级条件下饲养,符合滨州医学院伦理委员会认可;Pan02小鼠胰腺癌细胞购自中科院上海细胞库,使用含10%胎牛血清的RPMI 1640培养液,置于5% CO2培养箱于37 ℃条件下培养。HUVEC细胞购自美国ATCC细胞库,使用ECM内皮细胞专用培养基,置于5% CO2培养箱于37 ℃条件下培养。
1.1.2试剂 注射用盐酸吉西他滨购自江苏南京正大天晴制药有限公司(批准文号:国药准字H20093403);RPMI-1640培养基(货号:SH30809.01)、胰酶消化液(货号:SH30042.01)购自美国Hyclone公司;胎牛血清(货号:11011-8611)购自杭州四季青试剂有限公司;细胞培养用青/链霉素混合液(货号:P1400)、TMB单组分显色液(货号:PR1200),购自北京索莱宝科技有限公司;刀豆蛋白A(ConA,货号:C7642)购自美国Sigma公司;辣根过氧化物酶(HRP)标记兔抗小鼠IgG抗体(货号:ZB2305)购自北京中杉金桥生物科技有限公司;CytoTox96非放射性细胞毒性检测试剂盒(货号:G1780)购自美国Promega公司;小鼠IFN-γ检测试剂盒(货号:SEA049Ra)购自武汉云克隆科技股份有限公司;其它试剂均为市售。
1.2 实验方法
1.2.1荷瘤小鼠模型的建立及分组 将C57BL/6小鼠随机分为4组:PBS对照组,GEM组,HUVEC疫苗组和GEM与HUVEC疫苗联合(HUVEC-GEM)组。收集对数生长期的Pan02小鼠胰腺癌细胞,调整细胞浓度为5×109个·L-1,于小鼠左肋皮下接种0.1 mL(接种量为5×105细胞/小鼠)。在接种后的d 2、8、14皮下注射0.1 mL HUVEC疫苗(含1×106HUVEC),吉西他滨组于肿瘤接种后d 1、7、13腹腔注射100 μL GEM,使用剂量为30 mg·kg-1,HUVEC-GEM组腹腔注射100 μL GEM并且皮下注射100 μL的HUVEC疫苗,阴性对照组皮下注射100 μL PBS。待肿瘤成瘤后隔天用游标卡尺测量肿瘤长径和宽径,肿瘤体积按V=0.52×长径×宽径2计算,接种肿瘤后的d 18处死所有小鼠,剥取肿瘤并称重,计算抑瘤率,抑瘤率/%=(1-实验组平均瘤质量/对照组平均瘤质量)×100%,并将剖取的肿瘤组织切片,HE染色后作病理分析。各组小鼠处死前眼眦静脉丛取血分离血清,-80 ℃保存备用。在实验过程中,观察小鼠的日常行为活动、毛发以及饮食情况等,并每周称量小鼠体质量,以评估小鼠整体健康状况。
1.2.2免疫血清中HUVEC抗体检测 用反复冻融的HUVEC裂解物作为包被抗原,将其溶解在pH 9.6碳酸盐缓冲液中,以100 μL/孔加入96孔酶标板,置于4 ℃冰箱中过夜。使用PBST洗涤3次,每孔加入100 μL 1 ∶50倍稀释的免疫血清,37 ℃孵育2 h,PBST洗涤3次,每孔加入1 ∶10 000倍稀释的HRP标记的兔抗小鼠IgG二抗,37 ℃孵育1 h,使用TMB显色液室温避光显色20 min,用4 mol·L-1硫酸终止反应,酶标仪读取450 nm波长下吸光度值。
1.2.3淋巴细胞增殖实验 按治疗性免疫程序免疫小鼠,第三次免疫结束后7 d,脱颈处死各组小鼠,无菌分离小鼠脾脏,研磨过200目筛网,PBS洗涤重悬,加入等量的红细胞裂解液裂解红细胞,离心取沉淀,用含10%胎牛血清的RPMI 1640培养液重悬细胞,调整细胞浓度为1×1010·L-1,于96孔细胞培养板接种,每孔接种100 μL(1×105细胞),每组脾细胞中分别加入空白1640培养基、5 mg·L-1ConA、100 mg·L-1的HUVEC裂解物,每个样品设置4个复孔。于37 ℃ CO2培养箱中培养48 h后,每孔加入10 μL的CCK8溶液,避光孵育1-2 h,酶标仪读取450 nm波长下吸光度值。
1.2.4CTL杀伤活性实验 脾淋巴细胞悬液制备同1.2.3部分,使用美国Promega公司CytoTox96非放射性细胞毒性检测试剂盒检测CTL细胞杀伤活性。各组小鼠脾淋巴细胞经HUVEC裂解物刺激2 d后作为效应细胞使用,取对数生长期的HUVEC细胞和Pan02细胞作为靶细胞。按照200 ∶1,100 ∶1,50 ∶1,25 ∶1的效靶比将脾淋巴细胞和HUVEC或Pan02细胞共培养于96孔U型细胞培养板中,并设置相应的效应细胞和靶细胞对照组,37 ℃共孵育4 h,吸取50 μL培养上清至96孔平底细胞培养板中,加入50 μL检测试剂,室温避光孵育30 min,每孔加入50 μL终止液,酶标仪读取490 nm波长下吸光度值,释放率按下列公式计算:释放率/%=(实验组OD490-效应细胞自发OD490-靶细胞自发OD490)/(靶细胞最大OD490-靶细胞自发OD490)×100%。
1.2.5小鼠血清中IFN-γ检测 按治疗性免疫程序免疫小鼠,第三次免疫结束后7 d,眼眦静脉丛取血分离各组血清,按照小鼠IFN-γ ELISA检测试剂盒说明书检测各组小鼠血清中IFN-γ水平。
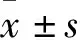
2 结果
2.1 GEM增强HUVEC疫苗抗胰腺癌作用如Fig 1所示,PBS组小鼠肿瘤生长迅速,肿瘤生长曲线较陡直,HUVEC、GEM及HUVEC-GEM治疗均在一定程度上延缓了肿瘤生长,其中HUVEC-GEM治疗抑制肿瘤生长的作用最显著。接种Pan02胰腺癌细胞18 d后PBS组肿瘤体积达到(1321.12±398.12)mm3,GEM、HUVEC和GEM+HUVEC组肿瘤体积分别为(1 058.52±327.08)mm3、(892.19±287.52)mm3及(575.33±128.37)mm3。实验结束后剖取的肿瘤瘤重结果与肿瘤体积结果一致,HUVEC-GEM组平均瘤质量明显低于HUVEC组及GEM单药组(P<0.05vsHUVEC,P<0.01vsGEM),各组瘤质量分别为PBS:(1.01±0.11)g,GEM:(0.84±0.12)g,HUVEC:(0.65±0.17)g,HUVEC-GEM:(0.44±0.10)g。以上实验结果显示GEM的引入增强了HUVEC疫苗的抗肿瘤生长作用。
2.2 GEM增强HUVEC疫苗诱导的肿瘤细胞坏死为进一步研究GEM增强HUVEC疫苗的抗胰腺癌药效学,我们对剖取的肿瘤进行切片后HE染色分析,光学显微镜下观察染色切片。实验结果如Fig 2所示,PBS组肿瘤细胞生长活跃,细胞结构较完整,未发现明显的坏死及炎症细胞浸润。GEM、HUVEC及HUVEC-GEM组均出现了一定程度的细胞坏死,伴随核固缩或溶解,其中HUVEC-GEM组肿瘤细胞坏死情况最明显,可见较大面积细胞坏死(坏死区域如箭头所示),这说明GEM增强了HUVEC疫苗诱导的肿瘤细胞坏死。
2.3 GEM增强HUVEC疫苗诱导的抗体水平采用ELISA检测各组治疗方案诱导产生的抗体水平,实验结果如Fig 3所示,HUVEC及HUVEC-GEM组小鼠免疫血清中抗体水平有一定程度的上升,而GEM组未有HUVEC抗体产生。与HUVEC组比较,HUVEC-GEM组抗体水平也有上升(P<0.01),这说明低剂量的GEM引入HUVEC疫苗后,不会对小鼠免疫系统产生抑制,反而在一定程度上会提升HUVEC疫苗诱导的体液免疫应答水平。

Fig 1 Therapeutic antitumor effect induced by GEM and HUVEC vaccine in subcutaneous pancreatic cancer-bearing mice n=3)

Fig 2 Histopathology study of tumor tissues (200×)
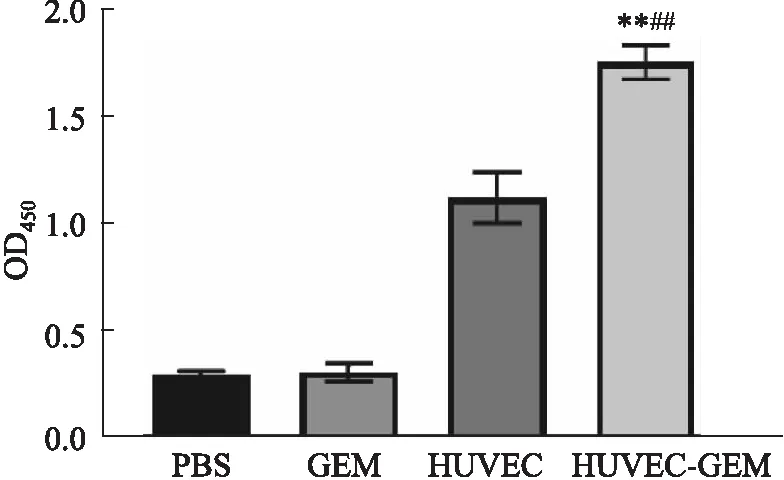
Fig 3 Detection of anti-HUVEC humoral immune responses
2.4 GEM增强HUVEC疫苗诱导的淋巴细胞增殖活性采用淋巴细胞增殖实验检测各组治疗方案诱导的细胞免疫应答强度,如Fig 4所示,PBS对照组与GEM组淋巴细胞未显示明显的增殖活性,而HUVEC和HUVEC-GEM组淋巴细胞均显示了一定的增殖活性,其中HUVEC-GEM给药组淋巴细胞增殖活性最明显,与HUVEC组差异有统计学意义(P<0.01),这说明低剂量GEM可以增强HUVEC疫苗诱导的淋巴细胞增殖活性。
2.5 GEM增强HUVEC疫苗诱导的CTL细胞杀伤活性我们进一步使用美国Promega公司CytoTox96细胞毒性检测试剂盒检测各组治疗方案诱导的CTL细胞杀伤活性。如Fig 5所示,随着E ∶T比值的增大,HUVEC及HUVEC-GEM组效应细胞对靶细胞的杀伤活性逐渐增高,其中HUVEC-GEM组杀伤活性最高(P<0.05vsHUVEC)。HUVEC-GEM组小鼠脾细胞在E ∶T为50 ∶1、100 ∶1及200 ∶1时均高于HUVEC组,而PBS和GEM组小鼠脾淋巴细胞对HUVEC细胞无杀伤功能。当靶细胞为Pan02细胞时,所有组淋巴细胞未显示杀伤活性,这说明疫苗诱导的CTL杀伤活性是HUVEC特异的。

Fig 4 Effect of different treatment on lymphocyte proliferation n=4)

Fig 5 Level of CTLs induced by different treatment n=4)
2.6 GEM增强HUVEC疫苗诱导的免疫血清IFN-γ含量采用ELISA检测试剂盒检测各组小鼠免疫血清中IFN-γ含量,实验结果如Fig 6所示,HUVEC组[(158.33±9.51)ng·L-1]和HUVEC-GEM组[(225.32±11.99)ng·L-1]IFN-γ含量都有所升高,GEM单药组免疫血清中未检测到IFN-γ;此外,HUVEC-GEM治疗后小鼠免疫血清中IFN-γ含量也远高于HUVEC组,差异有统计学意义(P<0.01),以上结果均表明低剂量GEM可以增强HUVEC疫苗诱导的细胞免疫应答强度。

Fig 6 Detection of INF-γ content of immune sera n=3)
3 讨论
随着医学免疫学等学科的迅猛发展及对肿瘤微环境的不断认识,肿瘤免疫治疗得到了更深入系统的研究。本论文所研究的HUVEC疫苗是一种靶向肿瘤新生血管的主动免疫治疗策略,可以依靠有限次数的治疗诱导机体产生持续的免疫反应,抑制肿瘤血管的生成,拮抗肿瘤细胞的生长和转移,能够克服单克隆抗体等传统血管生成抑制剂类药物用药频繁,毒副作用大,患者用药负担重的缺点[11]。在我们前期研究中发现HUVEC疫苗在预防性免疫中抗肿瘤作用明显,但该疫苗在治疗性免疫中的抗肿瘤药效并不能完全令人满意,故而提升HUVEC疫苗的治疗性抗肿瘤药效是疫苗研发中的重要问题。
肿瘤抗原特异性CTL细胞是起主要杀伤作用的效应细胞,如何诱导机体产生有效的CTL免疫应答反应是肿瘤疫苗研发中的关键技术。自上世纪80年代研究人员发现低剂量环磷酰胺不仅不会产生免疫制剂作用,反而可以增加抗肿瘤免疫反应以来,化疗药的免疫激活作用引起了研究人员的兴趣。大量研究已证实持续节拍性非治疗剂量化疗药能发挥免疫调节作用,可以协助肿瘤疫苗诱导更有效的CTL免疫应答,提升疫苗的抗肿瘤药效[12-14]。本论文中所考察的化疗药物GEM是胰腺癌一线化疗药物,临床上已应用多年,安全性有保障。本研究中,我们将其引入HUVEC疫苗,考察非治疗剂量的GEM能否提升HUVEC疫苗在治疗性免疫中的抗肿瘤作用,并以此为例探讨非治疗剂量化疗药增强HUVEC疫苗抗肿瘤作用的可能机制。
实验结果表明,低剂量GEM引入HUVEC疫苗免疫方案后,可以有效提升HUVEC疫苗的治疗性抗胰腺癌作用,HUVEC-GEM组在治疗性免疫中的抑瘤率可以达到56.44%;GEM的引入可以协助HUVEC疫苗有效改善荷瘤小鼠的肿瘤微环境,肿瘤组织HE染色结果证实HUVEC-GEM组出现了更多的肿瘤细胞坏死及炎性细胞浸润;GEM引入后,协助HUVEC疫苗更有效的激活了B淋巴细胞,在经过2、8及14 d 3次免疫后,HUVEC-GEM组小鼠免疫血清中产生了高水平的HUVEC-抗体;HUVEC-GEM组小鼠的T细胞应答水平也明显高于其它各治疗组,说明GEM也增强了HUVEC疫苗激活肿瘤抗原特异性T细胞反应的能力,提升了HUVEC疫苗的特异性CTL杀伤活性;给药过程中观察各组小鼠证实HUVEC-GEM治疗方案的毒副作用较单一给药组并没有明显增加,实验小鼠的耐受性良好。综上所述,本实验的结果证实低剂量GEM作为免疫佐剂能增强HUVEC疫苗诱导的免疫应答强度,提升HUVEC疫苗在治疗性免疫中的抗肿瘤药效,本研究为HUVEC疫苗临床治疗方案提供了新选择,有潜在巨大的临床应用价值。
