基于Ras/ERK信号通路益肾通癃汤对人前列腺癌 PC-3细胞增殖、凋亡、侵袭及迁移的影响
2021-07-09刘德果李姿蓉陈其华赵姣杨磊李博向时竹林梦姣
刘德果,李姿蓉,陈其华,赵姣,杨磊,李博,向时竹,林梦姣
1.湖南中医药大学,湖南 长沙 410207; 2.湖南中医药大学第一附属医院,湖南 长沙 410008
前列腺癌早期症状相对隐匿,缺少特征性临床表现,多数被确诊的患者已是肿瘤中晚期阶段,失去手术治疗的机会,只能采用内分泌及化疗手段治疗。前列腺癌发病机制至今仍未完全明确,前列腺癌细胞的增殖、凋亡、侵袭、迁移等生物学过程受到诸多基因的调控与影响[1]。因此,研究相关基因对前列腺癌细胞生物学过程的作用机制将给本病的防治提供确切有效的治疗靶点。研究发现,Ras/ERK信号通路是调控前列腺癌细胞增殖、凋亡、侵袭、迁移等生物学过程的关键通路[2]。Semenchenko等[3]研究表明,在前列腺癌组织中Ras致癌突变表达水平较正常前列腺组织显著升高,且Ras致癌突变高表达患者更易于发生远处转移。临床及基础研究表明,中医药在改善前列腺癌具体临床症状、延缓内分泌耐受、改善生活质量、调护心理健康等方面有较好的疗效[4-5]。益肾通癃汤是湖南中医药大学第一附属医院治疗前列腺癌的经验方,近20年临床应用表明,其能明显缓解前列腺癌患者排尿困难、食欲减低、乏力等临床症状,明显提高患者生活质量,降低炎性相关指标水平,并对化疗药物起到减毒增效的作用[6],但其具体机制仍需进一步探讨。本研究以人前列腺癌PC-3细胞为研究对象,从Ras/ERK信号通路调控角度探讨益肾通癃汤对PC-3细胞增殖、凋亡、侵袭及迁移的影响。
1 实验材料
1.1 细胞
人前列腺癌PC-3细胞株,购于中国医学科学院肿瘤细胞库(目录号TCHu158)。
1.2 动物
选取SPF级雄性SD大鼠30只进行药物血清制备,体质量180~220g,购于湖南斯莱克景达实验动物有限公司,动物使用许可证号SYXK(湘)2019-0009,生产许可证号SCXK(湘)2019-0004。饲养于湖南中医药大学动物实验中心SPF级动物房,温度21~25 ℃,相对湿度40%~70%,每日按时喂养。
1.3 药物
益肾通癃汤(补骨脂15g,熟地黄15g,黄芪30g,三棱10g,莪术10 g),饮片购于湖南中医药大学第一附属医院中药房,均为超微中药,本院制剂室根据临床等效剂量[7]水煎浓缩后制成膏剂,其终浓度为含原药材1.44 g/mL,置于无菌棕色瓶,4 ℃冰箱保存备用。
1.4 主要试剂与仪器
RPMI 1640细胞培养基,美国Gibco公司,批号8120357;胎牛血清,美国Gibco公司,批号42G3099K;CCK-8试剂盒,日本Dojindo公司,批号JP198233;Annexin V-FITC/PI凋亡检测试剂盒,日本Dojindo公司,批号VN833;RIPA裂解液,美国赛默飞世尔公司,批号33454712;BCA蛋白浓度测定试剂盒,美国赛默飞世尔公司,批号YP195441;溴化乙锭,美国赛默飞世尔公司,批号CC3348574;RNase A,美国赛默飞世尔公司,批号LD45845;PVDF膜,Millipore公司,批号K8A4571;锌指转录因子(Snail)、Ras、细胞外调节蛋白激酶1/2(ERK1/2)、p-ERK1/2、E-钙黏蛋白(E-cadherin)、N-钙黏蛋白(N-cadherin)、基质金属蛋白酶-9(MMP-9)抗体,美国赛默飞世尔公司,货号分别为10H8L11、Thr185、5AD13MA、6D2、CDH1、8C11、IIA5。超净工作台(苏州安泰空气技术有限公司,型号SW-CJ-2FD),CO2细胞培养箱(日本Panasonic公司,型号MCO-20AIC),酶标仪(美国MD公司,型号SpectraMax i3),电子显微镜(日本Olympus公司,型号TH4-200),流式细胞仪(美国BD公司,型号LSRⅡ)。
2 实验方法
2.1 药物血清制备
实验大鼠适应性喂养3 d,按随机数字表法分为空白血清组和药物血清组。将益肾通癃汤膏剂加入蒸馏水,益肾通癃汤膏低(0.36 g/mL)、中(0.72 g/mL)、高剂量(1.44 g/mL)组予相应剂量药液灌胃,空白血清组大鼠予等体积生理盐水灌胃。早晚各1次,连续7 d。末次给药后1 h,腹腔注射10%水合氯醛麻醉,腹主动脉取血,静置2 h,离心,过滤,灭活,吸取上清液,即为药物血清或空白血清。同时细胞毒性实验显示,PC-3细胞最大耐受剂量为14.5 g/(mL•d),故本研究给药剂量并未影响本实验结果。
2.2 细胞培养及分组
PC-3细胞置于37 ℃、5%CO2培养箱,用含10%胎牛血清、1%双抗的RPMI 1640培养基培养。培养48~72 h,0.25%胰酶消化传代,取对数生长期细胞用于后续实验。将PC-3细胞分为空白血清组、益肾通癃汤含药血清高、中、低剂量组(益肾通癃汤高、中、低剂量组),空白血清组予空白血清干预,益肾通癃汤高、中、低剂量组分别予高、中、低剂量益肾通癃汤含药血清干预。48 h后进行相关检测,细胞抑制率检测时间点为24 h及48 h。
2.3 细胞增殖检测
采用CCK8法检测PC-3细胞增殖,计算细胞抑制率。细胞抑制率(%)=(1-实验组吸光度值÷对照组吸光度值)×100%。
2.4 细胞凋亡检测
采用Annexin V-FITC/PI双染色法检测细胞凋亡。收集PC-3细胞,洗涤后以标记液重悬细胞,25 ℃避光孵育15 min。1500r/min离心15 min,取细胞沉淀加荧光(SA-Flous)溶液,低温孵育15 min。按照标准程序使用流式细胞仪检测,结果用ModFit LT软件进行处理。
2.5 细胞侵袭、迁移检测
采用Transwell小室法检测PC-3细胞侵袭及迁移。制备Transwell小室,加基础培养基及Matergel,37 ℃水化基底膜。将PC-3细胞制成密度为1×105个/mL的细胞悬液,吸取适量悬液加至上室,下室加含10%FBS完全培养基,避光孵育24 h;洗净后用甲醇固定30 min,0.5%结晶紫染色5 min,镜下观察并拍照。细胞迁移实验同侵袭实验,无Matergel包被步骤。
2.6 Western blot检测相关蛋白表达
提取PC-3细胞蛋白,高速离心15 min,吸取上清液,BCA法检测蛋白浓度。电泳后转至PVDF膜,加5%胎牛血清白蛋白,37 ℃封闭1.5 h,洗膜后加Snail、Ras、p-ERK1/2、ERK1/2、E-cadherin、N-cadherin、MMP-9一抗,4 ℃孵育过夜。次日加二抗37 ℃孵育1.5 h,显影,结果运用Image Lab软件进行处理,以GAPDH为内参,计算目的蛋白表达量。
2.7 RT-PCR检测相关蛋白mRNA表达
收集PC-3细胞,提取总RNA,并测定其浓度,根据试剂盒说明书进行操作。经浓度及纯度检测后,根据试剂盒说明书合成cDNA,并以β-actin为内参,SYBR Green PCR试剂盒扩增Ras、ERK1、E-cadherin、N-cadherin,每组设置3个复孔,以相对定量2-ΔΔCt法分析基因相对表达量。
3 统计学方法
采用SPSS22.0统计软件进行分析。实验数据以±s表示,组间比较用方差分析。P<0.05表示差异有统计学意义。
4 结果
4.1 益肾通癃汤药物血清对PC-3细胞增殖的影响
与空白血清组比较,益肾通癃汤高、中、低剂量组可显著抑制PC-3细胞增殖,降低其贴壁生长能力(P<0.01),并呈剂量依赖性,除益肾通癃汤低剂量组外,随着作用时间延长,抑制率有所增加。见图1。

图1 各组PC-3细胞不同时点细胞抑制率比较(±s,n=3)
4.2 益肾通癃汤药物血清对PC-3细胞凋亡的影响
与空白血清组比较,益肾通癃汤高、中、低剂量组均可显著促进PC-3细胞凋亡(P<0.05),并呈剂量依赖性。见图2。
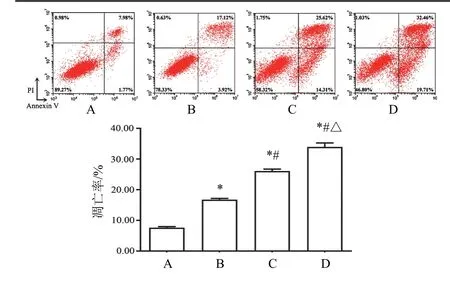
图2 各组PC-3细胞凋亡比较(±s,n=3)
4.3 益肾通癃汤药物血清对PC-3细胞侵袭、迁移的影响
与空白血清组比较,益肾通癃汤高、中、低剂量组可显著降低PC-3细胞体外侵袭、迁移能力(P<0.05),并呈剂量依赖性。见图3、图4。
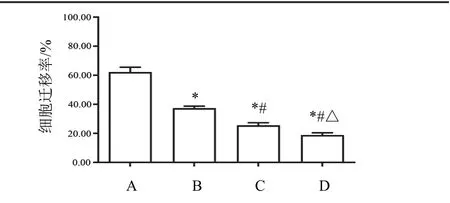
图4 各组PC-3细胞迁移能力比较(±s,n=3)
4.4 益肾通癃汤对PC-3细胞蛋白表达的影响
与空白血清组比较,益肾通癃汤高、中、低剂量组PC-3细胞Snail、Ras、p-ERK1/2、ERK1/2、N-cadherin、MMP-9蛋白表达均下调,E-cadherin蛋白表达明显上调(P<0.05,P<0.01)。见图5、表1。
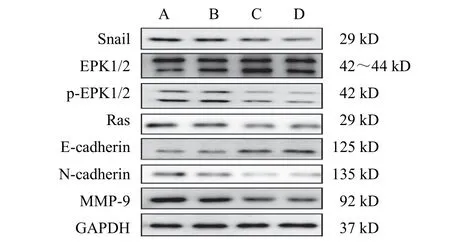
图5 各组PC-3细胞蛋白免疫印迹图
表1 各组PC-3细胞Snail、ERK1/2、p-ERK1/2、Ras、E-cadherin、N-cadherin、MMP-9蛋白表达比较(±s)
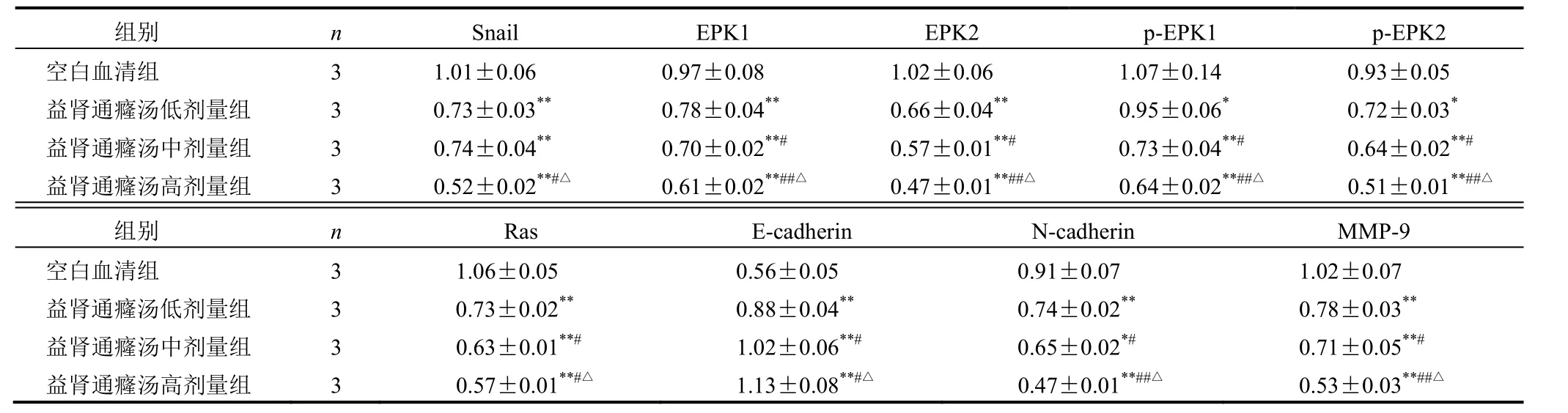
表1 各组PC-3细胞Snail、ERK1/2、p-ERK1/2、Ras、E-cadherin、N-cadherin、MMP-9蛋白表达比较(±s)
注:与空白血清组比较,*P<0.05,**P<0.01;与益肾通癃汤低剂量组比较,#P<0.05,##P<0.01;与益肾通癃汤中剂量组比较,△P<0.05
组别 n Snail EPK1 EPK2 p-EPK1 p-EPK2 空白血清组 3 1.01±0.06 0.97±0.08 1.02±0.06 1.07±0.14 0.93±0.05 益肾通癃汤低剂量组 3 0.73±0.03** 0.78±0.04** 0.66±0.04** 0.95±0.06* 0.72±0.03* 益肾通癃汤中剂量组 3 0.74±0.04** 0.70±0.02**# 0.57±0.01**# 0.73±0.04**# 0.64±0.02**# 益肾通癃汤高剂量组 3 0.52±0.02**#△ 0.61±0.02**##△ 0.47±0.01**##△ 0.64±0.02**##△ 0.51±0.01**##△ 组别 n Ras E-cadherin N-cadherin MMP-9 空白血清组 3 1.06±0.05 0.56±0.05 0.91±0.07 1.02±0.07 益肾通癃汤低剂量组 3 0.73±0.02** 0.88±0.04** 0.74±0.02** 0.78±0.03** 益肾通癃汤中剂量组 3 0.63±0.01**# 1.02±0.06**# 0.65±0.02*# 0.71±0.05**# 益肾通癃汤高剂量组 3 0.57±0.01**#△ 1.13±0.08**#△ 0.47±0.01**##△ 0.53±0.03**##△
4.5 益肾通癃汤对PC-3细胞mRNA表达的影响
与空白血清组比较,益肾通癃汤低、中、高剂量组PC-3细胞Ras、ERK1、N-cadherin mRNA表达显著下调,差异有统计学意义(P<0.05,P<0.01);益肾通癃汤高、中剂量组PC-3细胞E-cadherin mRNA表达显著上调,差异有统计学意义(P<0.01,P<0.05);益肾通癃汤低剂量组PC-3细胞E-cadherin mRNA表达变化不明显,差异无统计学意义(P>0.05)。见表2。
表2 各组PC-3细胞Ras、ERK1、E-cadherin、N-cadherin mRNA表达比较(±s)
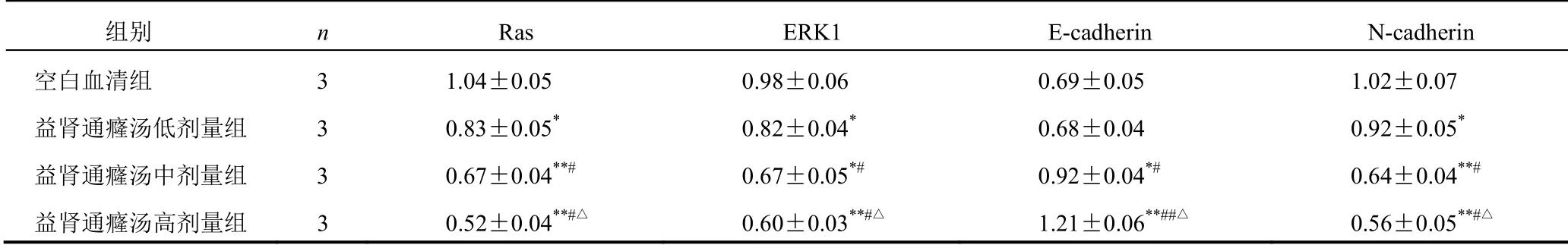
表2 各组PC-3细胞Ras、ERK1、E-cadherin、N-cadherin mRNA表达比较(±s)
注:与空白血清组比较,*P<0.05,**P<0.01;与益肾通癃汤低剂量组比较,#P<0.05,##P<0.01;与益肾通癃汤中剂量组比较,△P<0.05
组别 n Ras ERK1 E-cadherin N-cadherin 空白血清组 3 1.04±0.05 0.98±0.06 0.69±0.05 1.02±0.07 益肾通癃汤低剂量组 3 0.83±0.05* 0.82±0.04* 0.68±0.04 0.92±0.05* 益肾通癃汤中剂量组 3 0.67±0.04**# 0.67±0.05*# 0.92±0.04*# 0.64±0.04**# 益肾通癃汤高剂量组 3 0.52±0.04**#△ 0.60±0.03**#△ 1.21±0.06**##△ 0.56±0.05**#△
5 讨论
根据临床表现,前列腺癌属中医学“癥瘕”“积聚”“癃闭”等范畴。全国名中医陈其华教授认为阴阳失调是前列腺癌发生的基本病机,阳虚阴结是对前列腺癌病机的高度概括,机体阳气虚衰,脏腑功能失调,正气无力抗邪,各类病理产物如瘀血、痰浊、湿阻、癌毒等阻滞气机,气血不行,胶结于下焦精室,终致本病发生。前列腺癌多为本虚标实之证,往往以阳气亏虚为本,瘀毒久积、邪郁下焦为标,虚、毒、瘀夹杂,以虚为主。益肾通癃汤方中补骨脂温肾助阳、固精缩尿、补益精血,激发肾中阳气。现代药理研究表明,补骨脂具有提升免疫、抗氧化、抗肿瘤作用,其化学成分补骨脂定及补骨脂素能显著抑制癌细胞增殖、侵袭、转移[8-9];熟地黄补血养阴、填精益髓,为补益精血之要药,同时熟地黄与补骨脂阴阳相得,互为补充;黄芪益气升阳,为补气要药,气行则血行,使瘀滞得散,阴寒、痰浊、瘀毒更无滞停之处,则“阴结”之癌瘤自消;三棱、莪术为攻积除坚经典药对,癌毒留恋络脉,血瘀、痰浊、寒凝等胶结积聚,三棱、莪术为化瘀散结通络要药。全方攻补兼施,诸药合用,共达阴阳双补、抗癌解毒、化痰散瘀之功。
本课题组前期临床研究显示,益肾通癃汤能有效治疗前列腺癌[6]。Moore等[10]研究表明,恶性肿瘤的发病、侵袭、转移等生物学过程均与众多细胞内信号通路异常激活相关,此类信号通路异常激活造成的细胞增殖、细胞周期、凋亡、迁移、侵袭等生物学过程异常是恶性肿瘤发生的标志性特征之一。Ras/ERK信号通路目前被发现在真核细胞中广泛存在,其主要功能是调控组织细胞的终末分化、分裂增殖、周期、凋亡、侵袭及转移等生物学行为[11]。研究显示,Ras/ERK信号通路在肺癌、前列腺癌、乳腺癌、口腔癌等多类恶性肿瘤的发生、发展及侵袭转移进程中扮演重要角色[12]。在Ras/ERK信号通路中,Ras蛋白是原癌基因c-ras的表达产物,也是恶性肿瘤发生过程中最常见的突变蛋白;ERK蛋白是Ras/ERK信号通路下游的关键蛋白,ERK被激活后经细胞内环境运送至细胞核,对细胞内诸多信号通路的重要因子进行激活或灭活,调控相应的关键靶基因转录,使相关蛋白表达或活性异常,最终推进相应基因表观修饰异常,导致细胞增殖及恶性转化[13]。Ngalame等[14]在前列腺癌组织中发现Ras/ERK信号通路异常激活,其通过激活该信号通路下游转录因子,促进细胞过度增殖,导致前列腺癌发生。
此外,Wang等[15]认为,前列腺癌细胞增殖、侵袭及迁移是前列腺癌发生发展的病理基础,而上皮间质转化(EMT)是前列腺癌发生及远处转移的必经过程。Qiu等[16]研究显示,Ras/ERK信号通路与EMT密切相关。Cai等[17]研究表明,前列腺癌细胞EMT一旦激活,其肿瘤细胞各种恶性生物学行为明显提升,并调控前列腺癌发展,该过程中E-cadherin扮演关键性角色,而N-cadherin则与之相反。Snail是前列腺癌发生发展及EMT过程中的主要调节因子,其通过调节E-cadherin表达推进EMT过程[18]。MMP-9是关键细胞外基质蛋白水解酶,其可直接调控恶性肿瘤的发生、侵袭及转移进程,也可通过水解细胞外基质,调控细胞黏附及肿瘤微小血管生成,在癌性浸润进程中起关键作用。
本研究结果显示,益肾通癃方能有效抑制前列腺癌细胞增殖,促进其凋亡,并能降低前列腺癌细胞侵袭及迁移能力。同时益肾通癃汤各剂量均可下调Snail、Ras、p-ERK1/2、ERK1/2、N-cadherin、MMP-9蛋白的表达,上调E-cadherin表达,降低Ras、ERK1、N-cadherin mRNA的表达,上调E-cadherin mRNA的表达,提示益肾通癃汤治疗前列腺癌的作用机制可能与其抑制前列腺癌EMT进程,调控Ras/ERK信号通路活化有关。但益肾通癃汤抑制前列腺癌细胞增殖及侵袭、促进其凋亡是直接还是间接通过Ras/ERK信号通路,抑制前列腺癌EMT是否还存在其他关键细胞内信号通路,仍需今后进一步深入研究。
