从调节Cajal细胞自噬探讨芍药甘草汤改善Oddi括约肌功能障碍的机制
2021-07-08李甫陈萌吉建梅张晞文丁俊黄金鑫唐睿蔡淦
李甫 陈萌 吉建梅 张晞文 丁俊 黄金鑫 唐睿 蔡淦
摘要 基于芍藥甘草汤具有显著改善Oddi括约肌功能障碍(SOD)患者腹痛的临床疗效和抑制自噬相关蛋白(GPR78、Beclin1)的工作基础,结合Cajal间质细胞(ICC)过度自噬将引起平滑肌收缩紊乱、进一步导致SOD的研究进展,探讨芍药甘草汤调节ICC自噬水平及治疗SOD的分子药理机制。首先,复制豚鼠SOD模型,观察芍药甘草汤对Oddi括约肌压力、ICC自噬水平的影响;其次,吗啡刺激诱导离体SOD模型,观察芍药甘草汤对Oddi括约肌肌条收缩曲线、自噬通路的影响;最后,分离原代ICC、构建IRE1基因沉默或过表达载体、衣霉素刺激ICC建立内质网应激模型,予不同浓度的芍药甘草汤孵育,观察ICC内质网应激水平、自噬信号通路的变化。最终验证“芍药甘草汤抑制IRE1/Beclin1信号通路,减轻ICC内质网应激引起的过度自噬,从而改善SOD平滑肌舒张效应”的科学假说,为推进中医药调节胆道动力学的理论研究夯实基础。
关键词 芍药甘草汤;Oddi括约肌功能障碍;Cajal间质细胞;细胞自噬;IRE1/Beclin1通路
Study on the Mechanism of Shaoyao Gancao Decoction on Improving Sphincter Dysfunction
of Oddi by Regulating Autophagy of Interstitial Cells of Cajal
LI Fu, Chen Meng, JI Jianmei, ZHANG Xiwen, DING Jun, HUANG Jinxin, TANG Rui, CAI Gan
(Shuguang Hospital Affiliated to Shanghai University of Traditional Chinese Medicine, Shanghai 201203, China)
Abstract Based on the clinical effect of Shaoyao Gancao Decoction on abdominal pain of Sphincter of Oddi dysfunction (SOD) patients and the work basis of inhibiting autophagy related proteins (GPR78,Beclin1), combined with the research progress that Cajal interstitial cells (ICC) over autophagy will cause smooth muscle contraction disorder and further lead to SOD research development, to explore the molecular pharmacological mechanism of Shaoyao Gancao Decoction on regulating the level of ICC autophagy and treating SOD. Firstly, the SOD model of guinea pig was duplicated, and the effects of Shaoyao Gancao Decoction on Oddi sphincter pressure and ICC autophagy level was observed; secondly, morphine stimulation induced SOD model in vitro, and the effects of Shaoyao Gancao Decoction on Oddi sphincter contraction curve and autophagy signal pathway of Oddi was observed; finally, we isolated the primary ICC, constructed the silencing or overexpression vector of IRE1 gene, and stimulated ICC by tunicamycin to establish the endoplasmic reticulum stress model, and incubated with different concentrations of Shaoyao Gancao Decoction to observe the changes of endoplasmic reticulum stress level and autophagy signal pathway in ICC. We verified the scientific hypothesis that Shaoyao Gancao Decoction can inhibit IRE1 / Beclin1 signal pathway, reduce excessive autophagy caused by ICC endoplasmic reticulum stress, so as to improve the relaxation effect of SOD smooth muscle, which will lay a solid foundation for the theoretical research of TCM regulating biliary dynamics.
Keywords Shaoyao Gancao Decoction; Oddi Sphincter dysfunction; Interstitial cells of Cajal; Cell Autophagy; IRE1/Beclin1 pathway
中图分类号:R259文献标识码:Adoi:10.3969/j.issn.1673-7202.2021.02.025
Oddi括约肌(Sphincter of Oddi,SO)是胆、胰与十二指肠连接部位的精密平滑肌装置,在神经、体液、局部反射的多重复杂调控下,形成时相性的移行复合运动(MMC),发挥控制胆汁和胰液排放、防止反流的“门户”作用[1]。Oddi括约肌功能障碍(Sphincter of Oddi Dysfunction,SOD)是因SO舒张功能异常引起的一组疾病,临床分为胆型和胰型2种,以胆型SOD常见,主要表现为上腹部疼痛发作30 min以上、足以影响日常活动甚至到急诊科就诊,排便或改变体位、服用抗酸药均不能缓解,可伴随恶心、呕吐、肝功能异常、胆管扩张、胆管排空时间延长等表现[2](罗马Ⅳ标准,2106)。SOD往往没有器质性改变证据、却会给患者带来持久难忍的困扰,严重时可继发肝损、胰酶异常、甚至急性胰腺炎等,严重危害患者的生命健康[3]。因此,积极探索SOD的病理机制和药物治疗具有重要意义。
目前针对SOD的首选治疗仍然是内镜下括约肌切开术(Endoscopic Sphincterotomy,EST),但EST仅对部分患者有效、且近期有并发出血和胰腺炎风险,手术引起SO永久性破坏可导致菌群易位、反流性胆管炎的后果[4]。内镜下局部注射内毒毒素对SOD疗效亦不确切[5]。内科保守治疗如钙通道拮抗剂、硝酸酯类、胃肠动力调节药物等可能临时减缓SO平滑肌痉挛,但实际疗效没有在足够大的RCT研究中得到证实[6]。
事实上,SOD的形成涉及不同细胞-组织-器官间的功能失调,多种细胞信号传导、基因或蛋白表达异常均可导致SO平滑肌舒缩功能紊乱。这提示我们,SOD病理机制复杂,细胞与细胞之间、细胞因子及其信号通路之间存在复杂联系,基于单一靶点的治疗方法对SOD效果欠佳。为此,我们从调控平滑肌细胞的Cajal间质细胞(Interstitial Cells of Cajal,ICC)入手,分析芍药甘草汤如何通过下调IRE1/Beclin1通路抑制ICC过度自噬,以促进ICC功能而改善SOD的作用机制。
1 恢复和促进ICC功能可能是治疗SOD的重要途径
慢波电位是消化道平滑肌特有的、细胞自发性节律性去极化形成的起步电变化,本身不能直接引起平滑肌收缩,但它是动作电位产生的基础。研究证明,ICC是消化道慢波电位的发生器,作为起搏细胞发挥着调控平滑肌动力、推进电活动传播、介导和调节神经递质的重要作用[7-8]。
ICC广泛存在于人和哺乳动物的消化系统中,最初发现在胃、小肠、结肠等部位的平滑肌层内以网络状广泛分布,因其与固有神经和平滑肌细胞之间的紧密连接,引起广泛关注[9];深入研究发现,在胃肠道以外的胆囊、肝外胆道、Oddi括约肌、输精管、膀胱、尿道中均有ICC的分布[10]。解剖学和电生理学研究均证明ICC是神经元细胞和平滑肌细胞的重要纽带,依靠特异性缝隙连接蛋白Cx43和Cx45将神经细胞和平滑肌细胞紧密结合[11]。尽管ICC细胞总量不足消化道肌膜细胞的10%,却承担着调控平滑肌基本电节律起搏和传播的关键角色[12];如果说Oddi括约肌对于人类的胆汁和胰液排放是起“阀门”作用[1],那么ICC可谓是开启阀门的“钥匙”。
ICC特异性表达一种酪氨酸激酶受体c-kit,可被干细胞生长因子(Stem Cell Factor,SCF)激活。SCF由胃肠神经细胞及平滑肌细胞合成并分泌,作为c-kit的天然配体,可促进c-kit受体的表达。当c-kit与SCF结合后信号跨膜传递,一方面激活PI3K/Akt、RAS/ERK、JAK/STAT3种胞内信号途径,发挥调控ICC增殖分化及维持细胞表型的功能[13];另一方面,c-kit/SCF还能磷酸化ICC细胞膜表面SP、NK1、TRPV1等受体,增加ICC内在起搏节律,调节SO平滑肌的收缩[14]。此外,ICC与平滑肌细胞均来源于同一种前体细胞,c-kit受体的表达与否决定该前体细胞的分化方向,即当c-kit/SCF信号系统受损时,则该前体细胞因缺少c-kit受体刺激而分化为平滑肌细胞[15],如此则ICC数量和功能缺失,最终导致SO网络结构发生改变,影响慢波的形成及信号的传导,导致消化道动力障碍[16]。由此可见,c-kit/SCF表达对ICC的生长发育和维持SO动力的稳态具有至关重要的作用。
越来越多的研究发现,在肝外胆管、胆囊、Oddi括约肌等组织中存在c-kit表达阳性细胞,即ICC;而在多种胆道疾病如胆囊胆固醇结石、慢性胆囊炎、硬化性胆管炎、胆管囊肿等引发的SOD中,ICC的活性与功能随着疾病的进展而明显下降,并同时伴有SCF表达降低[17-20]。我们前期通过建立比格犬胆囊切除模型,发现肠神经系统中最重要的抑制性神经递质一氧化氮(Nitric Oxide,NO)可以对犬SO产生显著抑制作用[21-22]。事实上,NO发挥抑制作用的主要靶细胞就是ICC,以激活ICC内可溶性环磷酸鸟苷(Cyclic Guanosine Monophosphate,cGMP)及cGMP依赖性蛋白激酶的方式,调节ICC内钙离子浓度及周围平滑肌细胞的收缩活动[23]。我们进一步在透射电镜下观察,发现模型组的SO组织内ICC细胞数量和细胞器减少、线粒体部分空泡状或双层膜结构消失。因此,恢复并促进ICC的数量和功能可能是防治SOD的重要途径之一。围绕这些问题,明确SOD形成过程中对ICC起到负向调节作用而促进SO舒张异常的关鍵因素,不仅可以提高ICC细胞活性及增强周围平滑肌细胞的舒张效应,更为我们进一步治疗SOD提供新的思路。
2 阻断IRE1/Beclin1信号通路可减少ICC过度自噬、提高SO舒张效应
ICC在消化道中形成网状结构,其数量处于动态平衡之中,炎性反应、手术应激、激素水平改变等病理因素均可导致ICC数量减少或功能减退,发生多种消化动力障碍性疾病[8,12]。其中,内质网应激(ERS)引起细胞过度自噬是ICC数量减少和结构破坏的重要原因[24]。
ERS引起的细胞自噬是一把“双刃剑”:外界刺激引起内质网稳态改变,导致未折叠蛋白反应(UPR)或细胞内Ca2+超载,都将激活自噬反应,即通过胞内溶酶体途径消化自身受损的细胞器或错误折叠蛋白,从而减轻细胞损伤、维持细胞正常生理功能,可起到预防疾病的作用;然而ERS持续存在和增强的情况下,如机体受到外界电离辐射、缺血缺氧、惊厥等,过度自噬将引导细胞走向程序性死亡[25-26],使得机体病变加重。
已有文献表明,IRE1-TRAF2-JNK-Beclin1是ERS启动细胞过度自噬的重要信号通路:ERS时,未折叠或错误折叠蛋白的大量积累,使内质网分子伴侣葡萄糖调节蛋白78(GRP78)与肌醇依赖性激酶-1(IRE1)解离,参与UPR反应,GRP78被作为ERS发生的标志性分子[25]。过多的错误折叠蛋白,将激活自噬清除受损的内质网,当自噬发生时,微管相关蛋白轻链3B(LC3B)始终位于自噬体膜上,被作为检测自噬水平的特异性方法。IRE1是内质网I型跨膜蛋白,ERS时启动二聚化的IRE1,其Ser/Thr蛋白激酶结构域与肿瘤坏死因子受体相关因子2(TRAF2)相互作用形成复合物,将信号传递至凋亡信号调控激酶I(ASK1),继而激活c-Jun氨基端激酶(JNK),活化的JNK调节磷酸化的Bcl2释放出游离的Beclin1进而诱导自噬。Beclin1是一种含BH3结构域的Bcl2互作蛋白,作为自噬基因,是自噬的直接执行者[27-28]。
多项研究在消化动力障碍疾病中证实了ICC数量或功能异常可能与ERS引发的ICC过度自噬有关:在功能性消化不良的大鼠模型中,ICC-MY内细胞结构出现异常,线粒体肿胀明显,粗面内质网颗粒脱落,可见大量自噬泡[29];在慢传输型便秘的大鼠模型中发现,肠道ICC中ERS标记分子GRP78、自噬相关Beclin1和LC3B表达上升、自噬泡水平较对照组明显增高[30]。然而,并未在SOD疾病模型中找到ICC产生ERS继而引发自噬的证据。据此,我们猜测,ERS引起细胞过度自噬是否是SOD中ICC数量减少和结构破坏的罪魁祸首?
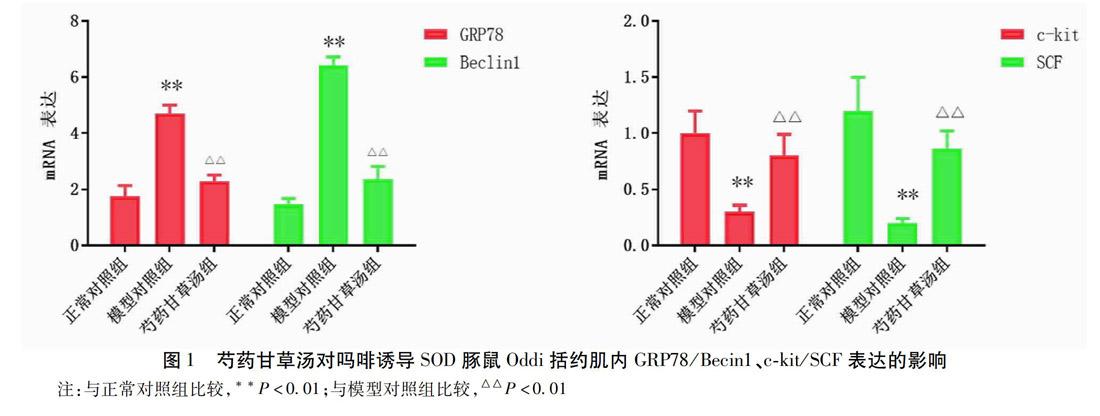
针对我们的猜测,我们观察了比格犬胆囊切除模型中SO压力明显异常的对象,通过透射电镜检查SO平滑肌中ICC超微结构,发现ICC与周围平滑肌和神经末梢之间缝隙连接减少,细胞器减少,粗面内质网扩张且脱颗粒明显,自噬泡可见。同时我们在吗啡刺激模拟豚鼠SOD模型中以RT-PCR检测SO标本内ERS自噬相关基因,发现GRP78、Beclin1表达较假手术组明显升高,而相反的,c-kit和SCF表达则明显下降。见图1。这提示我们:ERS诱导的ICC过度自噬可能参与了SOD的发病过程,并影响到了SO内ICC的数量和功能;ERS激活IRE1/Beclin1信号通路促进细胞过度自噬可能是导致ICC数量功能减退并引起SO动力障碍性疾病的重要机制。因此,寻找针对ICC具有靶向调节的药物,可以减缓内质网应激-自噬引起的细胞程序性死亡,增强胆道动力障碍病理状态下ICC的数量和功能,可能成为治疗SOD药物研究的新方向。
3 探讨芍药甘草汤调节ICC活性的机制为治疗SOD提供了新视角
SOD以腹痛为主要临床表现,古代没有SOD的病名,但类似的症状表现在“腹痛”等病证中,中医学认为其主要以少阳胆经或厥阴肝经病变为主。肝藏血,血为阴,故肝体为阴;肝主疏泄,内寄相火,为风木之脏,易动风化火,故肝之功能属阳。《临证指南医案·肝风》:“故肝为风木之脏,因有相火内寄,体阴用阳,其性刚,主动主升,全赖肾水以涵之,血液以濡之”。筋膜喜阳气之温煦、阴血之荣养,阴阳不足或阴阳失衡则筋脉横解、挛急而痛。因此,治疗当以柔肝舒筋、缓急止痛为主。芍药甘草汤最早见于汉代张仲景所著《伤寒论·辨太阳病脉证并治》,为张仲景治疗诸痛的基础方,亦是缓急止痛的常用药对,仅《伤寒论》113方中就有24方使用了这一配伍。尽管仅有两味药,实则有“四两拨千斤”之效。方中芍药为君,偏于入里而泻实,甘草为臣,偏于补中滋液。两者配伍,张弛有道、柔肝缓急,具有柔肝舒筋、缓急止痛之功效,可纠正“体阴用阳”失衡所致的筋膜拘挛[31]。
现代药理研究发现,芍药中主要成分芍药甙可通过降低SO基础压发挥治疗胆源性胰腺炎的作用[32],并对高胆固醇血症模型的SO肌环产生舒张作用[33];甘草的甲醇提取物FM100亦可镇痛、抑制消化液分泌、减轻平滑肌痉挛[32]。
课题组针对本科室16例临床诊断为Ⅱ型SOD的患者,采用自身前后对照发现芍药甘草汤可以明显降低VAS疼痛评分、ALT/AST、γ-GT以及ECT肝胆核素显像的胆汁排泄时间;通过4~7个月的随访,最终仅2例(12.5%)患者行内镜下EST術。我们同时在预实验中发现,芍药甘草汤可显著降低吗啡诱导SOD模型豚鼠Oddi括约肌内自噬相关GRP78、Beclin1基因表达,并提高了c-kit与SCF表达。见图1。以上结果提示我们,调控内质网应激-自噬相关IRE1-Beclin1信号通路,提高ICC数量活性,可能是芍药甘草汤改善SO平滑肌舒张效应的重要机制之一。
4 科学假说和主要研究内容
基于ICC在消化动力障碍疾病中的新进展和芍药甘草汤具有舒张SO效应的工作基础,我们提出科学假说:芍药甘草汤抑制IRE1/Beclin1信号通路,减轻ICC内质网应激引起的过度自噬,从而改善SOD平滑肌舒张效应。
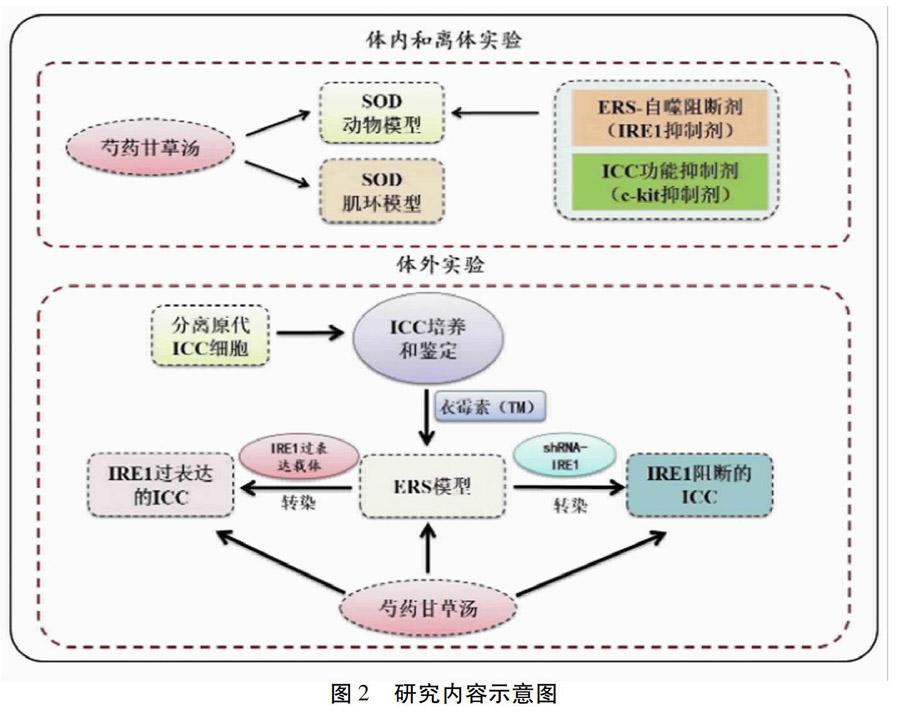
为了验证上述假说,开展以下研究工作:复制豚鼠SOD模型,设IRE1抑制剂和c-kit特异性抑制剂为对照,予芍药甘草汤干预治疗,观察芍药甘草汤对Oddi括约肌压力、ICC胞内内质网应激水平、ICC自噬水平的影响,阐明芍药甘草汤在体内抑制ICC过度自噬而改善SOD的作用;分离正常豚鼠的Oddi括约肌肌环,吗啡刺激诱导离体SOD模型,并同时予不同浓度的芍药甘草汤加入肌槽中孵育,观察芍药甘草汤对Oddi括约肌肌条收缩曲线、ICC自噬水平的影响;分离正常豚鼠Oddi括约肌内原代ICC,构建IRE1基因沉默或过表达载体,转染至ICC,并予衣霉素刺激ICC建立内质网应激模型,予不同浓度的芍药甘草汤孵育,观察ICC内质网应激水平、自噬水平及IRE1/Beclin1信号通路的变化,解析芍药甘草汤下调IRE1/Beclin1信号通路抑制ICC过度自噬的作用机制。见图2。
通過本研究,将验证以上科学假说,阐明芍药甘草汤改善SOD的作用机制,促进中医药调节胆道动力学的研究发展。
参考文献
[1]Kyanam Kabir Baig KR,Wilcox CM.Translational and clinical perspectives on sphincter of Oddi dysfunction[J].Clin Exp Gastroenterol,2016,28(9):191-195.
[2]彭春艳,邹晓平.Oddi括约肌功能障碍:新研究和新认识[J].胃肠病学,2017,22(5):262-265.
[3]Afghani E,Lo SK,Covington PS,et al.Sphincter of Oddi Function and Risk Factors for Dysfunction[J].Front Nutr,2017,30(4):1.
[4]Miyatani H,Matsumoto S,Mashima H.Risk factors of post-endoscopic retrograde cholangiopancreatography pancreatitis in biliary type sphincter of Oddi dysfunction in Japanese patients[J].J Dig Dis,2017,18(10):591-597.
[5]Murray W R.Botulinum toxin-induced relaxation of the sphincter of Oddi may select patients with acalculous biliary pain who will benefit from cholecystectomy[J].Surgical Endoscopy & Other Interventional Techniques,2011,25(3):813-816.
[6]杨迎,王凯,王长淼.Oddi括约肌功能障碍诊断治疗的现状与困惑[J].世界华人消化杂志,2018,26(30):1735-1741.
[7]Sanders KM,Ward SM,Koh SD.Interstitial cells:regulators of smooth muscle function[J].Physiol Rev,2014,94(3):859-907.
[8]Pasternak A,Szura M,Gil K,et al.Interstitial cells of Cajal-systematic review[J].Folia Morphol(Warsz),2016,75(3):281-286.
[9]Sanders KM,Kito Y,Hwang SJ,et al.Regulation of Gastrointestinal Smooth Muscle Function by Interstitial Cells[J].Physiology(Bethesda),2016,31(5):316-326.
[10]王锴,范莹.胆道Cajal样间质细胞的研究进展[J].中华消化外科杂志,2016,15(4):404-406.
[11]黄振鹏,邱虎,容谦,等.Cajal间质细胞在消化系统动力性疾病发病中作用机制的研究进展[J].国际消化病杂志,2018,38(1):28-31.
[12]Huizinga JD,Chen JH.Interstitial cells of Cajal:update on basic and clinical science[J].Curr Gastroenterol Rep,2014,16(1):363.
[13]Li X,Xue H,Kang Q,et al.Alterations of the interstitial cells of Cajal and the microstructure of the gastrointestinal tract in KIT distal kinase mutant mice[J].Cell Tissue Res,2014,355(1):49-58.
[14]Chen L,Yu B.Telocytes and interstitial cells of Cajal in the biliary system[J].J Cell Mol Med,2018,22(7):3323-3329.
[15]Radenkovic G,Radenkovic D,Velickov A.Development of interstitial cells of Cajal in the human digestive tract as the result of reciprocal induction of mesenchymal and neural crest cells[J].J Cell Mol Med,2018,22(2):778-785.
[16]Tan YY,Ji ZL,Zhao G,et al.Decreased SCF/c-kit signaling pathway contributes to loss of interstitial cells of Cajal in gallstone disease[J].Int J Clin Exp Med,2014,7(11):4099-4106.
[17]Fan Y,Wu S,Fu B,et al.The role of interstitial Cajal-like cells in the formation of cholesterol stones in guinea pig gallbladder[J].Hepatol Int,2015,9(4):612-620.
[18]Huang ZP,Qiu H,Yang Y,et al.The Role of Interstitial Cells of Cajal in Acute Cholecystitis in Guinea Pig Gallbladder[J].Cell Physiol Biochem,2016,38(5):1775-1784.
[19]Feng H,Wang F,Wang C.C-Kit expression in the gallbladder of guinea pig with chronic calculous cholecystitis and the effect of Artemisia capillaris Thunb on interstitial cells of Cajal[J].Iran J Basic Med Sci,2016,19(7):720-725.
[20]Karaku OZ,Ulusoy O,Aktürk G,et al.The Density of Interstitial Cells of Cajal Is Diminished in Choledochal Cysts[J].Dig Dis Sci,2016,61(3):900-904.
[21]李甫,范明明,楊超,等.一氧化氮与胆囊收缩素对犬Oddi括约肌的作用[J].中华消化外科杂志,2011,10(5):380-382.
[22]Li F,Zhang XW,Li KW,et al.Effects of cholecystectomy on the changes of motility of Beagle dogs′ sphincter of Oddi[J].Acta Cir Bras,2014,29(4):237-244.
[23]Kwon YH,Kim N,Nam RH,et al.Change in the Interstitial Cells of Cajal and nNOS Positive Neuronal Cells with Aging in the Stomach of F344 Rats[J].PLoS One,2017,12(1):e0169113.
[24]Dai YC,Zheng L,Zhang YL,et al.Jianpi Qingchang decoction regulates intestinal motility of dextran sulfate sodium-induced colitis through reducing autophagy of interstitial cells of Cajal[J].World J Gastroenterol,2017,23(26):4724-4734.
[25]Hosomi S,Kaser A,Blumberg RS.Role of endoplasmic reticulum stress and autophagy as interlinking pathways in the pathogenesis of inflammatory bowel disease[J].Curr Opin Gastroenterol,2015,31(1):81-88.
[26]Chen H,Yang H,Pan L,et al.The molecular mechanisms of XBP-1 gene silencing on IRE1α-TRAF2-ASK1-JNK pathways in oral squamous cell carcinoma under endoplasmic reticulum stress[J].Biomed Pharmacother,2016,77:108-113.
[27]Zhu X,Zhang J,Sun H,et al.Ubiquitination of inositol-requiring enzyme 1(IRE1)by the E3 ligase CHIP mediates the IRE1/TRAF2/JNK pathway[J].J Biol Chem,2014,289(44):30567-30577.
[28]Cheng X,Liu H,Jiang CC,et al.Connecting endoplasmic reticulum stress to autophagy through IRE1/JNK/beclin-1 in breast cancer cells[J].Int J Mol Med,2014,34(3):772-781.
[29]曾丽君,凌江红,邓静,等.柴胡疏肝散对功能性消化不良大鼠胃窦肌间Cajal间质细胞自噬的影响[J].时珍国医国药,2017,28(5):1041-1044.
[30]王振华,丁良,梁婧,等.Cajal间质细胞在慢性传输型便秘中的临床研究进展[J].湖南中医杂志,2015,31(1):164-166.
[31]宁云红,郭承伟.以21篇临床文献综述芍药甘草汤应用概况[J].中医药导报,2017,23(3):83-84,88.
[32]朱广伟,张贵君,汪萌,等.中药芍药甘草汤基原及药效组分和药理作用研究概况[J].中华中医药杂志,2015,30(8):2865-2869.
[33]Wang F,Wang CM,Liu JD,et al.Influence of paeoniflorin on intracellular calcium ion concentration in the sphincter of Oddi of hypercholesterolemic rabbits[J].Genet Mol Res,2014,13(3):5001-5010.
(2020-03-17收稿 责任编辑:王明)
基金项目:国家自然科学基金项目(81904017);上海市科委“科技创新行动计划”临床医学领域项目(19401972400);上海市浦东新区卫生和计划生育委员会卫生行业科研专项(PW2018E-03)
作者简介:李甫(1985.06—),男,硕士研究生,主治医师,研究方向:胆道动力学的中西医结合研究,E-mail:yclifu17@163.com
通信作者:蔡淦(1938.08—),男,本科,主任医师,研究方向:脾胃病的中西医结合研究,E-mail:lwchenmeng@163.com
