载体油对槲皮素纳米乳液理化稳定性和生物利用度的影响
2021-07-08李朝阳窦中友张丽萍刁静静江连洲
李朝阳,窦中友,张丽萍,刁静静,江连洲,马 萍,*
(1.黑龙江八一农垦大学 国家杂粮工程技术研究中心,黑龙江 大庆 163319;2.东北农业大学食品学院,黑龙江 哈尔滨 150030)
槲皮素是一种广泛存在于蔬菜(如洋葱、西兰花)、水果(如苹果、蓝莓)、谷物和草药中的黄酮醇类化合物,具有抗菌、抗氧化、抗增殖、抗炎、抗肥胖等生物活性[1]。然而,槲皮素黏膜通透性低,具有高度疏水性和低口服生物利用度(大鼠中小于17%,人类中约1%)[2]。因此,槲皮素食用后直至代谢之前的保护及其在胃肠道的生物活性至关重要。
迄今为止,已有研究报道了不同包封系统,包括脂质体、纳米乳液、聚合物纳米颗粒等,用以增强亲脂性生物活性组分的生物利用度[3]。在这些系统中,纳米乳液是一种特别有效的输送系统,因为它具有制备简单、安全性高和易于工业化的优点,因此受到越来越多的关注。纳米乳液粒径较小(10~500 nm),具有长期稳定性,可以避免沉淀和聚结现象[4]。近年来,使用模拟胃肠道进行的体外研究表明,槲皮素的生物可及性可以通过改变纳米乳液的结构和组成调整[5]。Kwan等[6]研究发现橙油难以与生物活性物质和胃肠道内消化物形成胶束,营养物质的生物可及性较低。因此载体油种类对营养物质利用率有较大的影响。研究发现包含短链或中链甘油三酯(medium chain triglyceride,MCT)传递系统易被消化[7]。另一方面,包含长链甘油三酯(long chain triglyceride,LCT)的递送系统在消化体系中形成混合胶束,生物活性成分易被转运,但生物利用度较低[8]。前期研究表明,使用MCT配制的基于乳液的输送系统比使用LCT配制的输送系统更适合封装和输送VE[9]。
本研究旨在制备和表征槲皮素纳米乳液。使用体外消化模型结合脂质体特性(MCT与LCT),研究载体油类型和体积分数对高度亲脂性类黄酮槲皮素的稳定性和生物可及性的影响。本实验研究结果将为纳米乳液体系的稳定机理研究和实际应用提供数据参考。
1 材料与方法
1.1 材料与试剂
梨小豆 国家杂粮技术研究中心;MCT、LCT长沙祯祥生物科技有限公司;NaOH、HCl、石油醚(均为分析纯) 天津市科密欧化学试剂有限公司;NaCl、CaCl2(均为分析纯) 沈阳市华东试剂厂;胃蛋白酶(3 000 U/mg)、胰蛋白酶(250 U/mg) 诺维信生物技术有限公司。
1.2 仪器与设备
Allegra64R型台式高速冷冻离心机 美国贝克曼公司;ZGL-20G型高速冷冻离心机 上海安亭科学仪器厂;DK-98-1型电热恒温水浴锅 天津市泰斯特仪器有限公司;ALPHA 1-4 LSC型冷冻干燥机 德国Christ公司;Zetasizer Nano-ZS 90型粒度分析仪 英国马尔文公司;UV755B型紫外分光光度计 上海菁华科技仪器有限公司;PHSJ-4A型实验室pH计 上海雷磁公司;FA2004B型电子分析天平(精度0.000 1 g) 北京赛多利斯仪器系统有限公司;Turbiscan Lab Expert浓缩体系稳定性分析仪 法国Formulaction公司;S4800型冷冻扫描电镜 日本Hitachi公司。
1.3 方法
1.3.1 梨小豆蛋白的提取
参考李杨等[10]提取方法。将梨小豆研磨过80 目筛形成粉状,加入石油醚脱脂6 h,将脱脂后的梨小豆按料液比1∶10(g/mL)加入蒸馏水搅拌混匀,用0.5 mol/L NaOH溶液调节pH值至10.0,在35 ℃水浴锅中搅拌2 h,3 500 r/min离心20 min取其上清液,用0.5 mol/L HCl溶液调节pH值至5.0,35 ℃静置2 h,3 500 r/min离心20 min取其沉淀,加水调节pH值至7.0,300 Da透析袋脱盐,喷雾干燥制得梨小豆蛋白(纯度92.6%)。
1.3.2 槲皮素纳米乳液的制备
将质量分数2%梨小豆蛋白溶解在去离子水中,用0.5 mol/L NaOH溶液将pH值调节至7.0,55 ℃搅拌2 h,4 ℃过夜使其混合均匀。分散质量分数0.2%槲皮素于2 种选定的载体油(MCT或LCT)中制备油相,然后将其混合成均匀的分散体。将油分散到水相(体积分数5%、10%、15%、20%)中,并使用高速混合器以10 000 r/min乳化3 min,以形成粗糙的乳液,然后使用高压均质化在100 MPa工作压力下均质3 次制备纳米乳液[10]。
1.3.3 粒度、Zeta电位和聚合物分散性指数(polymer dispersity index,PDI)
利用Zetasizer Nano-ZS 90型光散射粒度分析仪测定纳米乳液的平均粒径、Zeta电位和PDI。参数设定:油滴的折射率为1.460,水相溶液折射率为1.330,为降低多重光散射效应,分析前用PBS(pH 7.1,0.01 mol/L)稀释异硫氰酸苄酯纳米乳液1 000 倍测粒径及PDI(用于描述粒径均一度),稀释50 倍测Zeta电位[11]。
1.3.4 包封率的测定
槲皮素纳米乳液的包封效率参考文献[12]方法进行测定。将含有槲皮素纳米乳液的水性悬浮液10 000 r/min离心10 min,以分离出游离的槲皮素晶体,收集上清液,并与无水乙醇混合。使用紫外-可见分光光度计在波长375 nm处测定该溶液的吸光度。使用已知槲皮素含量的溶液制作标准曲线,计算测定溶液中槲皮素含量。包封率按式(1)计算:

式中:mE为纳米乳液中槲皮素的质量/g;mI为槲皮素的初始质量/g。
1.3.5 微观结构观察
通过冷冻扫描电镜对槲皮素纳米乳液进行形态观察[13]。将纳米乳液稀释100 倍,滴加在云母表面,用铝带将样品固定在样品架上,并使用离子溅射镀膜机用金钯溅射。20 kV加速电压下进行微观结构分析。使用带有气态二次电子检测器的二次电子图像获得微观结构。为了获得最佳图像质量,使用10 mm的标准工作距离和600 kPa压力。样品以×300的放大倍率可视化。
1.3.6 纳米乳液稳定性
采用李杨等[14]的方法,使用垂直扫描分析仪分析乳液的稳定性。在本实验中,于平底圆柱形玻璃池上放置5 个样品(总高度60 mm),并从下到上扫描,以监测样品在25 ℃下24 h内沿样品高度色散的光学特性。实验分为2 次进行,透射比的标准差为小于所有样品0.2%。平均后向散射在20~50 mm区域内计算,因为此区域不受乳化影响。根据透射比的变化评价各样品的稳定性。
1.3.7 槲皮素纳米乳液体外消化
根据Liu Xiaojuan等[15]的方法,通过模拟口腔、胃和小肠的消化进行体外消化模拟。
1.3.7.1 口腔消化
将纳米乳液样品(20 mL)与等体积的含黏蛋白(5 g/L)的人工唾液工作溶液混合;用0.5 mol/L NaOH将混合物的pH值调节至6.8,然后在37 ℃振荡器中以100 r/min孵育10 min,测定其粒径和Zeta电位。
1.3.7.2 胃消化
通过将NaCl(2 g)和HCl(7 mL)溶解在1.0 L的去离子水中制备模拟胃液。将口服消化阶段的样品(20 mL)与含有64 mg胃蛋白酶(1∶1,V/V)的模拟胃液混合,然后使用0.1 mol/L HCl溶液将pH值调节至2.5,并在37 ℃振荡器中孵育,100 r/min持续120 min。进行胃消化时,测定其粒径和Zeta电位。
1.3.7.3 小肠消化
制备包含CaCl2、NaCl和脂肪酶溶液(溶解于2.5 mL磷酸盐缓冲液中的60 mg脂肪酶)的模拟肠液。将消化过程在37 ℃加热2 h;在持续搅拌下将消化的pH值保持在7.0。使用pH 7.0的磷酸盐缓冲液测定样品的粒径和Zeta电位。
1.3.8 游离脂肪酸释放率的测定
根据Silva等[16]的方法,通过滴定法测定槲皮素纳米乳液释放的游离脂肪酸量评估脂解的程度。收集5 mL空肠滤液、回肠滤液和回肠递送样品,加入10 mL丙酮以猝灭酶活性,然后加入3 滴1%酚酞溶液作为指示剂。使用0.1 mol/L NaOH溶液进行直接滴定,加入NaOH体积直至滴定终点,并用于计算脂解产生的游离脂肪酸释放率。因此,释放的游离脂肪酸由中和游离脂肪酸所需的NaOH物质的量计算,除以甘油三酯可以产生的游离脂肪酸物质的量(假设样品完全消化,每1 个三酰基甘油分子产生2 个游离脂肪酸),如式(2)所示:
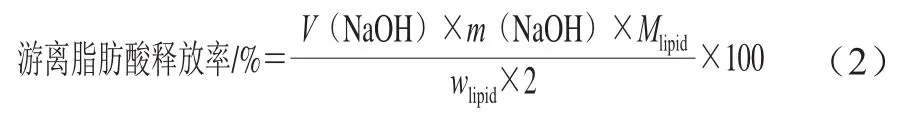
式中:V(NaOH)为中和所产生的游离脂肪酸释放率所需的NaOH溶液体积/mL;m(NaOH)为所用NaOH的浓度/(mol/L);wlipid为MCT(LCT)总质量/g;Mlipid为MCT(LCT)摩尔质量/(g/mol)。
1.3.9 槲皮素的生物利用度
根据Altaani等[17]的方法。小肠消化模拟后,使用高速冷冻离心机将10 mL小肠消化后的样品以5 000 r/min离心40 min,过滤得到上清液。将5 mL上清液与5 mL氯仿混合,涡旋2 min,2 500 r/min离心10 min,将该操作重复2 次。混合底部的氯仿相,并使用紫外分光光度计在波长275 nm处测其吸光度。槲皮素的生物利用度按式(3)计算:
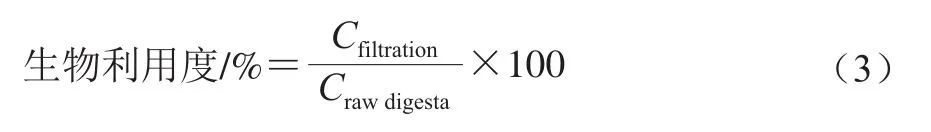
式中:Cfiltration为胶束中槲皮素的吸光度;Crawdigesta为消化液中槲皮素的初始吸光度。
1.4 数据统计分析
2 结果与分析
2.1 乳液粒径、Zeta电位和PDI测定结果
粒径是用于评估纳米乳液性能的主要因素,载体油的种类和体积分数可以在一定程度上决定纳米乳液的最终粒径。如表1所示,相同油脂体积分数下,MCT-纳米乳液粒径小于LCT-纳米乳液,随着油相体积分数升高,MCT-纳米乳液粒径先减小后增加,LCT-纳米乳液粒径显著增加(P<0.05)。可以推断出,油相组成对纳米乳液粒径的影响主要取决于液滴形成的物理化学因素,高压均质过程中产生液滴尺寸通常会随着油相黏度和界面张力的降低而减小,MCT的黏度和界面张力低于LCT,因此在均质过程中产生更小的液滴[18-19]。另一方面,LCT具有相对较高的水溶性,这导致形成的纳米乳液易形成奥斯特瓦尔德熟化,形成较小液滴后短时间内迅速增长[20]。随着载体油体积分数增加,液滴相互聚集,乳液粒径增加。2 种乳液具有较高的负电荷,且随着体积分数增加,Zeta电位变化不明显,证明纳米乳液Zeta电位与载体油类型和体积分数无关。PDI可以反映粒径均一度,并且PDI在0~0.3之间表明体系具有均匀的分散。PDI越小,粒度分布越集中[21]。使用不同的油制备的纳米乳液的PDI几乎低于0.3,显示出均匀的分散性。
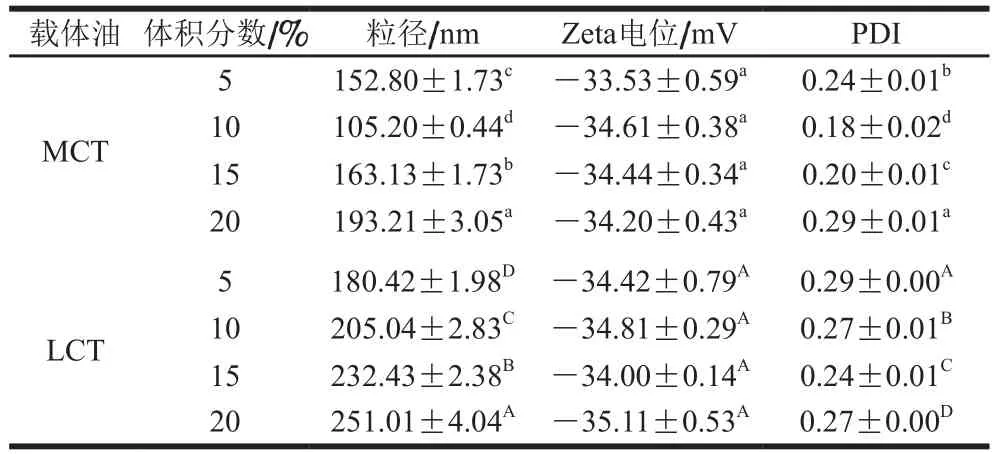
表1 载体油类型及体积分数对纳米乳液粒径、Zeta电位和PDI的影响Table 1Effect of carrier oil type and concentration on particle size,zeta-potential and PDI of nanoemulsion
2.2 包封率测定结果
槲皮素在纳米乳液中的包封率是评价纳米乳液体系质量和应用潜力的重要因素,它反映了槲皮素在制备过程中的保留率和表观溶解度。图1结果表明,在使用2 种油相制备的纳米乳液中,当槲皮素的负载量固定,油体积分数为5%时,MCT-纳米乳液包封率((84.2±2.14)%)高于LCT-纳米乳液((76.32±3.24)%)。可能是MCT的短酰基链与槲皮素之间的氢键相互作用,使生物活性物质在MCT中具有高包封率。Aditya等[22]研究发现姜黄素易溶于MCT形成高稳定性、高包封率纳米乳液。随着载体油体积分数增加,槲皮素包封率显著减小,这主要是因为槲皮素是一种脂溶性营养物质,乳液制备过程中槲皮素均匀分散至油相,相同体积乳化剂不能将其全部包埋,游离槲皮素增加,因此乳液包封率降低。
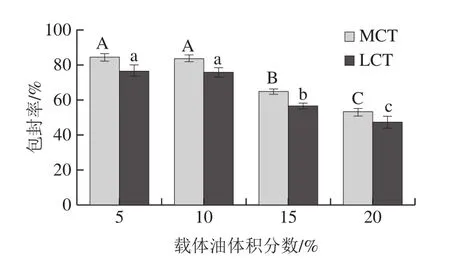
图1 载体油种类和体积分数对纳米乳液包封率的影响Fig.1 Influence of carrier oil type and concentration on encapsulation efficiency of nanoemulsion
2.3 微观结构
冷冻扫描电镜图能够以接近原子级的分辨率清晰地显示出纳米分子结构[23]。如图2所示,冷冻扫描电镜直接反映了2 种纳米乳液的表观形态和分散状态,可以看出相同体积分数载体油可以制备形成表观光滑且粒径较小的纳米颗粒,由于LCT黏度较大,游离油脂吸附在界面层上,形成部分黏连和聚集现象,MCT-纳米乳液表现出更小的粒径,这与2.1节结果一致。
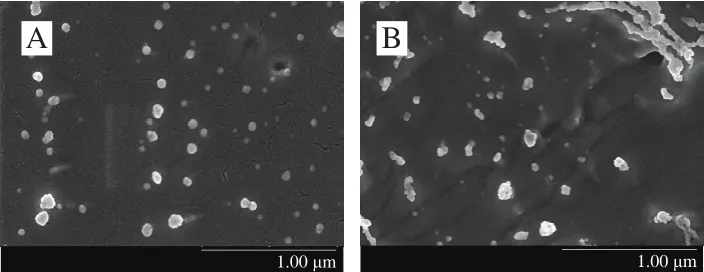
图2 基于MCT(A)和LCT(B)纳米乳液的冷冻扫描电镜Fig.2 Scanning electron microscopic images of MCT (A) and LCT (B)nanoemulsions
2.4 纳米乳液稳定性分析
由于纳米乳液体系在热力学上不稳定,其贮存稳定性易受到粒子碰撞和聚集的影响[24]。在本研究中,前期用于评估胶体分散体稳定性的Turbiscan稳定性分析仪用于研究槲皮素纳米乳液的物理稳定性[25]。如图3所示,2 种样品左边曲线未出现向上移动,中间曲线平缓无波动,右边曲线向上移动现象不明显。说明样品在贮藏期间具有较强稳定性,未出现沉淀、脂质析出和聚集等现象。且MCT-纳米乳液的曲线相对稳定,这说明在100 MPa的高压均质下,乳化剂能够较好地覆盖在油滴的表面,防止油滴发生聚集。相同体积分数下,不同油相均可以形成稳定的槲皮素纳米乳液,且以MCT为载体油,槲皮素纳米乳具有更强的稳定性。
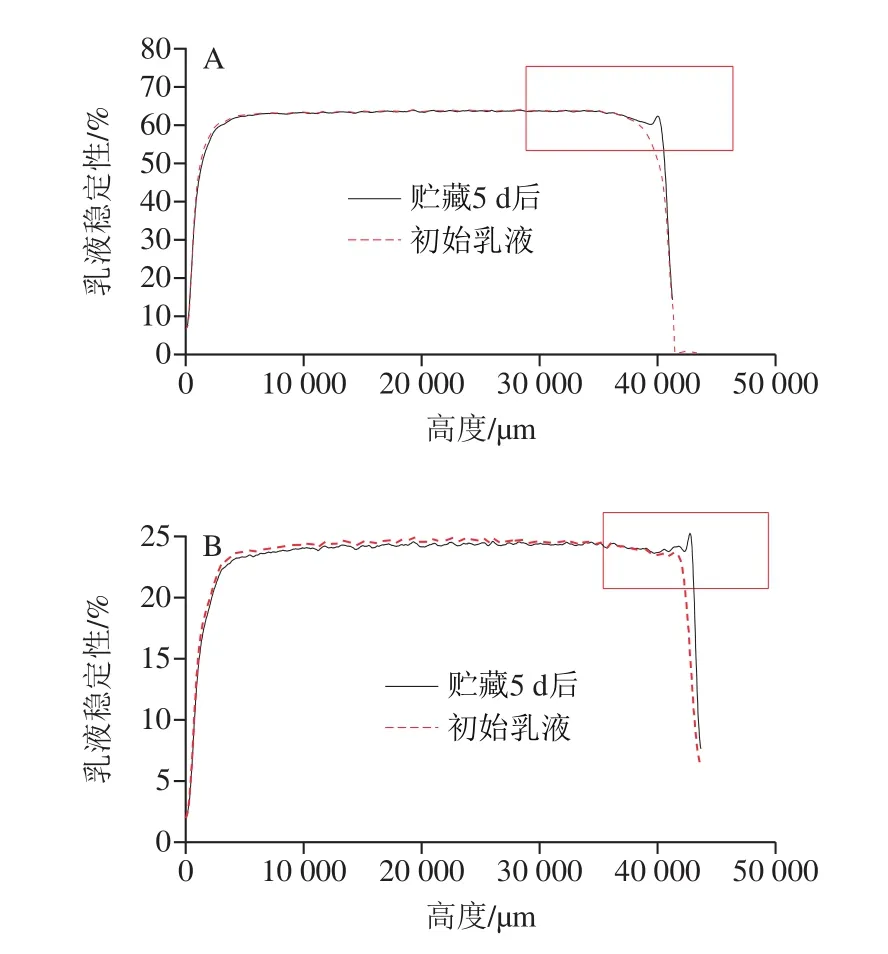
图3 基于MCT(A)和LCT(B)纳米乳液的稳定性影响Fig.3 Stability of nanoemulsions based on MCT (A) and LCT (B)
2.5 油脂类型对体外消化影响
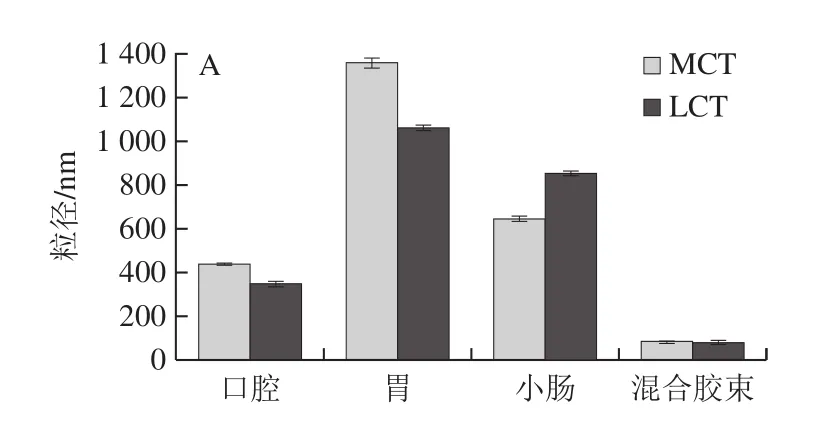
如图4所示,口腔阶段,2 种纳米乳液的唾液混合物均观察到絮凝物,并且通过光散射确定2 种乳液的平均粒径较初始乳液显著增加(P<0.05),主要是由于液滴与模拟唾液中的黏蛋白相结合形成聚合物,乳化剂与黏蛋白桥联形成絮凝。且乳液的Zeta电位也发生明显变化,这可能是由于口腔模拟液中的阴离子附着到O/W界面上[26]。MCT-纳米乳液和LCT-纳米乳液的粒径无显著差异,说明载体油种类对唾液混合物形态无显著影响。消化液进入模拟胃阶段,2 种纳米乳液粒径显著增加,这是由于液滴表面的乳化剂被为蛋白酶水解,界面层厚度降低,油相暴露出来形成聚集。另一方面,纳米液滴受低pH值和离子的诱导变性,减少了液滴之间的静电斥力,产生絮凝现象[27]。洪泽翰等[26]研究发现以酪蛋白酸钠作为乳化剂形成纳米乳液在模拟胃液中极易形成聚集。乳液的Zeta电位绝对值降低,由负电荷变成正离子。在小肠阶段,2 种纳米乳液粒径显著减小,这是因为模拟肠液中的脂肪酶将脂肪水解形成阴离子游离脂肪酸,并与槲皮素形成小分子胶束。且由于在消化过程中加入了胆盐,纳米乳液表现为增加的负电荷。这些负电荷可能是未消化的油滴、蛋白质聚集体或胶束等[28]。
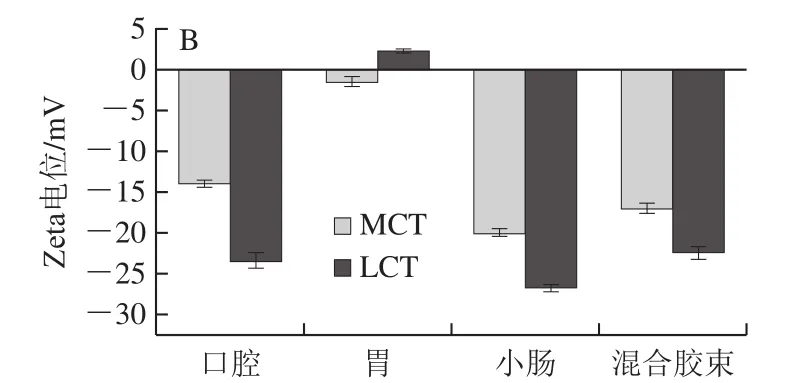
图4 体外消化阶段载体油种类对纳米乳液粒径(A)和Zeta电位(B)的影响Fig.4 Effect of carrier oil type on particle size (A) and zeta potential (B) of nanoemulsions during in vitro digestion
2.6 游离脂肪酸释放率
纳米乳液经体外消化模拟,在胰脂肪酶、胆汁盐和钙的作用下,三酰基甘油被转化为游离脂肪酸和单酰基甘油。NaOH可快速与游离脂肪酸发生中和反应,因此,此过程的速率和程度可以通过使用pH值固定方法自动滴定产生的游离脂肪酸监控。如图5所示,水解过程初始阶段,纳米乳液的脂肪酸释放率快速增加,随着水解时间延长,释放趋势逐渐平缓直至达到相对恒定的最终值,与LCT-纳米乳液相比,MCT-纳米乳液释放速率更快,可能是因为MCT较LCT溶解性更好[8]。因此在脂肪酶的作用下可以迅速水解,同样的,LCT黏度较高,游离LCT黏附在O/W界面层上形成保护膜,抑制脂肪酶对液滴的水解能力。
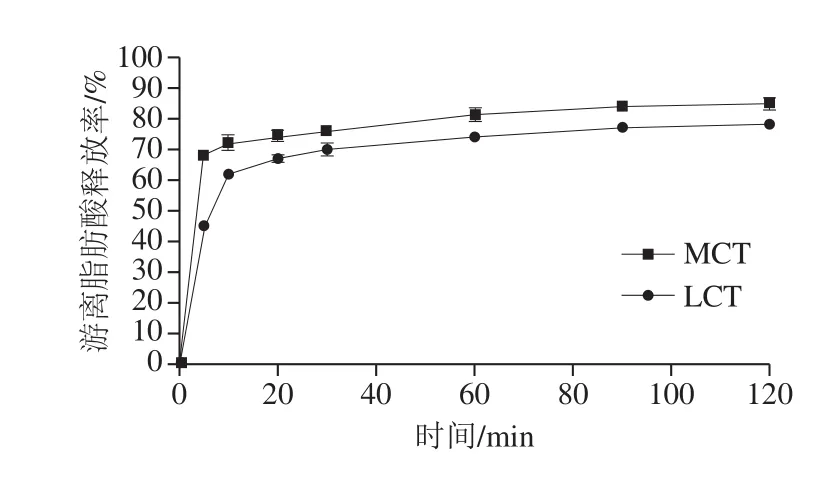
图5 体外消化过程中不同载体油制备的纳米乳液中游离脂肪酸的释放率Fig.5 Release rate of free fatty acids from nanoemulsion prepared with different carrier oils during in vitro digestion
2.7 槲皮素生物利用度
将口腔、胃和小肠阶段的模拟消化后获得的消化物离心,以获得含有溶解在该微胶粒中的槲皮素的微胶粒相(中间层)。通过测定胶束相中槲皮素的体积分数和总消化物确定生物利用度。如图6所示,槲皮素的生物利用度在9%~15%之间,具体取决于用于制备纳米乳液的油。在使用LCT制备的纳米乳液中,槲皮素的生物利用度明显较少,主要是由于LCT易与消化液中的阴离子多糖形成聚集体,且LCT黏度较大,吸附在界面层上形成保护膜,从而导致消化率较低[29]。另一方面,LCT-纳米乳液具有较大的颗粒尺寸和较低的比表面积,导致其不易被脂肪酶消化水解,生物成分吸收效率下降。相关研究[30-32]发现,富含高不饱和脂肪酸的核桃油不能在消化过程中维持其稳定性,阻碍了营养成分的生物利用度,这与本研究结果一致。
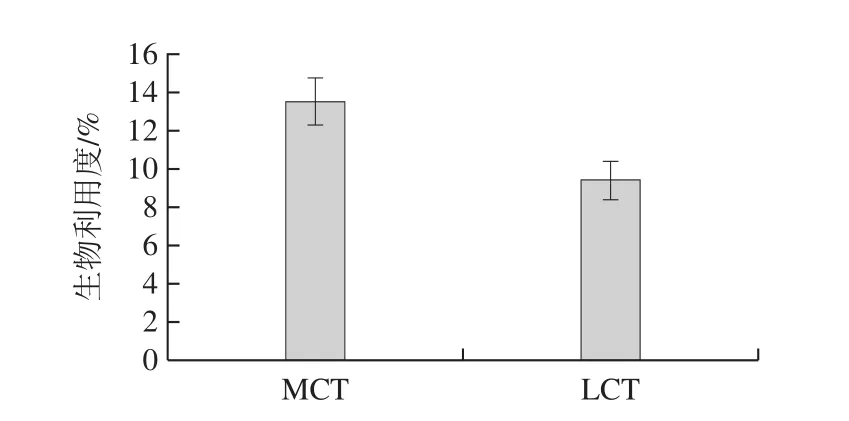
图6 基于MCT和LCT的纳米乳液中槲皮素生物利用度Fig.6 Bioavailability of quercetin in nanoemulsions based on MCT and LCT
3 结 论
以MCT和LCT为载体油,利用高压均质制备槲皮素纳米乳液,并评估其稳定性和生物利用度。结果表明,由MCT制得的纳米乳液具有更小的粒径和稳定性,这种现象归因于载体油相对低的水溶性,使奥斯特瓦尔德熟化率降低。油相体积分数越高,粒径越大,但油相种类对其Zeta电位无显著影响。在体外消化过程中,2 种纳米乳液粒径均先增加后降低,MCT-纳米乳液脂肪释放率最终值较LCT-纳米乳液高,与槲皮素生物利用度呈正相关。因此,以MCT作为载体油可以得到高稳定性纳米乳液体系,显著增加生物活性成分的消化吸收。
