獐牙菜苦苷可减轻糖尿病大鼠的周围神经痛:基于抑制NOXS/ROS/NLRP3通路实验
2021-07-08姚嘉茵尧新华劳俊铭陈陈燕
王 保,姚嘉茵,尧新华,劳俊铭,刘 栋,陈陈燕,鲁 义
1广州医科大学附属中医医院麻醉科,广东 广州 510130;2中山大学附属第六医院消化内科,广东 广州 510655
糖尿病周围神经痛(DPN)是1型和2型糖尿病的常见并发症,有报道称其发病率为13%~26%[1-2]。大部分DPN患者长期忍受慢性疼痛,甚至导致下肢截肢或者神经性疼痛致残[3-4]。目前临床上尚无针对DPN的特效治疗方法。獐牙菜苦苷是多种传统中药的活性成分,有国外研究表明獐牙菜苦苷及其衍生物具有抗糖尿病和抗高脂血症的作用,且可以减缓病理性神经疼痛[5]。然而,獐牙菜苦苷具体的镇痛通路尚不明确。有研究表明獐牙菜苦苷可调节核苷酸结合寡聚化结构域样受体蛋白-3(NLRP3)的信号通路,而NLRP3的激活主要受还原型烟酰胺腺嘌呤二核苷酸磷酸氧化酶(NOXs)和活性氧自由基(ROS)的调控[6]。这可能是其在治疗DPN中起作用的分子靶点。本课题组前期研究结果证实,DPN患者存在炎性因子的表达失衡[7-8]。本研究拟从獐牙菜苦苷通过调节NOXS/ROS/NLRP3信号通路,恢复平衡炎性因子为切入点,揭示獐牙菜苦苷对DPN的治疗作用,使其成为未来可供临床应用的药物防治手段。
1 材料和方法
1.1 实验动物及分组
SPF级Sprague-Dawley大鼠由广州医科大学动物实验中心提供。按照样本含量计算公式计算得出,共需32只大鼠,雌雄各半。选择大鼠体质量为180~220 g。大鼠称重后按照体质量编写序号1~32号,按照随机数字表法分在4个饲养笼,8只/笼,分别标记为:空白对照组、DPN模型组、獐牙菜苦苷治疗组、NOXS抑制剂治疗组。设定环境参数为湿度45%~55%,温度20~26 ℃,光照12 h∶12 h,提供自由摄食和饮水。实验动物使用许可证号:SYXK(粤)2020-0227。
1.2 动物模型的建立
所有大鼠在实验中心饲养1 周后开始动物模型的建立。本研究采用了目前DPN动物模型中最常用的链脲佐菌素(STZ)法构建大鼠模型[9]。方法如下:所有大鼠在禁食不禁水12 h后,一次性腹腔注射STZ溶液55 mg/kg(Sigma,溶于柠檬酸冷缓冲液)。操作后48 h后测定大鼠尾静脉血糖数值,若空腹血糖>16.7 mmol/L则验证成功。若造模不成功,则采用72 h后补充注射STZ溶液20 mg/kg,48 h后再次检测血糖。全部造模成功需要的时间约1周。空白对照组大鼠则腹腔注射相同体积的生理盐水作安慰剂对照。
1.3 各组的干预措施
空白对照组:在造模成功后第1、7、14天分别按大鼠每公斤体质量给予腹腔注射10 mL的生理盐水作安慰剂对照。DPN模型组:在造模成功后第1、7、14天分别按大鼠每公斤体质量给予腹腔注射10 mL的生理盐水作安慰剂对照。獐牙菜苦苷治疗组:造模成功后第1、7、14天分别按大鼠体质量给予腹腔注射治疗组药物(5 mg/kg獐牙菜苦苷,陕西永源生物)。NOXS抑制剂治疗组:造模成功后第1、7、14天分别按大鼠体质量给予腹腔注射抑制剂药物(10 mL/kg NOXS抑制剂,配置浓度为0.1 mg/mL:二苯基氯化碘盐,DPI,MCE,Corp.USA)。给药完毕30 min后进行动物实验。
实验过程持续14 d,大鼠在麻醉下处死,迅速解剖并取出腰膨大,留取2~3 g腰膨大组织,置于-70 ℃冰箱,用于基因及蛋白水平的检测。
1.4 触觉过敏试验
在造模成功后第1、7、14天观察大鼠应对触觉异位性疼痛的行为。方法如下:在实验前至少适应这个环境20 min。将大鼠放在一个有金属外壳的塑料笼子里,并让他们自由移动。下方放置Von Frey细针,从0.0045到447 mg逐渐增加对大鼠脚底的刺激,使用DelloffMR[9]所改良的上下调整法,刺激大鼠足跖正下方,观察其缩脚反应,并详细记录最小能诱发其缩腿的阈值。
1.5 ELISA检测与Western blot检测
实验大鼠处死后分离腰膨大组织,根据试剂盒说明书操作,采用ELISA方法定量检测各组大鼠脊髓组织的TNF-α、IL-6、TGF-β、NOXS、ROS以及NLRP3的表达水平。采用Western blot方法检测检测各组大鼠脊髓组织的NOXS、ROS以及NLRP3的蛋白表达水平。
1.6 统计学分析
应用SPSS 22.0进行统计分析。计量资料均采用均数±标准差表示,采用单因素的方差分析以及LSD法进行组间比较,P<0.05 为差异有统计学意义。
2 结果
2.1 建模结果
本研究采用STZ建模方法诱导DPN的首次成功率约为87.5%,二次诱导成功率100%。组间差异无统计学意义(P=0.32,表1)。

表1 不同组别建模过程中STZ注射次数
2.2 触觉过敏试验
在造模成功后第1、7、14天观察大鼠应对触觉异位性疼痛的行为,结果显示,与空白对照组比较,DPN模型组大鼠在造模后第1 天、第7 天的压力阈值下降(P<0.001),持续至第14天(P<0.001)不能自愈。与DPN模型组比较,獐牙菜苦苷以及NOXS抑制剂干预后,能有效提高压力阈值(第7、14天,P<0.001)。与NOXS抑制剂比较,獐牙菜苦苷治疗组大鼠的压力阈值较高(第7天,P=0.015;第14天,P=0.009,图1)。
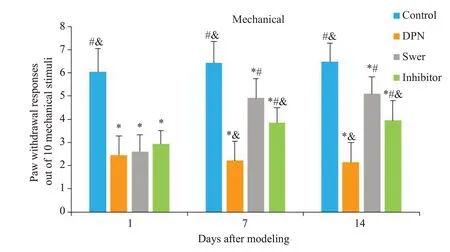
图1 各组大鼠触觉过敏试验的比较Fig.1 Comparison of tactile hypersensitivity of the rats in each group.*P<0.05 vs control group;#P<0.05 vs DPN group;&P<0.05 vs swer group.
2.3 各组大鼠NOXS/ROS/NLRP3通路及炎性因子的表达比较
DPN 模型组均上调NOXS(P<0.001)、ROS(P<0.001)以及NLRP3(P=0.002)表达。与DPN模型组比较,獐牙菜苦苷治疗组有效下调NOXS(P<0.001)、ROS(P<0.001)以及NLRP3(P=0.002)表达;NOXS 抑制剂治疗组有效下调NOXS(P=0.002)、ROS(P<0.001)以及NLRP3(P=0.003)表达。进一步检测炎性因子的表达水平显示,与空白组比较,DPN模型组促炎因子TNF-α(P<0.001)以及IL-6(P=0.009)表达升高,抑炎因子TGF-β(P<0.001)表达下降。与DPN模型组比较,獐牙菜苦苷治疗组促炎因子TNF-α(P=0.03)和IL-6(P=0.002)表达下降,抑炎因子TGF-β(P=0.04)表达升高;且NOXS抑制剂治疗组促炎因子TNF-α(P=0.001)和IL-6(P=0.04)表达下降,抑炎因子TGF-β(P=0.006)表达升高。两个治疗组间各因子表达差异无统计学意义(P>0.05,图2)。
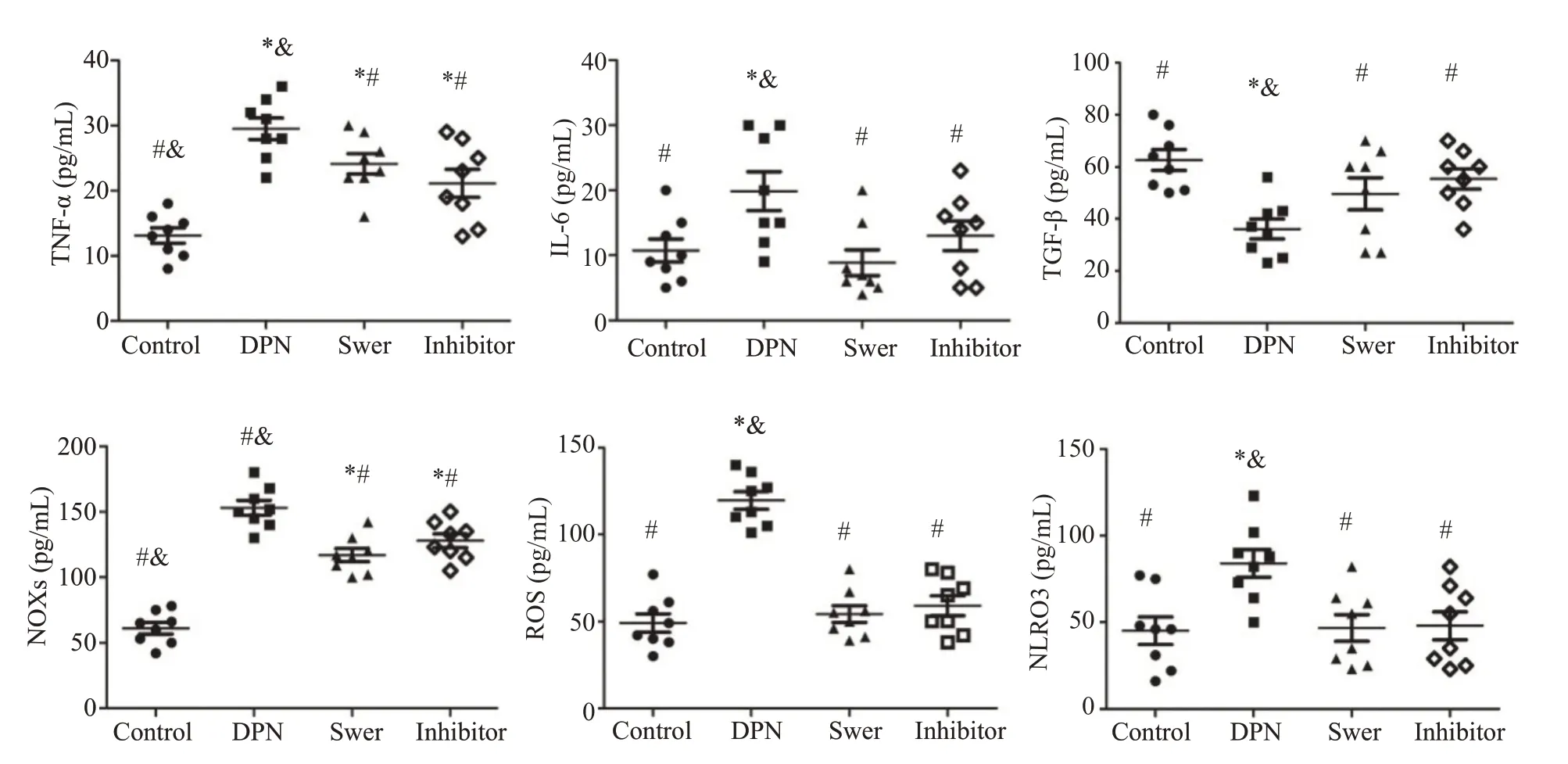
图2 各组NOXS/ROS/NLRP3通路及炎性因子的表达比较Fig.2 Expressions of NOXs,ROS,NLRP3 and inflammatory factors in each group.*P<0.05 vs control group;#P<0.05 vs DPN group;&P<0.05 vs swer group.
2.4 各组大鼠脊髓组织的NOXS/ROS/NLRP3通路的表达比较
与空白对照组比较,DPN模型组大鼠NOXS、ROS以及NLRP3的蛋白表达水平升高(P<0.001)。与DPN模型组比较,獐牙菜苦苷组有效抑制NOXS(P<0.001)、ROS(P=0.006)以及NLRP3(P<0.001)的表达;NOXS抑制剂组有效抑制NOXS(P<0.001)、ROS(P=0.005)以及NLRP3(P<0.001)的表达。獐牙菜苦苷治疗组与NOXS抑制剂治疗组组间各因子的表达水平差异无统计学意义(P>0.05,图3)。

图3 各组大鼠脊髓腰膨大组织的NOXS/ROS/NLRP3通路表达比较Fig.3 Expressions of NOXs,ROS,and NLRP3 in the spinal cord of rats in each group.*P<0.05 vs control group;#P<0.05 vs DPN group;&P<0.05 vs swer group.
3 讨论
本研究结果证实,獐牙菜苦苷能有效提高DPN大鼠触觉过敏压力阈值,减少触觉过敏,有效保护神经。DPN模型组促炎因子表达升高,抑炎因子表达下降。獐牙菜苦苷治疗组和NOXS抑制剂治疗组促炎因子表达低于DPN 模型组,抑炎因子表达则高于DPN 模型组。本研究结果提示,獐牙菜苦苷和NOXS抑制剂均有效下调促炎因子,上调抑炎因子,维持炎性因子平衡。
獐牙菜苦苷是多种龙胆科草药的主要活性成分之一[10-11]。有研究证实,獐牙菜苦苷与槲皮素合用对链脲佐菌素诱导的2型糖尿病大鼠高血糖、高脂血症和氧化应激具有显著的治疗作用[12]。有研究认为,獐牙菜苦苷通过激活AMPK,从而恢复肝细胞的胰岛素敏感性,可改善2型糖尿病患者的胰岛素抵抗效应[13]。有文献通过对獐牙菜苦苷及其衍生物的体外、体内研究,揭示了獐牙菜苦苷及其衍生物具有抗糖尿病和抗高脂血症的作用[14]。目前,国内学者对獐牙菜苦苷的药用研究主要集中在抗炎、护肝、祛风止痛等方面[15-17]。而本研究结果证实,獐牙菜苦苷能有效提高DPN大鼠触觉过敏压力阈值,提示獐牙菜苦苷可以减少触觉过敏,有效保护神经。该结果与国外其他学者结果类似[18]。本研究结果表明獐牙菜苦苷存在镇痛作用靶点,有望今后成为治疗DPN的药物。
DPN是由高血糖引起的氧化应激和炎症反应引起的神经组织损伤,这一损伤会过度产ROS以及NLRP3炎症小体,触发糖尿病炎症反应[19-20]。有研究证实,雷公藤多甙通过降低NOXs/ROS/NLRP3信号通路中促炎因子的表达,对溃疡性结肠炎具有抗炎作用[21]。有研究评价了罗根宁对高糖(25 mm)诱导的大鼠雪旺细胞系RSC96损伤的神经保护作用,发现罗根宁的抗氧化作用通过抑制ROS的产生和抑制NLRP3炎症小体的激活来防止RSC96雪旺细胞的凋亡[22]。有学者研究发现由ROS刺激生成的NLRP3,介导下游的促炎反应,从而加重慢性炎症反应对神经的损伤作用[23]。也有研究表明,外周神经受炎性因子的浸润,慢性炎症反应的存在极大影响正常神经功能的发挥[24-26]。在炎症状态下,促炎因子比如IL-6,IL-1以及TNF-α的级联释放,激活神经胶质细胞,胶质细胞本身表达这些促炎因子的受体,并且参与炎症的免疫反应。其次,促炎因子相互存在协同作用,进一步促进炎症的瀑布样反应。最后,释放性P物质以及兴奋性氨基酸持续释放,使背角神经元去极化,导致痛觉敏感以及持续性疼痛[27-30]。因此,本研究拟从与炎症反应息息相关的NOXS/ROS/NLRP3信号通路进一步明确獐芽菜苦苷影响炎症反应的具体分子机制。本课题组前期研究结果证实,DPN大鼠存在炎性因子表达失衡,表现为促炎因子TNF-α,IL-6和IL-8表达水平升高,抑炎因子IL-10和TGF-ß表达下降,而獐芽菜苦苷通过抑制促炎因子,促进抑炎因子的表达,纠正炎性因子失衡,治疗DPN大鼠[7-8]。本研究结果显示,獐牙菜苦苷有效抑制NOXS、ROS以及NLRP3的表达,同时显著降低DPN大鼠促炎因子TNF-α、IL-6水平,提高抑炎因子TGF-β水平。本研究进一步通过獐芽菜苦苷与NOXs抑制剂治疗DPN大鼠的效果进行比较,发现二者之间治疗效果相仿。本研究证实獐牙菜苦苷通过降低DPN大鼠脊髓组织的NOXS、ROS以及NLRP3的表达水平,来抑制NOXS/ROS/NLRP3炎性级联反应的信号通路,维持炎性因子平衡,提高痛阈,营养神经,达到治疗DPN的目的。
本研究存在一定的局限性,研究獐牙菜苦苷对于NOXS/ROS/NLRP3信号通路的影响仅在动物实验水平得到验证,尚需对离体细胞进行进一步实验。值得一提的是,尽管结果表明在对于NOXS/ROS/NLRP3信号通路的影响上獐牙菜苦苷与NOXS抑制剂治疗的差异无统计学意义,但是触觉过敏试验结果显示獐牙菜苦苷似乎在提高DPN痛觉压力阈值方面优于NOXS抑制剂。我们需进一步探索在等效药效的基础上比较二者的真正优劣,并研究相关机制,为DPN患者提供积极有效的防治以及低毒无害的药物新靶点。