胃癌黏膜组织miR-127、PALB2表达与临床特征及预后的相关性研究
2021-07-07陆霞娟蒋海峰马晶晶
陆霞娟,蒋海峰,马晶晶
上海市杨浦区控江医院消化内科,上海 200093
胃癌是现今世界上最常见的癌症之一,起源于胃部黏膜上皮的恶性肿瘤,具有高发病率、高病死率和预后差等特点,浸润程度、淋巴结转移等因素都是其致死因素。有研究发现,胃癌患者中有10%以上的病例显示出家族遗传史,人们至今仍为研究其潜在的机制及寻找生物标志物和治疗靶点而努力[1-2]。胃癌患者因多为晚期确诊,通常表现为预后不佳,因此,找到胃癌的诊断生物标志物及随访复查至关重要。越来越多的证据表明,微小RNA(miRNAs)在胃癌等各类癌症发生中具有重要作用,许多miRNAs已被作为治疗胃癌的潜在靶点[3-4]。近期有研究报道微小RNA-127(miR-127)可作为肿瘤抑制剂,抑制骨肉瘤细胞的增殖和迁移[5]。还有研究发现,miR-127可抑制胃癌的转移和侵袭[6]。乳腺癌易感基因相关蛋白2(PALB2)是一种乳腺癌基因,自2015年以来有多项研究为PALB2及其他参与同源重组DNA修复的基因在胃癌风险中的作用提供依据[7-8]。但关于miR-127和PALB2在胃癌黏膜组织中的表达水平与临床特征及预后相关性的研究鲜少报道。因此,本研究旨在探讨胃癌黏膜组织中miR-127、PALB2的表达与临床特征及预后的相关性,以期为胃癌的病情发展及预后监测提供有效依据,为进一步探讨胃癌的发生机制提供参考。
1 资料与方法
1.1一般资料 选取2013年3月至2015年7月本院收治且已确诊为胃癌患者120例作为研究对象,其中男67例、女53例,年龄34~82岁。纳入标准:(1)患者经镜检、活检等手段检查确诊(患者均为胃体部发生溃疡、结节隆起病变,少数表现为糜烂、菜花样肿物)[9],临床资料完整;(2)全部患者均进行手术切除治疗,术前未进行其他辅助性治疗。排除标准:(1)经内镜及活检确诊为食管胃交界部腺癌、原发性恶性淋巴瘤、胃肉瘤患者[9-10];(2)在近期进行过化疗或手术等治疗的胃癌患者;(3)患有其他免疫系统疾病患者。本研究通过本院伦理委员会批准,经患者和家属知情并签署同意书。
1.2仪器与试剂 高速低温离心机(JW-3021HR)购自嘉文设备有限公司;荧光定量PCR仪(LightCycler®96)购自上海罗氏诊断产品有限公司;全自动酶标仪(RT2100C)购自德国IFP公司。UltraSYBR Mixture(Low ROX)[货号:(CW0956)]购自康为世纪公司;RNA提取试剂盒(货号:DP441)购自北京天根生化有限公司;PrimeScriptTMRT Master Mix(货号:RR047AA)购自日本Takara公司。
1.3方法
1.3.1标本采集及保存 在手术中取研究对象胃癌黏膜组织和癌旁黏膜组织(>5 cm),用生理盐水清理干净,放入-80 ℃冰箱备用。
1.3.2胃癌黏膜组织和癌旁黏膜组织中miR-127、PALB2相对表达水平检测 使用RNA提取试剂盒(天根)提取出胃癌黏膜组织和癌旁黏膜组织总RNA后反转录成cDNA。以此为模板,采用实时荧光定量聚合酶链反应(qRT-PCR)检测标本中miR-127、PALB2相对表达水平。用U6、β-actin作为内参对mRNA标准化,通过2-ΔΔCt计算miR-127、PALB2相对表达水平。用Primer 6.0和Oligo 7软件设计引物,引物长度为18~22 bp,扩增长度100~300 bp,见表1,送华大基因进行合成,经10倍稀释备用。

表1 实时荧光定量 PCR 引物(5′-3′)
1.4随访 对出院患者进行为期5年的随访,以电话或复查形式记录患者预后生存情况。

2 结 果
2.1癌旁黏膜组织和胃癌黏膜组织中miR-127、PALB2相对表达水平比较 癌旁黏膜组织中miR-127相对表达水平高于胃癌黏膜组织,而PALB2相对表达水平则低于胃癌黏膜组织,差异有统计学意义(P<0.05),见表2。
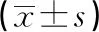
表2 癌旁黏膜组织和胃癌黏膜组织中miR-127、PALB2相对表达水平比较
2.2miR-127、PALB2相对表达水平与胃癌临床病理参数的关系 miR-127和PALB2相对表达水平分别以中位数0.23和2.02为标准,大于中位数为高表达组,低于或等于中位数为低表达组。由表3可知,两组胃癌黏膜组织中miR-127和PALB2相对表达水平在不同性别、分化程度、年龄和肿瘤大小间比较,差异无统计学意义(P>0.05),在淋巴结转移、浸润程度和TNM分期间比较差异有统计学意义(P<0.05)。

表3 miR-127、PALB2相对表达水平与胃癌临床病理参数的关系(n)
2.3miR-127、PALB2相对表达水平与胃癌患者预后的关系 miR-127、PALB2相对表达水平与胃癌患者生存状况的关系见图1、2。经过5年随访后,120例患者24例生存,96例死亡,生存率为20.00%。miR-127高表达组生存率为30.00%,miR-127低表达组生存率为10.00%,差异有统计学意义(P<0.05);PALB2低表达组生存率为31.67%,而PALB2高表达组生存率为8.33%,差异有统计学意义(P<0.05)。
2.4COX生存回归分析影响胃癌患者预后的因素 将淋巴结转移、TNM分期、浸润程度、PALB2相对表达水平和miR-127相对表达水平进行单因素COX生存回归分析,发现以上5个因素均对患者预后存在影响(P<0.05)。多因素分析发现,淋巴结转移、TNM分期、浸润程度、PALB2高表达和miR-127低表达均是影响胃癌患者预后的独立危险因素(P<0.05)。见表4。

注:1为高表达组;2为低表达组;3为高表达组-检剔后;4为低表达组-检剔后。

表4 胃癌患者预后的COX生存回归分析
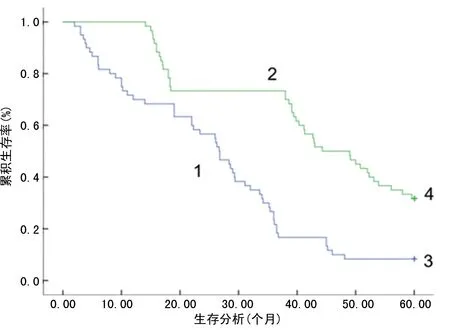
注:1为高表达组;2为低表达组;3为高表达组-检剔后;4为低表达组-检剔后。
3 讨 论
胃癌是除了肝癌和肺癌之外的第三大致命性癌症,因大多数患者患病晚期才得到确诊,导致预后不佳,因此病死率较高[11-12]。在解剖学上,胃癌分为胃腺癌和胃食管交界处腺癌,在组织学上可分为弥散型和肠型[11]。胃癌的患病风险因素有病毒感染、性别、年龄、饮酒史等,现今也有大量关于胃癌遗传性的研究,以期在胃癌预防和治疗方面取得突破性的进展[13]。张潇怡[14]在关于胃癌易感性和预后相关基因的研究中发现MSH6、MLH11和MUTHY等基因与胃癌的发生有关。
miRNAs是一种非编码的单链小分子RNA,在真核生物细胞中广泛存在,可在转录后水平调节基因表达,其表达异常可导致细胞异常分化和过度增殖,从而引发癌变[15]。彭洪等[16]研究表明,miR-127-5p高表达对结直肠癌细胞增殖起抑制作用,其在癌变组织中的表达水平低于正常组织。还有研究表明胃癌发生与miR-127的表达异常有关,通过蛋白印迹分析miR-127的表达发现,胃癌组织中其表达水平低于正常组织[17]。本研究结果发现,与癌旁黏膜组织相比,胃癌黏膜组织中miR-127相对表达水平降低,与上述研究结果一致。这表明miR-127可对胃癌的癌细胞起抑制作用,其表达降低可导致肿瘤细胞增殖[16]。此外,本研究还发现,胃癌黏膜组织中miR-127相对表达水平在性别、分化程度、年龄和肿瘤大小间比较,差异无统计学意义(P>0.05),在淋巴结转移、浸润程度和TNM分期间比较差异有统计学意义(P<0.05),这表明miR-127可影响胃癌的发生、发展。miR-127高表达组生存率为30.00%,miR-127低表达组生存率为10.00%,差异有统计学意义(P<0.05),且miR-127低表达是预后不良的独立危险因素。这表明miR-127可作为预后监测指标用以跟踪病情发展状况。
PALB2是一种乳腺癌基因,其突变可增加患乳腺癌的风险[18-19]。还有研究表明PALB2会增加患胃癌的风险,是一种癌症易感基因[8]。本研究结果发现,与癌旁黏膜组织相比,胃癌黏膜组织中PALB2相对表达水平增加,并且PALB2相对表达水平在淋巴结转移、浸润程度和TNM分期间比较,差异有统计学意义(P<0.05)。这表明其相对表达水平增加可致使肿瘤的发生。PALB2低表达组生存率为31.67%,而PALB2高表达组生存率为8.33%,差异有统计学意义(P<0.05)。多因素分析发现,PALB2高表达是影响预后的独立危险因素。以上结果表明,PALB2作为新的家族性胃癌基因,可对胃癌的治疗和预防重要作用。
综上所述,本研究发现胃癌黏膜组织miR-127低表达、PALB2高表达,二者与临床特征密切相关,且PALB2高表达和miR-127低表达均是影响胃癌患者预后的独立危险因素。以上结果表明,miR-127、PALB2具有作为胃癌患者预后不良生物标志物的潜在能力,但两者在胃癌中的详细作用机制还需进一步研究。