PDCD5、NRP1表达与NSCLC患者化疗效果及预后的关系
2021-07-07付群
付 群
肿瘤调控蛋白的改变,能够在NSCLC的发生或者病情进展过程中发挥作用。程序化死亡因子5(PDCD5)是凋亡诱导相关蛋白,能够通过诱导程序性凋亡因子的激活,促进癌细胞的凋亡,最终促进肿瘤病灶的萎缩[1];神经纤毛蛋白1(NRP1)是基因调控相关因子,能够通过提高癌细胞的变形和浸润能力,促进肿瘤细胞的异常增殖,加剧癌细胞的上皮-间质浸润和转移过程[2]。本次研究主要探讨PDCD5、NRP1的表达与NSCLC患者的病情及治疗结局的关系,为临床上NSCLC的诊疗及临床预后预测提供参考。
1 材料与方法
1.1 一般资料
选取2015年1月到2018年11月在我院治疗的NSCLC患者102例作为NSCLC组,纳入标准:①均经病理学确诊;②临床分期为Ⅲ~Ⅳ期;③ECOG功能状态评分0~2分;④具有客观测量的病灶;⑤在我院接受以顺铂为基础的化疗方案;⑥临床随访资料完整。排除标准:①非初治患者;②合并有其他系统恶性肿瘤;③组织获取前有放化疗等抗肿瘤治疗。同时选取正常肺组织50例作为对照组。NSCLC组男性62例、女性40例,平均年龄(54.49±9.28)岁;对照组男性30例、女性20例,平均年龄(53.17±10.00)岁。2组性别、年龄比较,差异无统计学意义(P>0.05)。
1.2 实验方法
采用石蜡切片,脱水操作后采用3%H2O2室温条件下孵育20 min,磷酸盐缓冲液清洗3次,每次5 min,磷酸盐缓冲液稀释后的山羊血清封闭抗体5 min,倒去血清后不清洗,加入一抗(购自赛默飞世尔中国,浓度:1∶1000)5 ml,37 ℃孵育2 h,或者放置4 ℃冰箱过夜孵育,磷酸盐缓冲液清洗3次,每次5 min,加入生物素荧光标记的二抗(购自赛默飞世尔中国,浓度:1∶2000)3 ml,37 ℃孵育20~30 min,磷酸盐缓冲液清洗3次,每次5 min,加入Streptavidin/HRP辣根酶标记链霉卵白素,37 ℃孵育20~30 min,磷酸盐缓冲液清洗3次,每次5 min,增强型HRP-DAB底物显色试剂盒 (PA110)显色,自来水冲洗,复染,封片。
1.3 化疗方法
吉西他滨化疗,1 000 mg/m2,第1、8天;顺铂注射液,20 mg/m2,第1~5天,连续治疗28 d为1个周期,连续治疗3个周期。
1.4 疗效判断
治疗2个周期后,依据RECIST1.1实体瘤疗效评价标准[3],完全缓解(CR)为病灶消失,且至少维持4周;部分缓解(PR)为病灶最大径之和减少≥30%,至少维持4周;疾病稳定(SD)为病灶最大径之和减小未达到PR或增大未达到PD;疾病进展(PD)的病灶最大径之和增加≥20%或出现新病灶。治疗有效=CR+PR。
1.5 免疫组化染色结果判断标准
在高倍镜下,对每张切片随机选取5个视野,每个视野计数20个,共计100个,对染色强度和阳性细胞比例进行评价,染色强度:无着色为0分,淡黄色为1分,黄色为2分,棕褐色为3分,阳性细胞比例:≤10%为0分,>10%~25%为1分,>25%~50%为2分,>50%~75%为3分,>75%为4分。染色强度和阳性细胞比例得分之和≥3分为阳性表达。
1.6 统计学处理
2 结果
2.1 NSCLC组和对照组PDCD5、NRP1表达比较
NSCLC组PDCD5阳性表达率明显低于对照组(P<0.05),而NRP1阳性表达率明显高于对照组(P<0.05)。见表1。

表1 NSCLC组和对照组PDCD5、NRP1表达比较(例,%)
2.2 PDCD5、NRP1表达与NSCLC临床病理特征关系
TNM分期Ⅳ期、中低分化患者PDCD5阳性表达率明显低于Ⅲ期和高分化患者(P<0.05);腺癌、TNM分期Ⅳ期患者NRP1阳性表达率明显高于鳞癌、Ⅲ期患者(P<0.05)。见表2。

表2 PDCD5、NRP1表达与临床病理特征关系(例,%)
2.3 化疗有效和无效患者PDCD5、NRP1表达率比较
化疗有效患者PDCD5阳性表达率明显高于无效患者(P<0.05),而NRP1阳性表达率明显低于无效患者(P<0.05)。见表3。
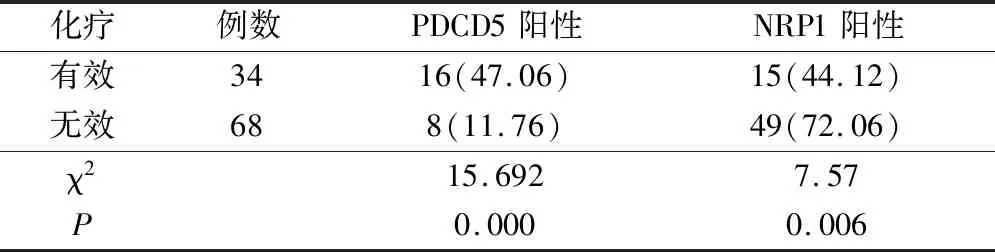
表3 化疗有效和无效患者PDCD5、NRP1表达率比较(例,%)
2.4 PDCD5、NRP1表达与预后的关系
PDCD5阳性表达患者中位总生存时间为22个月(95%CI:21.07~22.93),明显高于PDCD5阴性表达患者的12个月(95%CI:21.07~22.93),差异比较有统计学意义(χ2=36.716,P<0.05);NRP1阳性表达患者中位总生存时间为12个月(95%CI:16.74~21.27),明显低于NRP1阴性表达患者的19个月(95%CI:16.74~21.27),差异比较有统计学意义(χ2=33.327,P<0.05);见图1。

图1 生存曲线
3 讨论
不同内外因素导致的肺泡上皮细胞的异常病变,都会提高癌细胞的早期发生风险,同时在癌基因突变或者合并其他高危因素的群体中,NSCLC的发病率可持续上升[4]。临床上的观察分析发现,NSCLC患者的5年生存率或者3年生存率均显著下降,NSCLC的致残率明显上升[5]。辅助化疗能够在NSCLC的整体性治疗过程中发挥作用,通过静脉化疗能够显著促进肺癌肿瘤病灶的萎缩,改善NSCLC患者的高肿瘤临床负荷。但现阶段缺乏对于NSCLC临床预后评估的重要方式,影像学检查能够在NSCLC的诊疗过程中发挥作用,但影像学检查评估NSCLC的滞后性较为明显,其对于肺癌患者临床预后评估的可参考性较低。血清糖链蛋白199或者其他上皮糖链蛋白,能够在NSCLC的临床预后转归评估中发挥作用,但糖链蛋白199或者癌胚抗原等评估NSCLC临床预后或者化疗效果的符合率较低,同时癌胚抗原等指标检测的稳定性较差,检测的干扰因素较多。
PDCD5是程序性凋亡相关因子,主要表达于肿瘤细胞间质组织、内皮组织及神经未分化组织中。PDCD5蛋白结构上含有的可结合的脯氨酸结合区域,能够通过影响到癌细胞转录上游启动子的激活,最终促进癌细胞的凋亡[6];NRP1是癌细胞生物学行为调控因子,能够影响到癌细胞的变形能力,促进癌细胞浸润和粘附能力的改变[7]。有部分研究者探讨了PDCD5在肺癌患者中的表达情况,认为在肺癌患者中,PDCD5蛋白的表达阳性率明显下降[8],但对于PDCD5、NRP1的表达与肺癌化疗效果的关系分析不足。
本次研究通过对肺癌患者病灶组织中PDCD5、NRP1的分析,可以发现在NSCLC患者病灶组织中,PDCD5蛋白的阳性表达率明显下降,而NRP1蛋白的阳性表达率明显上升,PDCD5、NRP1的异常表达趋势提示二者可能在NSCLC的病情进展过程中发挥了重要作用。之所以存在PDCD5、NRP1的差异性表达,主要由于肺癌腺体上皮癌细胞肿瘤微环境的改变,影响到了肿瘤细胞的转录、凋亡及增殖调控过程,导致血管调控蛋白分泌的紊乱[9]。有其他研究者也发现,在肺癌患者病灶组织中,NRP1蛋白的阳性表达率可超过40%以上,在非小细胞肺癌患者中,NRP1蛋白的阳性表达率可随着非小细胞肺癌临床结局的恶化而上升[10]。在临床分期较晚或者癌细胞分化程度较差的肺癌中,PDCD5蛋白的阳性表达率较低,提示了PDCD5蛋白的表达缺失能够影响到肺癌患者的临床病理特征的进展。这主要由于PDCD5蛋白的下降,失去了对于癌细胞凋亡蛋白BCL或者BAX的诱导作用,导致肺癌细胞凋亡比例的下降,促进了癌细胞的浸润和转移进展。在腺癌或者临床分期较晚的患者中,NRP1蛋白的阳性表达率较高,提示了NRP1蛋白能够显著影响到肺癌患者临床病理特征的进展。这主要由于NRP1蛋白的表达上升,能够影响到癌细胞内信号通路MAPK的激活,促进了癌细胞浸润范围的增加,进而导致临床分期的进展。在化疗有效的患者中,PDCD5蛋白的阳性率较高,而NRP1的阳性率较低;在PDCD5阳性表达的患者中,肺癌患者的中位生存时间较长,而NRP1阳性表达的患者,其中位生存时间较短,提示了PDCD5的阳性表达能够改善肺癌患者的临床结局,而NRP1的阳性表达能够加剧肺癌临床预后的恶化。临床上可以通过检测PDCD5、NRP1蛋白,评估肺癌患者的临床预后。
NSCLC是肺癌的重要分型之一,但既往的研究往往集中分析本病的治疗方法,对本病癌细胞凋亡及生物学行为影响因子的研究较少。而本组研究的优势在于发现了PDCD5、NRP1可通过影响NSCLC癌细胞凋亡及生物学行为来参与本病发生、发展,并可一定程度上提示患者病情、治疗疗效及预后。
综上所述,NSCLC患者PDCD5表达降低,而NRP1表达升高,与病理类型、TNM分期及分化程度有一定关系,同时对化疗疗效和预后有一定影响。
