孤雌产雌生殖品系松毛虫赤眼蜂产卵强度对Wolbachia诱导的其生殖表型的影响
2021-07-07霍梁霄李媛媛宁素芳周金成
霍梁霄, 李媛媛, 张 丹, 于 茜, 宁素芳,赵 旭, 周金成,*, 董 辉,*
(1.沈阳农业大学植物保护学院, 沈阳 110866; 2.辽宁省农业发展服务中心, 沈阳 110034)
沃尔巴克氏体Wolbachia是一类广泛存在于节肢动物中并能够随母系遗传的胞内共生菌(Werrenetal., 2008; Gerthetal., 2014),可调控宿主的生殖表型,如细胞质不亲和(cytoplasmic incompatibility, CI)、雌性化(feminization)、杀雄(male-killing, MK)、孤雌产雌生殖(parthenogenesis, PI)等(Werrenetal., 2008)。此外,Wolbachia还参与到宿主卵子的形成过程(Kremeretal., 2009),增强宿主的免疫反应(Chrosteketal., 2013),阻断病原物感染宿主,以及为宿主提供营养物质(Moriyamaetal., 2015)。开展Wolbachia对宿主生殖及其他表型的调控研究和揭示共生菌与宿主间的互作关系具有重要意义,相关理论和方法对控制害虫种群和各类虫媒传播疾病也具有重要的应用价值(Hoffmannetal., 2015; 张艳凯等, 2015; Lopezmadrigal and Duarte, 2019)。
Wolbachia诱导宿主的生殖表型受Wolbachia滴度影响(Zchorifeinetal., 2000; Stouthamer and Mak, 2002; Uncklessetal., 2009; Osbomeetal., 2012; Baiãoetal., 2019)。例如,在寄生蜂中,当卵内的Wolbachia滴度足够高时才发生孤雌产雌生殖的两步机制(未受精卵先二倍化后雌性化的过程)(Maetal., 2015)。然而,宿主生殖表型与Wolbachia滴度之间的分子机制目前还不明确。
据报道,Wolbachia诱导多种膜翅目蜂类发生孤雌产雌生殖(张海燕, 2009; Ma and Schwander, 2017)。研究发现,前人通过抗生素或高温去除或降低孤雌产雌生殖宿主体内的Wolbachia滴度,导致子代雄性个体或间性个体增多(Stouthamer and Mak, 2002; De Almeidaetal., 2010; Ningetal., 2019; 霍梁霄等, 2020)。这类研究发现Wolbachia滴度随温度(25~31℃)的升高或抗生素浓度的增加而降低(童蕾蕾等, 2012; 陈茜等, 2016; 宁素芳, 2017; Wangetal., 2017; Zhouetal., 2019)。这表明Wolbachia感染存在一个“阈值”对于调控宿主的生殖表型具有重要作用(Hurstetal., 2000; Bordenstein and Bordenstein, 2011),且Wolbachia滴度与诱导宿主的表型呈现正相关关系(Breeuwer and Werren, 1993; Bourtzisetal., 1996; Ikedaetal., 2003)。本研究前期发现,无高温和抗生素处理条件下,感染Wolbachia且营孤雌产雌生殖的松毛虫赤眼蜂Trichogrammadendrolimi后代也会出现雄蜂个体。我们推测雌蜂高频率的产卵将影响Wolbachia向子代的垂直传播效率及滴度。开展该方面的研究不仅对Wolbachia与宿主之间的相互作用具有理论意义,也对应用孤雌产雌品系赤眼蜂,保障其生殖表型稳定性及生防潜力具有实践意义。
松毛虫赤眼蜂是一种寄生多种鳞翅目昆虫的卵期寄生性天敌,对松毛虫Deudrolimuspunctatus、亚洲玉米螟Ostriniafurnacalis和二化螟Chilosuppressalis等多种农林业重要的害虫具有良好的生物防治效果(Wangetal., 2014; Lietal., 2016; 姜雪冰等, 2020)。与两性生殖赤眼蜂相比,由于子代几乎全为雌性,孤雌产雌生殖的赤眼蜂具有增殖能力强、易于定殖、生产成本低等优势,因而具有较高的控害潜能(Stouthamer, 1993; Dongetal., 2017)。先前研究表明限制寄主卵量或控制雌蜂寄生时间导致子代雄性比降低(Hohmannetal., 2001; Lindsey and Stouthamer, 2017)。本研究以孤雌产雌生殖的松毛虫赤眼蜂为研究对象,明确雌蜂产卵强度对Wolbachia滴度及子代性比的影响。研究结果将为孤雌产雌松毛虫赤眼蜂的工厂化繁育提供理论依据,并为揭示宿主不同产卵强度下Wolbachia-宿主赤眼蜂的相互作用提供参考。
1 材料与方法
1.1 供试昆虫
供试松毛虫赤眼蜂来自于沈阳农业大学害虫生防实验室繁育的松毛虫赤眼蜂孤雌产雌品系。供试松毛虫赤眼蜂均以米蛾Corcyracephalonica卵为寄主,保种繁育30代以上,遗传性状稳定。繁育环境条件:温度25±1℃,相对湿度70%±5%,光周期16L∶8D。
寄主米蛾在养虫室内用麦麸繁育多代,繁育环境条件:25±1℃, 相对湿度70%±5%, 光周期16L∶8D。试验前取新鲜的米蛾卵(<24 h)粘在涂有阿拉伯树胶的白色纸卡上,制成米蛾卵卡。米蛾卵卡用紫外灯照射处理40 min,杀死胚胎,供松毛虫赤眼蜂寄生。
1.2 松毛虫赤眼蜂的处理
为避免羽化后的赤眼蜂子代之间交配,预先将米蛾卵卡上的单个寄主黑卵粒(寄生4~5日后变黑的米蛾卵)切下后转移至10 mm×45 mm指型管。随机选取刚羽化(<12 h)的雌蜂作为供试蜂,每管1头蜂。每头雌蜂按下列分组分别进行处理:处理1:每日只有1 h提供新鲜充足的米蛾卵卡,供雌蜂寄生,持续7 d;处理2:隔日全天24 h提供新鲜充足的米蛾卵卡,供雌蜂寄生,持续7 d;处理3:每日持续提供新鲜充足的米蛾卵卡,供雌蜂连续寄生,持续7 d;对照组:每日只提供10%蜂蜜水不提供卵卡,持续7 d,该组雌蜂仅用于测定体内共生菌滴度。每处理和对照组45头雌蜂,即重复45次。每天在同一时间段(9:00-10:00)对处理1的雌蜂提供充足新鲜米蛾卵卡。米蛾卵卡在处理条件下的雌蜂寄生完成之后,被分离到单个管中,避免再次被寄生。各处理和对照组的雌蜂每天均提供10%蜂蜜水。第8天,各处理雌蜂以液氮冷冻杀死后,以无水乙醇在-20℃下保存于1.5 mL离心管备用。统计母代雌蜂逐日产卵量(寄主米蛾卵变黑记为寄生),一周内的累积产卵量。根据赤眼蜂的触角形态和外生殖器鉴定雌性个体,雄性个体及雌雄间性个体(指个体组织拥有相同遗传基因,但组织呈现出雄性和雌性的中间特征)(Ningetal., 2019)。待所有被寄生的米蛾卵内的子代蜂羽化后,在体视解剖显微镜(Motic, SMZ-161)下观察并记录子代性别及个数,统计逐日子代雄性比和一周内的累积子代雄性比。
1.3 雌蜂体内Wolbachia滴度分析
采用Chelex-100法对待测的松毛虫赤眼蜂进行单头总DNA的提取(Sumeretal., 2009; 柳晓利等, 2011)。以共生菌Wolbachia的wsp基因(GenBank登录号: MG914000)拷贝数对雌蜂体内Wolbachia感染滴度进行定量分析。利用Primer Premier 5.0设计wsp基因特异性引物(上游引物: 5′-ATGAT GTAGCCCCAGAAATAC-3′; 下游引物: 5′-ACCAA AAGTGTTGTAAAGAA-3′)。以2 μL DNA样品为初始模板,加入2×Es Taq Matermix(康维世纪, 北京)25 μL,上下游引物(10 μmol/L)各1 μL, ddH2O 21 μL共50 μL作为PCR扩增体系。PCR反应程序: 94℃预变性3 min; 然后以94℃ 变性30 s, 57℃退火3 min, 72℃延伸30 s为基础,循环40次;最后以72℃延伸10 min。扩增产物经1%琼脂糖凝胶电泳后,将预期目的条带回收纯化后,送生工生物工程(上海)股份有限公司进行双向测序验证。
采用SYBR Green荧光染料法,利用Bio-Rad CFX96TM实时荧光定量PCR仪(Bio-Rad, 美国)进行绝对定量(absolute quantitative PCR, AQ-PCR)检测。通过qPCR检测梯度稀释后目标序列引物CT值,计算标准曲线用于目标序列的绝对定量。以未产卵的雌蜂为对照,选择了最具有代表性的不同产卵强度处理组(处理1和处理3),每组设6个生物学重复,通过检测wsp基因拷贝数确定雌蜂体内Wolbachia滴度,每重复测量3次,作为技术重复。
AQ-PCR的扩增体系(20 μL): 2×GoTaq qPCR Master Mix(Promega, 美国)10 μL,正向和反向引物(10 μmol/L)各0.5 μL,DNA模板(40 ng)1 μL,ddH2O 8 μL。qPCR扩增条件: 95℃预变性5 min; 5℃变性15 s, 55℃退火延伸45 s, 共40个循环。并在最后添加溶解曲线程序: 55℃ 5 s, 每5 s升温0.5℃, 直至95℃。
1.4 数据分析
采用广义混合效应模型(generalized linear mixed-effects model, GLMM)下的协方差分析,检验不同产卵强度处理下雌蜂日龄对逐日子代雄性比[二项分布(binomial distribution)]和母代雌蜂逐日产卵量[泊松分布(Poisson distribution)]的影响。采用GLMM下的卡方测验分别检验产卵强度对累积子代雄性比(二项分布)、母代雌蜂累积产卵量(泊松分布)以及母代雌蜂体内Wolbachia滴度的影响。为了排除不同雌蜂个体及批次导致的系统误差,在GLMM中,将不同雌蜂个体及批次设为随机效应。采用Breusch-Pagan检验对模型的正态性和方差一致性假定进行检验,其中,对不符合假定的比例指标和整数指标,分别采用对数连接函数和logit连接函数转换后进行分析。不同处理因素间的多重比较采用Tukey氏HSD法检验(α=0.05)。本试验数据均采用R(3.6.2)软件(R Developmental Core Team, 2019)分析。
2 结果
2.1 逐日子代雄性比和累积子代雄性比
雌蜂产卵强度(χ2=24.21,P<0.05)和日龄(χ2=110.30,P<0.05)均对松毛虫赤眼蜂逐日子代雄性比存在显著影响,但二者互作对逐日子代雄性比无显著影响(χ2=2.01,P=0.37)。逐日子代雄性比随赤眼蜂日龄的增加显著升高(斜率±标准误: 1.51±0.14,P<0.05)。持续供寄主卵的雌蜂(处理3)逐日子代雄性比显著高于隔日24 h供寄主卵的雌蜂(处理2)(z=2.93,P<0.05)和每日仅1 h供寄主卵的雌蜂(处理1)(z=4.75,P<0.05),而处理2逐日子代雄性比与处理1相比无显著差异(z=-2.208,P=0.07)(图1)。
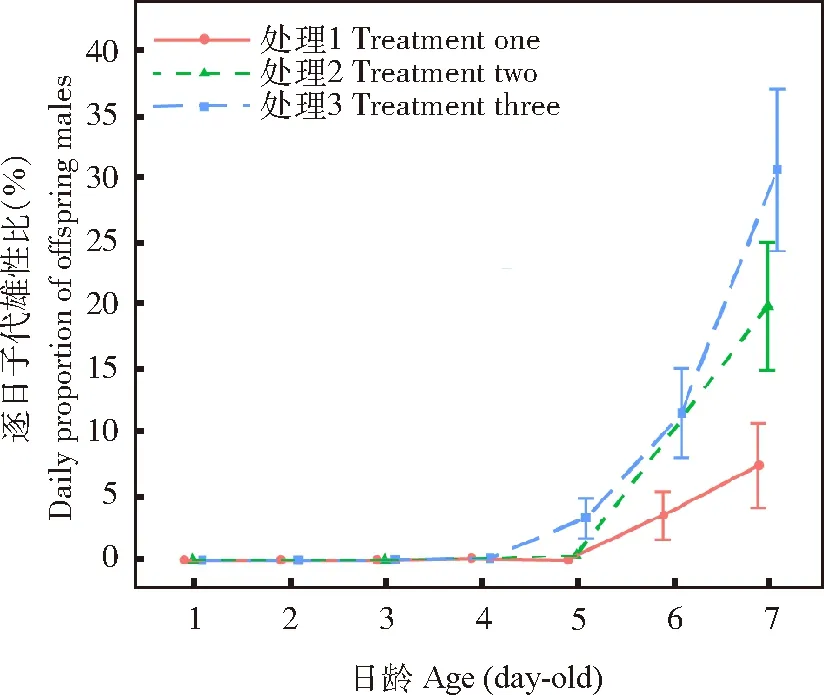
图1 产卵强度和日龄对松毛虫赤眼蜂逐日子代雄性比的影响
雌蜂产卵强度对松毛虫赤眼蜂累积子代雄性比存在显著影响(χ2=10.11,P<0.05)。处理3累积子代雄性比显著高于处理1(z=2.85,P<0.05);处理2累积子代雄性比与处理3间相比无显著差异(z=2.05,P=0.10),与处理1之间也无显著差异(z=-0.85,P=0.675)(图2)。
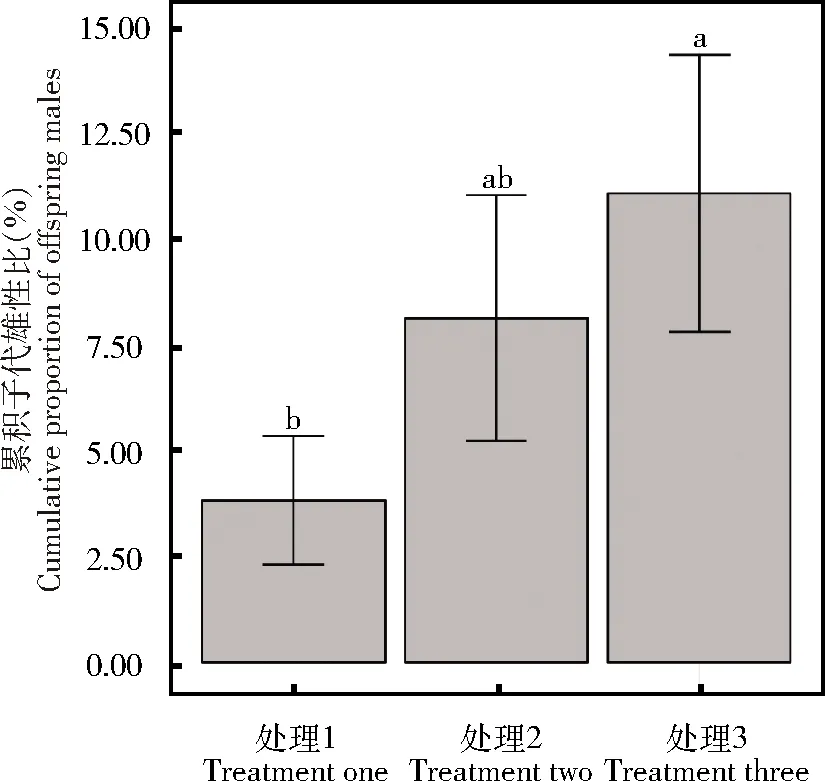
图2 产卵强度对松毛虫赤眼蜂累积子代雄性比的影响
2.2 母代雌蜂逐日产卵量和累积产卵量
松毛虫赤眼蜂母代雌蜂逐日产卵量受雌蜂产卵强度和日龄二者的交互作用显著影响(χ2=202.43,P<0.05)。母代雌蜂逐日产卵量随赤眼蜂日龄的增加均显著降低(斜率±标准误:-0.68±0.016,P<0.05)。处理3母代雌蜂逐日产卵量的下降幅度显著高于处理2(z=7.22,P<0.05)和处理1(z=15.18,P<0.05)。处理2母代雌蜂逐日产卵量下降幅度显著高于处理1(z=9.64,P<0.05)(图3)。

图3 产卵强度和日龄对松毛虫赤眼蜂逐日产卵量的影响
雌蜂产卵强度对松毛虫赤眼蜂母代雌蜂累积产卵量存在显著影响(χ2=41.22,P<0.05)。处理3母代雌蜂累积产卵量显著高于处理1(z=4.34,P<0.05)和处理2(z=6.22,P<0.05),处理1母代雌蜂累积产卵量与处理2间无显著差异(z=1.88,P=0.15)(图4)。
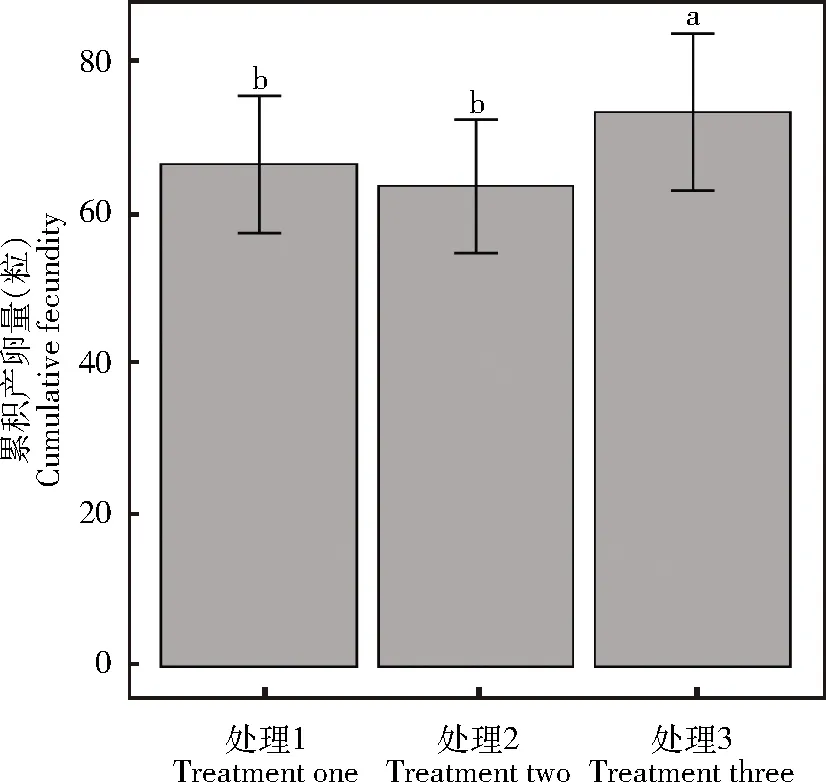
图4 产卵强度对松毛虫赤眼蜂累积产卵量的影响
2.3 母代雌蜂体内Wolbachia滴度
根据子代雄性比结果,处理2与处理3和处理1相比均无显著差异,且获取处理2雌蜂样本时间无法确定。因此,我们选择了最具有代表性两组处理,分别为处理3和处理1,并以未产卵的雌蜂为对照组,利用qPCR检测雌蜂体内Wolbachia滴度变化。
雌蜂产卵强度对松毛虫赤眼蜂母代雌蜂体内的Wolbachia滴度存在显著影响(χ2=75.12,P<0.05)。未产卵雌蜂体内Wolbachia滴度显著高于处理1(z=8.24,P<0.05),而与处理3相比无显著差异(z=1.34,P=0.37)(图5)。
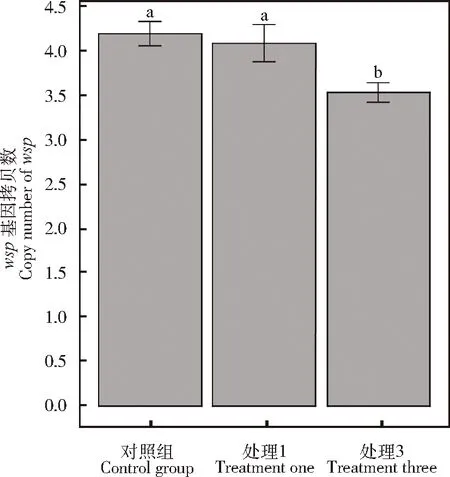
图5 产卵强度对松毛虫赤眼蜂体内Wolbachia滴度的影响
3 讨论
研究结果发现,每日仅1 h供寄主卵处理能够维持母代雌蜂体内Wolbachia滴度不变,使其维持孤雌产雌生殖表型。Lindsey和Stouthamer(2017)在研究短管赤眼蜂T.pretiosum时,也发现类似现象。有学者推测,宿主体细胞中的Wolbachia可持续转移至卵细胞中,以维持卵细胞内较高水平的Wolbachia滴度(Ferreeetal., 2005; Serbusetal., 2008)。当母代雌蜂连续产卵时,卵细胞对体细胞内Wolbachia持续“提取”,最终导致赤眼蜂体内Wolbachia“枯竭”。因此当赤眼蜂体内Wolbachia滴度下降时,雌蜂在产卵后期会产出Wolbachia滴度较低的卵。一般而言,赤眼蜂的性别由其染色体倍性决定,即双倍体受精卵发育为雌蜂,单倍体未受精卵发育为雄蜂(潘雪红等, 2007; Ma and Schwander, 2017)。在赤眼蜂中,Wolbachia可诱导单倍体未受精卵第一次有丝分裂后期染色体分离失败,导致染色体加倍形成二倍体胚胎,进而发育为雌性(Stouthamer and Kazmer, 1994)。当Wolbachia滴度降低时,其对宿主生殖表型的调控能力下降,使部分宿主恢复两性生殖。另一方面,共生菌Wolbachia滴度受宿主细胞增殖的影响(张晓晨和冯纪年, 2018)。在持续供寄主卵处理中,Wolbachia的恢复速度可能落后于生殖干细胞的更新速度,导致母代雌蜂产下的卵内Wolbachia滴度不足以调控宿主未受精卵染色体加倍,使其依然维持单倍体,并最终发育为雄性。因此,通过控制雌蜂产卵的间隔时间,使卵细胞内保持较高水平的Wolbachia滴度,可使雌蜂有效维持孤雌产雌生殖表型。
本研究发现,松毛虫赤眼蜂母代雌蜂逐日产卵量受产卵强度和日龄互作的影响。持续供寄主卵的母代雌蜂只有在第1日的日产卵量显著高于每日仅1 h供寄主卵的母代雌蜂,而在随后6 d,两者的日产卵量无显著差异。由于赤眼蜂卵巢内部分卵需通过雌蜂摄取外界补充营养来保障卵子发育成熟(黄静等, 2015)。母代雌蜂在第1日产出大量的卵,而后期卵子尚未成熟,使雌蜂后期的日产卵量下降。研究结果还发现,持续供寄主卵的母代雌蜂累积产卵量高于隔日24 h供寄主卵的雌蜂(图3)。该结果与前人研究(Stouthamer and Luck, 1993; Hohmannetal., 2001)不同。这可能是由不同的蜂卵接触时间造成的,持续供寄主卵处理使母代雌蜂寄生时间充分,因而具有较高的累积产卵量。基于本研究结果,在赤眼蜂规模化繁育过程中应适当权衡产雌率与繁蜂效率间的矛盾,在保障繁蜂数量的同时,适当降低雌蜂产卵强度,将有助于提高子代雌性比,降低繁蜂成本,提高繁蜂效率。在孤雌产雌品系赤眼蜂规模化繁育环节上,可考虑进一步开展相关研究,通过平衡繁蜂数量和雌性比两者间的矛盾,改善规模化繁蜂过程中的相关环节。
前人证明,孤雌产雌赤眼蜂种群与两性生殖赤眼蜂种群在野外同时存在,且两者间存在基因交流,即感染Wolbachia的雌蜂能够与雄蜂交配育出杂交的可育子代蜂(Stouthamer and Kazmer, 1994)。在本研究中,感染Wolbachia的母代雌蜂产卵后期子代雄性比显著升高(图2)。雄蜂的出现将使孤雌产雌种群与两性种群存在基因流动的可能。在田间,寄主卵资源通常具有波动性(Kunte, 1997; Royetal., 2001; van den Bosch, 2003)。基于本研究的结果,我们提出猜想,即当寄主资源丰富时,雌蜂更容易找到寄主,产卵强度增加,导致孤雌产雌生殖的雌蜂在产卵后期产出少量雄性子代,可能将使孤雌产雌种群与两性种群间基因交流的频率上升,而寄主资源有限时,雌蜂可能花费更长时间寻找新的寄主,产卵间隔时间延长,产卵强度降低,将更有利于其维持孤雌产雌生殖表型。然而,关于田间孤雌产雌种群与两性种群间的基因交流频率及其潜在影响因素尚需田间调查数据的支撑。
本研究结果及前人研究均发现成蜂体内Wolbachia滴度对于维持其孤雌产雌生殖表型至关重要(Maetal., 2015; Lopezmadrigal and Duarte, 2019)。持续产卵将导致母代雌蜂体内Wolbachia滴度降低,使得Wolbachia调控染色体二倍化过程难以维持,导致孤雌产雌生殖表型部分丧失,最终育出一定数量的雄性子代。当规模化繁育孤雌产雌生殖的松毛虫赤眼蜂时,通过适当减少雌蜂产卵频率和时间,可有助于维持雌蜂体内的Wolbachia滴度水平,提高雌蜂孤雌产雌生殖的稳定性,增加种群雌性比。另一方面,本研究通过室内测定产卵强度对雌蜂孤雌产雌表型的影响,将有助于揭示孤雌产雌生殖雌蜂产卵行为影响下的子代性别结构变化,为预测孤雌产雌赤眼蜂在田间的种群性别结构动态变化,揭示孤雌产雌种群和两性生殖种群间的共存及互作关系提供依据,为评估和改善孤雌产雌品系赤眼蜂的室内繁育技术和田间持续控害能力提供参考。
