尿崩症并垂体柄增粗2例
2021-07-07高楚淇马晓群朱本章吴晓燕
吴 远,高楚淇,马晓群,文 娟,崔 莉,朱本章,吴晓燕,王 毅
1. 西安交通大学第一附属医院内分泌代谢科(西安 710061)
2. 吴忠市人民医院内分泌科(宁夏吴忠 750000)
3. 旬阳县医院内一科(陕西安康 725700)
4. 甘肃酒钢医院内分泌科(甘肃嘉峪关 735100)
在垂体磁共振成像(magnetic resonance imaging,MRI)中,垂体柄为一上宽下窄的锥形结构。在MRI的矢状位T1加权像上,多数正常的垂体后叶呈高信号,与后叶和视交叉相比,垂体柄呈较低信号,由于缺乏血脑屏障,在注射对比剂后,正常垂体柄和垂体前叶均匀强化[1]。垂体柄的中点均较基底动脉细,是影像判定垂体柄增粗(pituitary stalk thickening, PST)的重要指标[2]。目前认为,正常垂体柄直径小于3.0 mm,3.0 ~4.5 mm为轻度增粗,4.6 ~6.5 mm为中度增粗,大于6.5 mm为重度增粗[3]。根据病变累及范围的不同,临床可表现为部分或完全中枢性尿崩症(central diabetes insipidus, CDI)[4]和(或)垂体前叶功能减退症(anterior pituitary dysfunction, APD)及高泌乳素血症,可伴随头痛、视力视野改变等占位效应的症状。本研究对2例尿崩症并垂体柄增粗病例进行分析,现报告如下。
1 临床资料
病例1,男,16岁。以“多尿、多饮2月”之主诉入院。无头痛、视野缺损、流涕。既往慢性乙型病毒性肝炎病史。查体生长发育同正常同龄儿。入院后血常规、肝肾功能未见异常,肿瘤标志物、自身抗体谱、免疫球蛋白正常。季氏试验:白天尿量3 750 mL,夜间尿量4 250 mL,尿比重固定于1.002。禁水加压素试验共禁水21小时,禁水前尿比重1.008、血渗透压292 mOsm/kg,注射加压素前尿比重1.009、血渗透压318 mOsm/kg、尿量32 mL/h,注射加压素后2小时尿比重上升至1.019、血渗透压332 mOsm/kg、尿量20 mL/h,考虑部分性CDI。垂体前叶功能正常(表1)。3.0T MRI情况见图1:垂体形态存在,高度约为6.0 mm,实质信号均匀,增强扫描未见异常信号影。垂体柄前端增粗增大,直径约6.6 mm,垂体柄居中,增强扫描呈明显均匀强化。视交叉未见受压、抬高。鞍旁及鞍上其他结构未见异常。临床诊断为鞍区占位病变中枢性尿崩症。行经鼻蝶垂体柄活检术可见垂体柄增粗呈红色,质地韧。术后病理情况见图2:鞍区小块垂体组织伴局部纤维组织慢性炎及肉芽肿形成并嗜酸性粒细胞浸润。最终诊断为朗格汉斯组织细胞增生症(Langerhans' cell histiocytosis,LCH)。
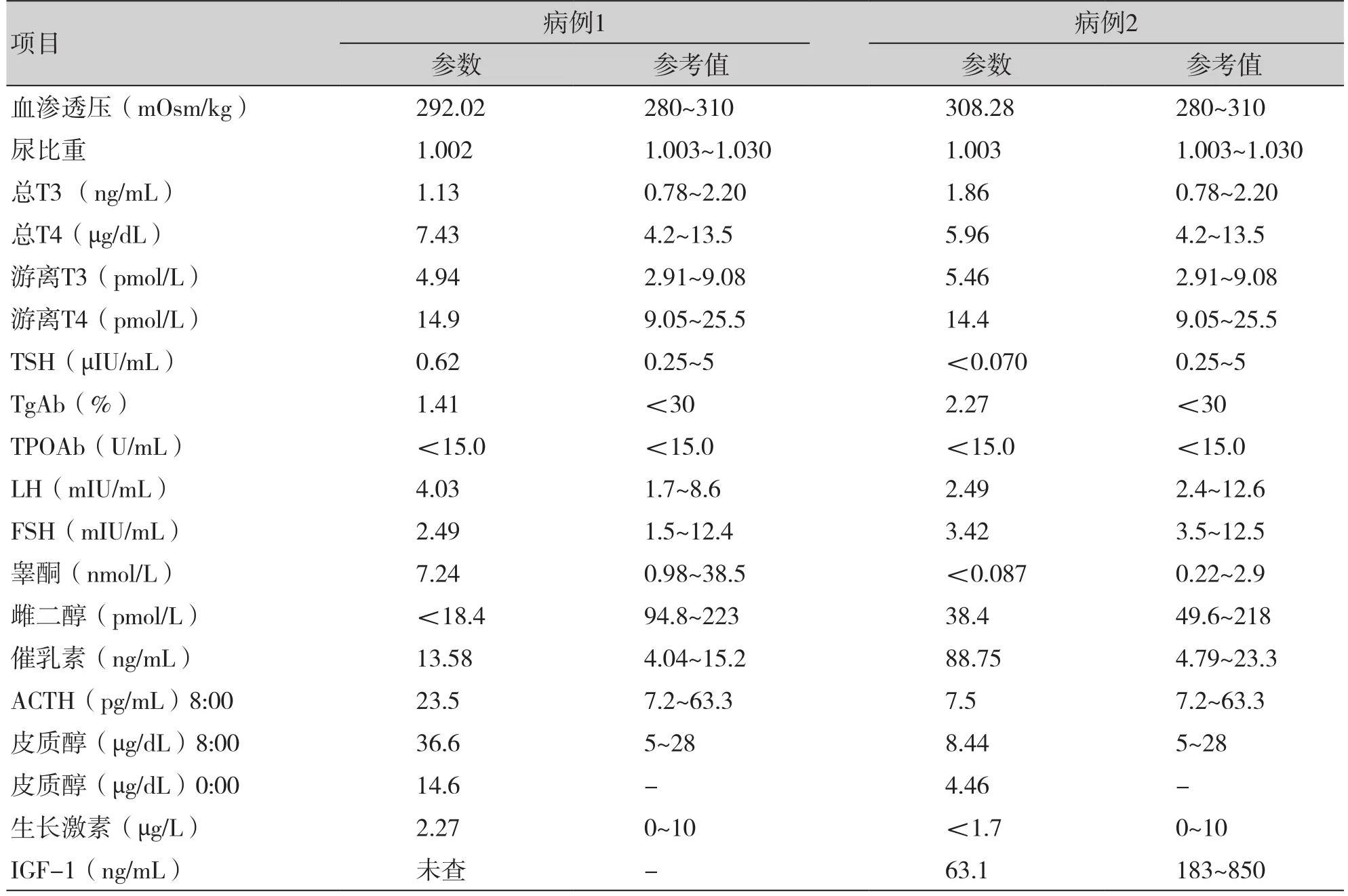
表1 2例患者入院后垂体功能评估Table 1. Evaluation of pituitary function in 2 patients after admission

图1 病例1 3.0T MRI平扫(A、C)及增强(B、D)Figure 1. Case 1 3.0T MRI scan (A, C) and enhanced(B, D)

图2 病例1 鞍区小块垂体组织显微镜下图(HE 10×40)Figure 2. The microscopic view of a small piece of pituitary tissue (HE 10×40) in the sarella area of Case 1
病例2 ,女,13岁。以“多尿、多饮1年,恶心、呕吐3月”之主诉入院。无头痛、视野缺损、流涕。查体:身高160 cm,体重 39 kg,BMI 15.23 kg/m2。血压偏低,波动于90 ~105/50 ~80 mmHg之间。无第二性征发育。双侧乳房Tanner 2期,挤压乳头无溢乳。入院后血常规、肝肾功能未见异常。季氏试验:白天尿量2 000 mL,夜间尿量1 000 mL,尿比重固定于1.002 ~1.004。禁水加压素试验共禁水14 h,禁水前尿比重1.004、血渗透压308.28 mOsm/kg,注射加压素前尿比重1.003、血渗透压321.73 mOsm/kg、尿量100 mL/h,注射加压素后2小时尿比重上升至1.016、血渗透压325.93 mOsm/kg、尿量20 mL/h,考虑完全性CDI。血清β-HCG正常,脑脊液β-HCG 7.63 IU/L。脑脊液糖、氯正常,蛋白升高,淋巴细胞比例90%升高,轻度淋巴细胞反应。肿瘤标志物神经元特异性烯醇化酶(neuron specific enolase, NSE)18.510 ng/mL,鳞状上皮细胞癌抗原SCC 1.62 ng/mL。甲胎蛋白(alpha-fetoprotein, AFP)、自身抗体谱、C反应蛋白、血沉、结核斑点试验、结核菌素试验、血清IgG4正常,甲状腺彩超及促甲状腺激素受体抗体正常。甲状腺吸碘率降低。入院后垂体功能评估提示垂体前叶功能减退,累及生长激素轴、甲状腺轴及肾上腺轴。住院期间行低血糖兴奋试验生长激素无反应,GnRH兴奋试验示FSH高峰(11.05 mIU/mL)出现于120 min,LH高峰(18.42 mIU/mL)出现于30 min。3.0T MRI动态增强示情况见图3:垂体形态自然,高度约为4.4 mm,上缘未见局限性膨隆,其内未见明确异常信号影,动态增强示垂体组织明显均匀强化,其内未见异常强化影。垂体柄弥漫性明显增粗,直径约6 mm,垂体柄居中,增强扫描不均匀强化。视交叉未见明显上抬。双侧颈内动脉海绵窦段走形自然,未见受压移位及包绕。临床诊断为中枢性尿崩症、垂体前叶功能减退症,淋巴细胞性垂体炎或生殖细胞瘤不能完全除外。行神经内镜下经鼻蝶窦入路鞍区病变活检术与鞍底重建术,术中探查鞍内后方,在垂体后叶位置可见质韧、灰白色鱼肉样的肿瘤组织,血供不丰富。术中切除肿瘤约6 cm×6 cm×6 cm,部分送检病例。术后病理示数据为鞍区肿物病变符合生殖细胞瘤。免疫组化为Ki-67(index 8%)、SALL-4(部分+)、AE1/AE3(-)、OCT3/4(-)、Syn(-)、SOX2(-)、CgA(-)、CD30(Ki-1)(-)、EMA(散在+)、CD117(+)、AFP(-)、D2-40(+)、PLAP(+)、HCG-β(-)、HCG(-),最终诊断为垂体生殖细胞瘤(germinoma)。本研究报告病例均获患者家属知情同意。

图3 病例2 3.0T MRI平扫(A、C)及增强(B、D)Figure 3. Case 2 3.0T MRI plain scan (A, C) and enhanced (B, D)
2 讨论
上述2例患者均满足24 h尿量持续在3 000 mL以上,排除高钙、低钾血症等电解质紊乱、溶质性多尿等所致多尿,并采用禁水加压素试验诊断除外精神性多饮和肾性尿崩症,故CDI诊断明确。2例患者均无典型占位效应的症状。影像学上均表现为PST,无偏移,直径6.0 ~6.6 mm之间。
病例1为1例LCH,又被称为嗜酸细胞性肉芽肿(eosinophilic granulomatosis)。LCH属于肿瘤样浸润或炎性浸润仍有争议[5]。其病理学特点是组织细胞(来源于骨髓祖细胞)、淋巴细胞、巨噬细胞和嗜酸性粒细胞的浸润,常累及皮肤、淋巴结、肺、胸腺、肝脏、脾脏、骨髓或中枢神经系统。LCH系罕见病,尚无流行病学数据。在一项对1 741例LCH患者的回顾性研究中发现,中枢神经系统LCH约占6%[6]。LCH可仅累及中枢神经系统(灰质或白质),可同时浸润眼部、耳部或口腔,也可同时合并有其他组织器官的LCH。中枢神经系统LCH最常见临床表现为CDI,可伴APD和占位效应症状。欧洲组织细胞协会资料显示LCH患者中29.6%合并CDI[7],而国内报道LCH合并CDI患者较低,占5%[8]。CDI可出现在LCH确诊前或确诊后数月至数十年[6-7]。两篇回顾性研究发现,在合并CDI的LCH患者中,80%在5年内出现了APD[3,9]。影像学上,垂体后叶T1加权高信号影消失是累及垂体的LCH的典型改变,但该影像特征并不具有诊断意义[10]。组织活检提示朗格汉斯细胞、嗜酸性粒细胞、中性粒细胞、小淋巴细胞和组织细胞(可能形成多核巨细胞)的浸润[11]。治疗包括化疗(长春新碱、甲氨蝶呤、硫唑嘌呤、依托泊苷、克拉屈滨)[10,12],静脉甲强龙冲击治疗或口服强的松[12]、吲哚美辛[10],以及放射治疗[12-13]与手术治疗[10]。上述治疗或可缩小肿瘤体积,但并不能完全纠正已受损的垂体前、后叶功能[10,12]。
病例2系1例女性生殖细胞瘤患者。从垂体功能上来说,该患者系CDI合并APD,累及垂体-甲状腺轴、垂体-肾上腺轴及生长激素轴,并合并高泌乳素血症。在CDI患者中,垂体柄增粗的程度与APD的发生显著相关。一项单中心队列研究数据显示,当垂体柄直径大于4.15 mm时,80%的患者均合并CDI,而以垂体柄直径大于4.75 mm预测CDI合并APD的发生,敏感性为69.2%,特异性为71.4%[14]。另一项数据同样提示了CDI患者垂体柄直径大于4.5 mm和APD的发生相关[15]。颅内生殖细胞瘤约占亚洲青少年中枢神经系统肿瘤的11%,远高于北美及欧洲的青少年[16]。该病诊断的中位时间为10 ~12岁,男性患病率是女性的2 ~3倍[17]。颅内生殖细胞瘤几乎全部起源于中线结构,最常见累及松果体和鞍区。该病的临床表现取决于肿瘤累及的部位,累及鞍区的生殖细胞瘤同其他鞍区病变一样可出现CDI、APD、高泌乳素血症以及占位效应症状,临床表现并不特异。头颅MRI中生殖细胞瘤表现为T1等信号或低信号、T2高信号,均匀强化[18]。可伴有血清和(或)脑脊液中APF、β-HCG升高。病理学是诊断的金标准,生殖细胞瘤常伴有大量淋巴细胞浸润,免疫组化可帮助明确诊断。
影像学表现为垂体柄增粗的良性炎性疾病还常可见于淋巴细胞性垂体炎。李悦等回顾的11例淋巴细胞性垂体炎患者资料,其中72.73%存在中枢性尿崩症,54.55%存在垂体前叶功能减退,在其中10例具有影像学资料的患者中,垂体柄增粗者8例,垂体后叶T1高信号消失8例[19]。除上述例2生殖细胞瘤,影像学表现为垂体柄增粗的肿瘤性疾病还常见于垂体腺瘤或垂体转移性肿瘤。垂体转移性肿瘤多累及后叶或以后叶为先发部位,多以尿崩症为首发症状,可能是因为垂体后叶的血供源于颈内动脉的分支垂体下动脉[20]。而早期出现CDI是鉴别垂体转移性肿瘤和垂体腺瘤的重要临床依据。王诺金等回顾了中外42例以尿崩症为首发表现的垂体转移性肿瘤患者的临床特征,发现29例患者已确认存在2个以上部位转移[21]。
PST的临床表现、垂体功能改变及影像学特征并无特异性。表现为PST的CDI患者的鉴别诊断常十分困难。而垂体柄活检术技术难度高、手术花费大,存在术后并发APD可能,并不能常规开展。因此,根据临床症状体征及影像学表现,对PST的病因进行鉴别,尤其是区分肿瘤性和炎性浸润是疾病诊疗的关键。结合现有文献[14,22-25],肿瘤性PST常为中重度、进展性的垂体柄上段增粗或均匀增粗,可伴垂体柄偏移、垂体后叶高信号影消失,常合并有垂体前叶多功能减退以及CDI。
PST是CDI患者最常见的影像学表现之一,提示炎性或肿瘤性疾病的浸润。病变性质的鉴别是诊疗的关键,从垂体功能、垂体柄增粗的程度以及影像学特点可进行初步的良、恶性鉴别,垂体活检病理学检查仍是诊断的金标准。良性的炎性PST存在自限可能,可以进行激素替代治疗并随访观察。
