肺腺癌脑转移病理学特征及人类间变性淋巴瘤激酶和表皮生长因子受体诊断价值
2021-07-06李竹君毛璐宁熊佶王鑫卢韶华刘颖
李竹君 毛璐宁 熊佶 王鑫 卢韶华 刘颖
肺癌是世界范围内发病率居第2位、死亡率居首位的恶性肿瘤,总体5年生存率仅22%[1]。其中,非小细胞肺癌(NSCLC)是最常见的病理类型,占肺癌总病例数的80%~85%[2]。造成肺癌高病死率的最主要原因是局部复发和远隔转移,其中远隔转移以脑转移最常见。约7.4%的非小细胞肺癌患者初诊时即已存在脑转移,25%~30%的患者在疾病进展过程中发生脑转移[3]。随着现代影像学技术的不断进步,非小细胞肺癌脑转移检出率逐年增高[4],此类患者之预后差,未经治疗患者的中位生存期(MST)仅1~2个月,即使予以治疗,中位生存期也仅3~6个月[5-6]。肺癌特异性脑转移的机制目前尚不明确,阻碍早期发现或阻断脑转移的治疗,因此,积极寻找肺癌脑转移高表达的生物学标志物,对肺癌脑转移预警具有十分重要的临床意义。近年来,检测肺癌相关分子遗传改变并进行分子靶向治疗的个体化治疗逐渐成为肺癌治疗研究热点。研究表明,人类棘皮动物微管相关蛋白样4(EML4)和人类间变性淋巴瘤激酶(ALK)重排形成的融合基因EML4-ALK,以及表皮生长因子受体(EGFR)基因是肺癌发生发展的驱动基因[7-12]。目前,临床应用上述驱动基因及信号转导通路的相关靶向抑制剂如吉非替尼、厄洛替尼等药物已显示出较好的治疗前景。此外,表皮生长因子受体-酪氨酸激酶抑制剂(EGFR-TKIs)和ALK抑制剂均可透过血-脑屏障,有用于治疗脑转移瘤的可能。但由于组织标本获取的局限性,ALK基因重排与EGFR基因突变在肺癌转移特别是肺癌脑转移中的可获取资料有限,故肺癌脑转移患者能否从靶向药物治疗中获益尚需实验数据的支持。基于此,本研究通过获取非小细胞肺癌脑转移标本,分析肺腺癌与脑转移相关病理学特点及与肺腺癌免疫治疗相关基因突变,以期指导肺腺癌脑转移的靶向药物治疗,延长患者生存期。
资料与方法
一、临床资料
1.纳入与排除标准 (1)明确诊断为非小细胞肺癌。(2)影像学显示脑部病灶,手术切除后经病理证实为肺腺癌脑转移。(3)单发脑部转移灶。(4)本研究经复旦大学道德伦理委员会审核批准(批号:2021-Y022),所有患者或其家属均知情同意并签署知情同意书。(5)排除术后病理证实为非转移性肺腺癌、原发性脑肿瘤,以及脑部肿瘤细胞比例<5%的患者。
2.一般资料 根据上述纳入与排除标准,选择2013年1月至2016年12月在复旦大学附属华山医院神经外科住院治疗的单发非小细胞肺癌脑转移患者共86例,男性54例,女性32例;年龄29~82岁,平均(56.74±11.04)岁;均行脑部病变切除术,术后收集脑组织标本。
二、研究方法
1.病理学检查 按照规范的手术标本程序制备脑组织切片[13],经体积分数为4%的中性甲醛溶液固定、常规脱水、石蜡包埋,制备10μm层厚脑组织切片,分别行HE染色和免疫组化染色。免疫组化染色采用EnVision二步法,检测用抗体包括P40(济南迈新生物科技有限公司,1∶200)、甲状腺转录因子-1(TTF-1,丹麦Dako公司,1∶100)、Napsin A(德国Leica公司,1∶200)、CD56(丹麦Dako公司,1∶100)、嗜铬素A(CgA,丹麦Dako公司,1∶200)及突触素(Syn,丹麦Dako公司,1∶500);同时采用Leica BOND-MAX自动免疫组织化学机(德国Leica公司)对脑组织切片行ALK(济南迈新生物科技有限公司)、EGFR(德国Leica公司)及EGFR基因外显子19、21特异性突变抗体E746-A750del、L858R(美国Cell Signaling Technology公司,均1∶100)免疫组化染色,结果判读以胞质内出现棕黄色颗粒为阳性。
2.病理分型 由两位病理学专家依据2015年世界卫生组织(WHO)肺癌病理分类标准[14],根据组织学形态特点加以必要的免疫组化标志物区分腺癌、鳞癌及内分泌癌。明确肺腺癌脑转移后观察其病理学特点,依据2011年国际肺癌研究协会(IASLC)/美国胸科学会(ATS)/欧洲呼吸学会(ERS)肺肿瘤组织学分类标准[15],分析肺腺癌中腺泡型、实体型、乳头型和微乳头型所占比例,并按照主要成分分组。
3.统计分析方法 采用SPSS 22.0统计软件进行数据处理与分析。计数资料以相对数构成比(%)或率(%)表示,采用χ2检验或配对χ2检验。以P≤0.05为差异具有统计学意义。
结 果
经HE染色及免疫组化染色证实,86例非小细胞肺癌脑转移患者中74例(86.05%)为肺腺癌(图1),3例(3.49%)为肺鳞癌(图2),9例(10.47%)为肺神经内分泌肿瘤(图3)。

图1 低分化肺腺癌脑转移病理学检查所见 ×100 1a 肿瘤细胞呈弥漫性分布 HE染色 1b 肿瘤细胞胞核可见清晰的棕黄色颗粒,TTF-1呈强阳性 免疫组化染色(EnVision二步法) 1c 肿瘤细胞胞质可见清晰的棕黄色颗粒,Napsin A呈阳性 免疫组化染色(EnVision二步法) 1d 肿瘤细胞胞核不表达P40 免疫组化染色(EnVision二步法)Figure 1 Pathological observation of brain metastases from poorly differentiated lung adenocarcinoma ×100 The tumor cells were diffuse(Panel 1a). HE staining Clear brown-yellow particles could be seen in the nucleus of tumor cells,TTF-1 was strong positive expression(Panel 1b). Immunohistochemical staining(EnVision) Clear brown-yellow particles could be seen in the cytoplasm of tumor cells,Napsin A was positive expression(Panel 1c). Immunohistochemical staining(EnVision) No staining of tumor cell nucleus,P40 was negative expression(Panel 1d). Immunohistochemical staining(EnVision)
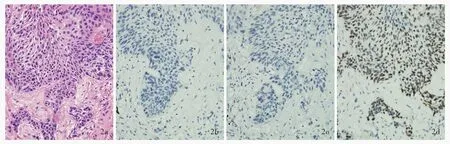
图2 低分化肺鳞癌脑转移病理学检查所见 ×100 2a 肿瘤细胞呈巢状分布 HE染色 2b 肿瘤细胞胞核不表达TTF-1 免疫组化染色(EnVision二步法) 2c 肿瘤细胞胞质不表达Napsin A 免疫组化染色(EnVision二步法) 2d 肿瘤细胞胞核可见清晰的棕黄色颗粒,P40呈强阳性 免疫组化染色(EnVision二步法)Figure 2 Pathological observation of brain metastasis from poorly differentiated lung squamous cell carcinoma ×100 The tumor cells distributed like nest(Panel 2a). HE staining No staining of tumor cell nucleus,TTF-1 was negative expression(Panel 2b).Immunohistochemical staining(EnVision) No staining of tumor cell cytoplasm,Napsin A was negative expression (Panel 2c).Immunohistochemical staining(EnVision) Clear brown-yellow particles could be seen in the nucleus of tumor cells,P40 was strong positive expression(Panel 2d). Immunohistochemical staining(EnVision)
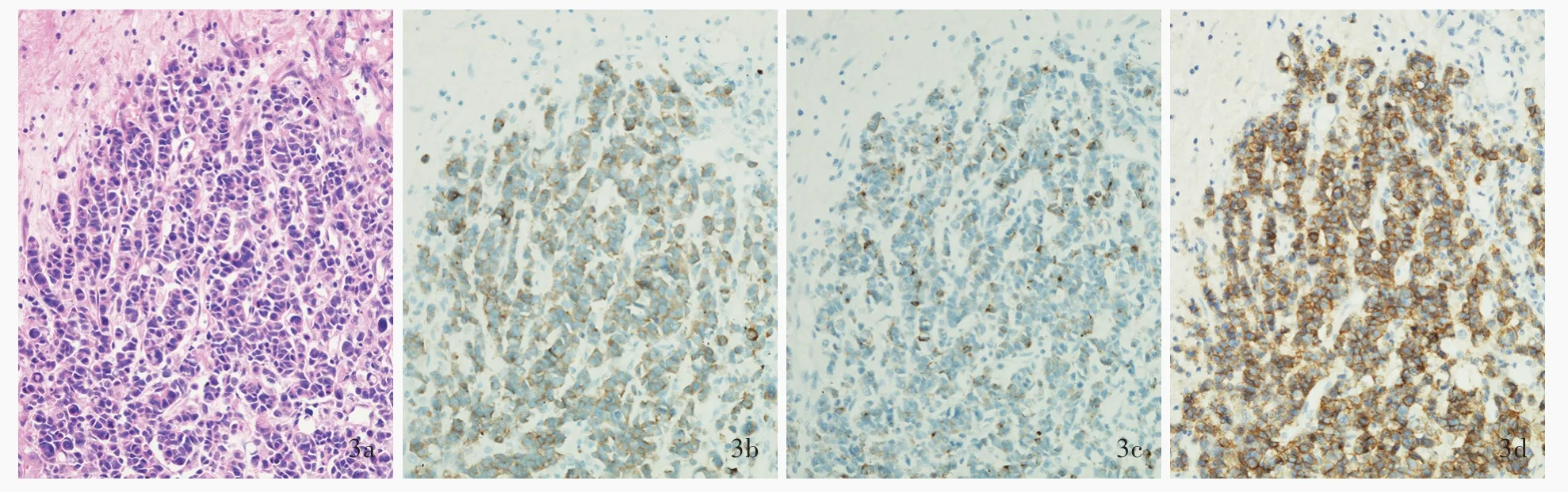
图3 低分化肺神经内分泌肿瘤脑转移病理学检查所见 ×100 3a 肿瘤细胞呈弥漫性散在分布 HE染色 3b 肿瘤细胞胞质可见清晰的棕黄色颗粒,Syn呈阳性 免疫组化染色(EnVision二步法) 3c 肿瘤细胞胞质可见清晰的棕黄色颗粒,CgA呈阳性免疫组化染色(EnVision二步法) 3d 肿瘤细胞胞核可见清晰的棕黄色颗粒,CD56呈强阳性 免疫组化染色(EnVision二步法)Figur e 3 Pathological observation of brain metastasis from poorly differentiated lung neuroendocrine carcinoma ×100 The tumor cells were diffuse(Panel 3a). HE staining Clear brown-yellow particles could be seen in the cytoplasm of tumor cells,Syn was positive expression(Panel 3b). Immunohistochemical staining(EnVision) Clear brown-yellow particles could be seen in the cytoplasm of tumor cells,CgA was positive expression(Panel 3c). Immunohistochemical staining(EnVision) Clear brown-yellow particles could be seen in the nucleus of tumor cells,CD56 was strong positive expression(Panel 3d). Immunohistochemical staining(EnVision)
根据组织学形态,74例肺腺癌脑转移患者的病理分型以实体型为主要成分者最多,为44例(59.46%),其次为乳头型14例(18.92%),腺泡型和微乳头型分别为9例(12.16%)和7例(9.46%),无附壁型病例(图4)。Lu等[16]回顾分析269例原发性肺腺癌患者的病理学特点,其病理分型以腺泡型为主要成分者最多,为139例(63.76%),其次为乳头型53例(24.31%),实体型和微乳头型分别为23例(10.55%)和3例(1.38%),余51例(18.96%)为附壁型,其中218例(81.04%)发生脑转移。与本研究肺腺癌脑转移的病理分型相比较,总体差异具有统计学意义(P=0.000,表1)。
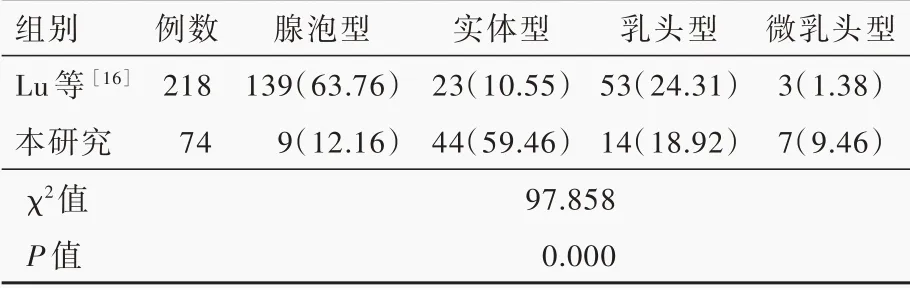
表1 文献报道的原发性肺腺癌与本研究肺腺癌脑转移病理分型的比较[例(%)]Table 1. Comparison of the pathological classification of primary lung adenocarcinoma reported in the literature and the brain metastasis from lung adenocarcinoma in this study[case(%)]
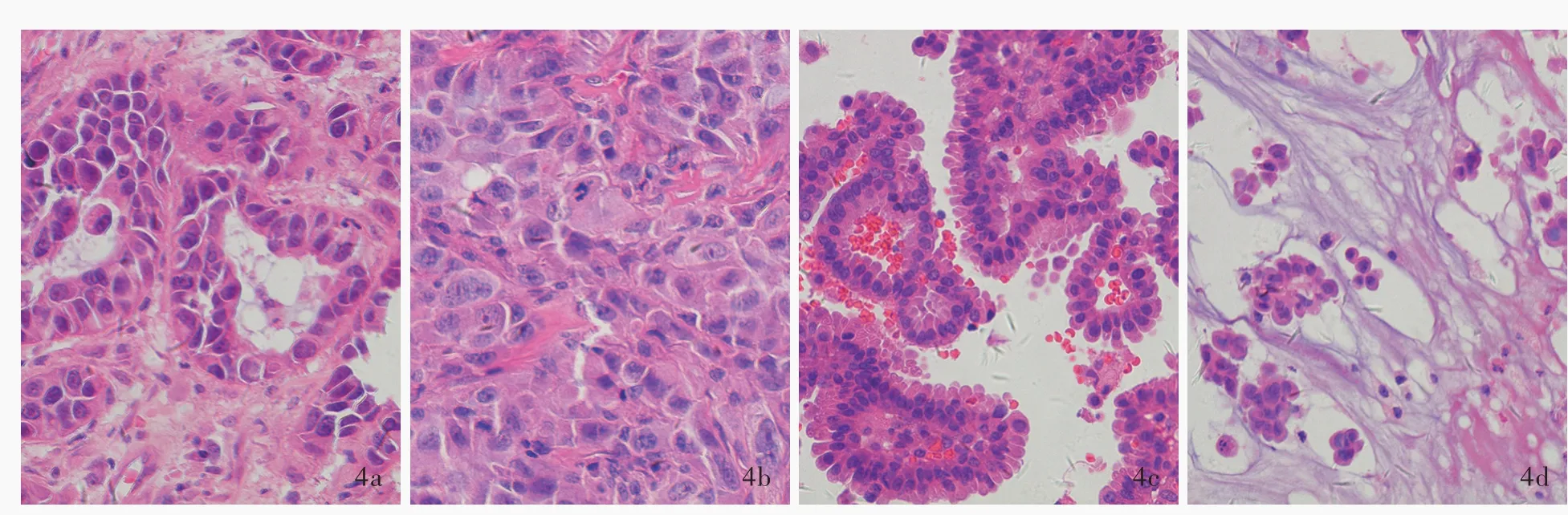
图4 肺腺癌脑转移的病理分型 HE染色 ×200 4a 腺泡型:肿瘤细胞呈腺样排列,胞质和腺腔内可见黏液 4b 实体型:多角形肿瘤细胞呈片状排列 4c 乳头型:肿瘤细胞围绕纤维血管轴心呈乳头状排列 4d 微乳头型:肿瘤细胞排列为缺少纤维血管轴心的簇状Figure 4 Histological classification of brain metastases from lung adenocarcinoma HE staining ×200 Acinar type:the tumor cells were arranged in adenoids,the cytoplasm and glandular cavity contained mucus (Panel 4a). Solid type:polygonal tumor cells were arranged in sheets(Panel 4b).Papillary type:tumor cells were arranged in a papillary shape around the axis of fibrous vessels(Panel 4c).Micropapillary type:tumor cells were arranged in clusters lacking the axis of fibrous vessels(Panel 4d).
免疫组化显示,74例肺腺癌脑转移患者ALK呈现阴性、弱阳性、中阳性或强阳性(图5),阳性率为9.46%(7/74),不同病理分型中ALK表达差异无统计学意义(P=0.639),其中微乳头型不表达ALK;EGFR亦呈现阴性、弱阳性、中阳性或强阳性(图6),阳性率为52.70%(39/74),不同病理分型中EGFR表达差异有统计学意义(P=0.047);突变型EGFR检测发现,EGFR-19(EGFR基因外显子19特异性突变蛋白)阳性率为18.92%(14/74),EGFR-21(EGFR基因外显子21特异性突变蛋白)阳性率为16.22%(12/74),突变型EGFR总体阳性率为33.78%(25/74,其中1例存在双位点突变;图7),不同病理分型中突变型EGFR表达差异无统计学意义(P=0.632,表2)。采用配对χ2检验对ALK与EGFR表达进行比较,差异有统计学意义(P=0.001,表3),提示肺腺癌脑转移ALK与EGFR的表达可能相互排斥。
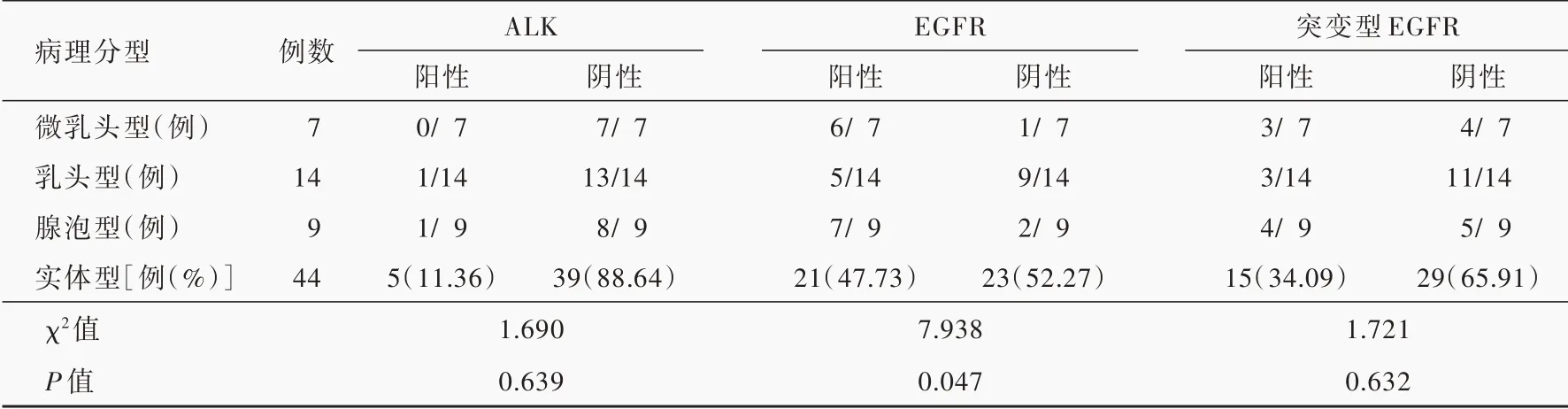
表2 肺腺癌脑转移不同病理分型ALK、EGFR和突变型EGFR阳性率的比较Table 2. Comparison of the positive rate of ALK,EGFR and mutant EGFR in different pathological types of brain metastasis from lung adenocarcinoma
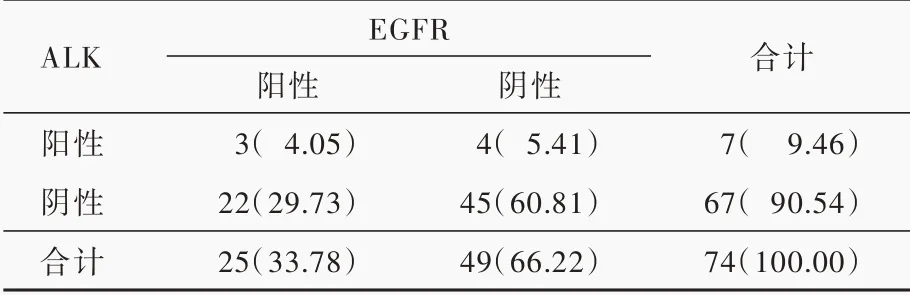
表3 肺腺癌脑转移ALK与EGFR表达的差异[例(%)]Table 3. The difference of ALK and EGFR expression in brain metastases from lung adenocarcinoma[case(%)]

图5 ALK免疫组化染色(EnVision二步法)所见 ×100 5a 肿瘤细胞胞质不表达ALK 5b 肿瘤细胞胞质ALK呈弱阳性 5c肿瘤细胞胞质ALK呈中阳性 5d 肿瘤细胞胞质ALK呈强阳性Figure 5 Immunohistochemically labeled ALK findings(EnVision) ×100 ALK expression was negative in cytoplasm of tumor cells(Panel 5a).ALK expression was weakly positive in cytoplasm of tumor cells(Panel 5b).ALK expression was moderately positive in cytoplasm of tumor cells(Panel 5c).ALK expression was strongly positive in cytoplasm of tumor cells(Panel 5d).
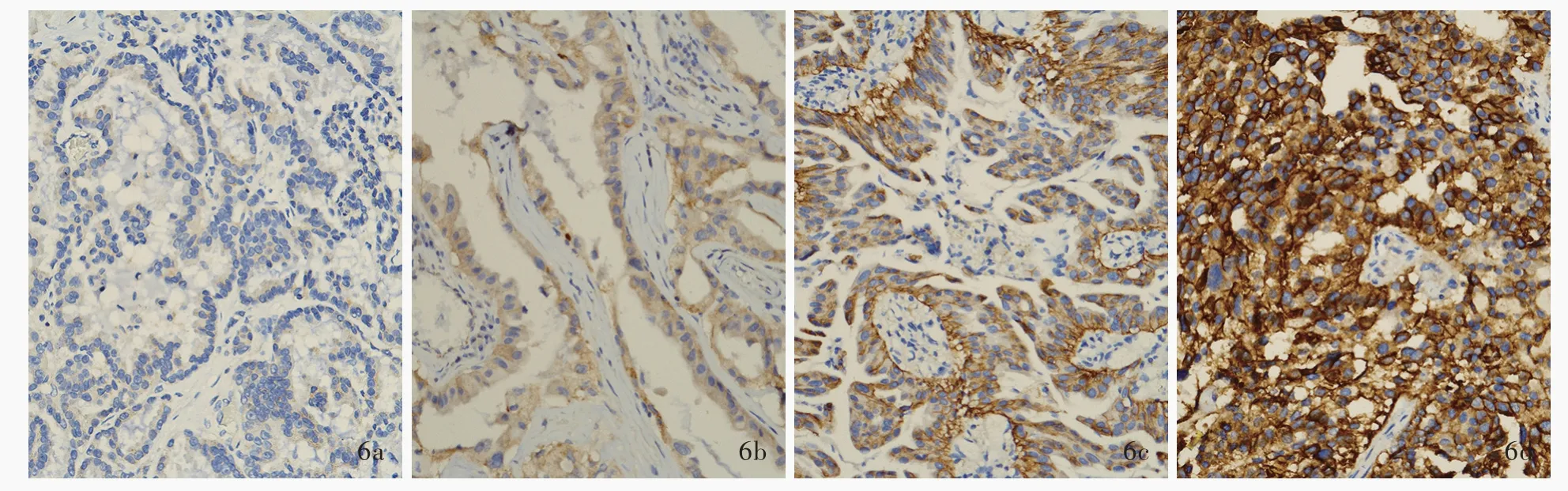
图6 EGFR免疫组化染色(EnVision二步法)所见 ×100 6a 肿瘤细胞胞质不表达EGFR 6b 肿瘤细胞胞质EGFR呈弱阳性6c 肿瘤细胞胞质EGFR呈中阳性 6d 肿瘤细胞胞质EGFR呈强阳性Figure 6 Immunohistochemically labeled EGFR findings(EnVision) ×100 EGFR expression was negative in cytoplasm of tumor cells(Panel 6a).EGFR expression was weakly positive in cytoplasm of tumor cells(Panel 6b).EGFR expression was moderately positive in cytoplasm of tumor cells(Panel 6c).EGFR expression was strongly positive in cytoplasm of tumor cells(Panel 6d).
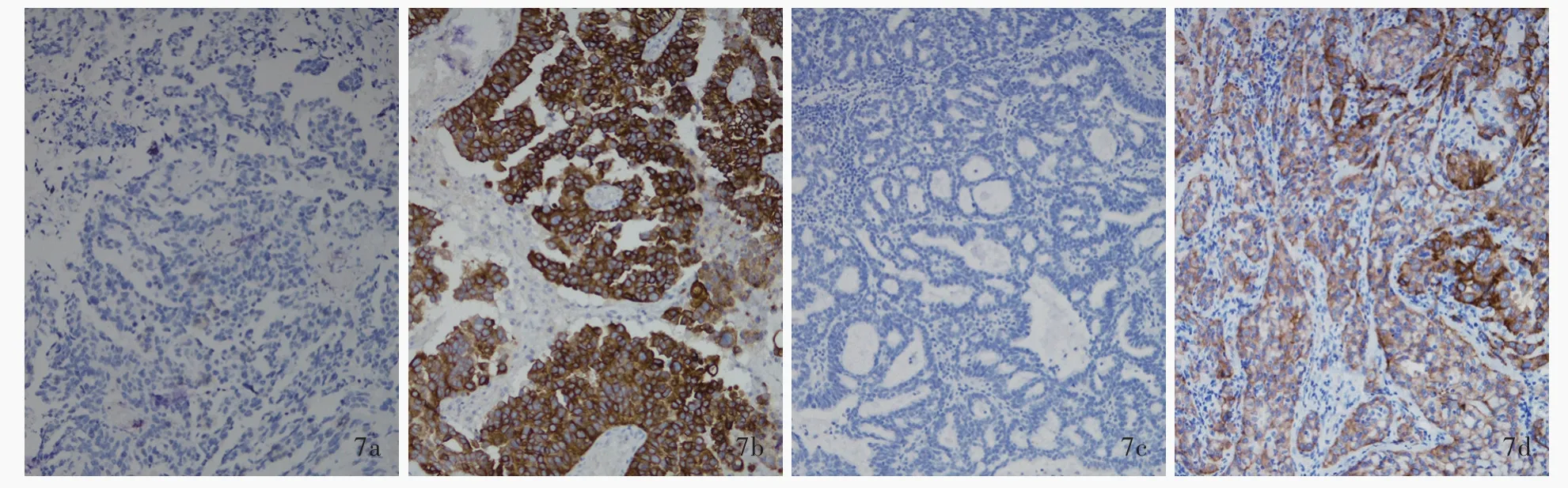
图7 EGFR-19特异性突变蛋白(E746-A750del)和EGFR-21特异性突变蛋白(L858R)免疫组化染色(EnVision二步法)所见 ×100 7a 肿瘤细胞胞质不表达E746-A750del 7b 肿瘤细胞胞质E746-A750del呈阳性 7c 肿瘤细胞胞质不表达L858R 7d肿瘤细胞胞质L858R呈阳性Figure 7 Immunohistochemically labeled EGFR exon 19 specific mutation(E746-A750del)and EGFR exon 21 specific mutation(L858R)findings(EnVision) ×100 E746-A750del expression was negative in cytoplasm of tumor cells(Panel 7a).E746-A750del expression was positive in cytoplasm of tumor cells(Panel 7b).L858R expression was negative in cytoplasm of tumor cells(Panel 7c).L858R expression was positive in cytoplasm of tumor cells(Panel 7d).
讨 论
Yoshizawa等[17]发现,病理分型是肺腺癌患者无病生存率(DFS)的预测因素。腺泡型和乳头型预后较好,5年无病生存率为54%~87%,实体型和微乳头型预后最差且有较高的转移可能,其中微乳头型是肺腺癌脑转移的重要危险因素[18-20]。研究显示,微乳头型肺腺癌在肿瘤转移过程中仅与脑转移相关,并未见其他脏器转移率的增加,但其发生高特异性脑转移的原因尚不清楚[21]。Casteillo等[22]发现,脑转移肺腺癌患者中腺泡型患者的总生存期为(26.5±6.3)个月、乳头型为(30.1±5.6)个月,而实体型和微乳头型患者的总生存期明显缩短,分别为(13.8±1.4)和(11.6±10.1)个月,提示病理分型可以作为预测转移性肺腺癌的重要因素。本研究结果显示,肺腺癌脑转移中以实体型为主要成分者最多,为44例(59.46%),其次为乳头型14例(18.92%),提示这两种病理分型可能在肿瘤侵袭和转移过程中具有较强的侵袭行为,易发生脑转移,应引起临床医师的高度重视。
2007年,Soda等[8]在非小细胞肺癌患者的肿瘤标本中首次发现EML4-ALK融合基因,其突变率约占非小细胞肺癌的5%[23]。国内学者的研究显示,在非小细胞肺癌中,EML4-ALK融合基因的阳性率为4.2%[24]。文献报道,肺腺癌中EML4-ALK融合基因的阳性率为10%[24-25]。有20%~35%的ALK阳性非小细胞肺癌患者发生脑转移[26-27]。有研究采用免疫组化染色、荧光原位杂交(FISH)和逆转录-聚合酶链反应(RT-PCR)共3种检测方法验证EML4-ALK融合基因突变的检测结果,具有较高的一致性[28]。本研究74例肺腺癌脑转移患者,ALK阳性率为9.46%(7/74)。EML4-ALK融合基因阳性的肺腺癌具有独特的病理学特点,常表现为腺泡样生长方式伴细胞外黏液或以实性结构为主,含印戒细胞成分[29-30],而本研究脑组织标本中并无腺泡样伴细胞外黏液型。
EGFR基因是另一与肺癌发生发展密切相关的重要驱动基因。EGFR是一种跨膜糖蛋白,属于酪氨酸激酶型受体,是ErbB家族成员,EGFR基因酪氨酸激酶区域体细胞之突变主要发生于外显子18~21[31]。研究显示,50%~80%的非小细胞肺癌患者存在EGFR基因过表达,亚洲人群肺腺癌EGFR基因突变率为51.4%[32]。目前检测EGFR基因突变的主要方法有直接测序法和RT-PCR法,但繁琐、耗时长、费用高。随着EGFR基因经典突变特异性抗体的出现,传统的免疫组化染色也可成为可能的检测方法,且可以弥补上述缺陷,还具有快速、简便、经济等特点。研究业已证实,EGFR免疫组化染色结果与RT-PCR法结果具有高度一致性[33-35]。本研究结果显示,74例肺腺癌脑转移患者中突变型EGFR总体阳性率为33.78%(25/74),EGFR-19阳性率为18.92%(14/74)、EGFR-21阳性率为16.22%(12/74),且在不同病理分型中的表达无差别,因此认为,肺腺癌脑转移的机制与EGFR基因突变无关。肺腺癌的基因突变与病理分型密切相关,有研究显示,EML4-ALK融合基因突变与印戒细胞成分呈正相关关系[36-37]。此外,以附壁型为主的肺腺癌具有更高的EGFR突变率(47%~78%),而浸润性黏液型肺腺癌EGFR突变率较低(0~22%)[38-39]。本研究结果显示,肺腺癌脑转移不同病理分型EGFR阳性率差异有统计学意义,但突变型EGFR(包括EGFR-19和EGFR-21)阳性率差异无统计学意义,推测可能与本研究样本量较小有关,提示以微乳头型和腺泡型为
主的晚期肺腺癌脑转移患者可应用EGFR抑制剂。
近年研究显示,EML4-ALK融合基因阳性的肺腺癌患者虽然与EGFR基因突变的肺腺癌患者之间具有某些相似的临床特征,但大多数情况下,二者并不共存[40],其中EML4-ALK融合基因突变多发生于较年轻患者和晚期患者[36],进一步揭示肺腺癌多个基因突变存在互相排斥的现象。随着对ALK基因的深入研究,发现有极少数患者有两种突变共存现象[41],本研究也存在4.05%(3/74)患者ALK/EGFR共表达,进一步采用配对χ2检验对ALK与EGFR的表达进行比较,差异具有统计学意义,推测二者的表达可能相互排斥,且突变型EGFR阳性率(33.78%)高于ALK(9.46%),即EGFR基因较ALK基因更易发生突变。不论是肺组织还是脑组织,ALK基因突变与EGFR基因突变存在相互排斥的根本原因究竟是同一分子事件的必然结果,还是不同分子事件的巧合?尚待在更广泛的人群中进行检测,并寻找更多分子生物学标志物,以揭示其本质和彼此之间的关联性。
综上所述,肺腺癌脑转移患者的病理分型存在明显差异,实体型、微乳头型肺腺癌易发生脑转移。因此,在临床诊断与治疗时应注意对具有较强侵袭行为、易发生早期转移的以实体型和微乳头型为主要成分的肺腺癌患者的随访,病理学医师也应在肺癌常规报告中特别注意提示其病理分型。本研究74例肺腺癌脑转移患者ALK和EGFR的阳性率分别为9.46%和33.78%,与原发性肺腺癌患者的阳性率相一致,且EGFR基因较ALK基因更易突变。期望上述观察结果能够为临床医师对肺癌脑转移患者进行靶向药物治疗时提供一定的理论依据。
利益冲突 无
