帕金森病合并脑小血管病人脑组织病理学分析:附一例报告并文献复习
2021-07-06曹凌晓董威李渊李少祥陈彪黄越
曹凌晓 董威 李渊 李少祥 陈彪 黄越
帕金森病(PD)是老年人群常见神经变性病,其典型病理改变为黑质多巴胺能神经元减少、α-突触核蛋白(α-Syn)聚集和路易小体(LB)形成[1]。脑小血管病(CSVD)同样是老年人群常见脑血管病,其病理改变为脑小动脉、小静脉和毛细血管病变导致的腔隙性梗死(LACI)、脑微出血(CMBs)、扩大的血管周围间隙(EPVS)等[2]。目前尚无关于这两种疾病关联性的定论[3-6],且缺乏相关病理学研究。本文报道1例行脑深部电刺激术(DBS)的帕金森病患者,临床并无脑小血管病的诊断,但人脑组织尸检时发现与帕金森病共存的脑小血管病病理改变,并在此基础上复习相关文献,总结帕金森病、脑深部电刺激术后和帕金森病与脑小血管病共病的人脑组织病理学特点及其研究进展,以为老年人群脑疾病多病共病研究和精准医学提供依据。
病例资料
患者 男性,69岁,退休人员,大学本科学历。2019年9月3日猝死后9.50小时,由首都医科大学附属北京天坛医院国家神经系统疾病临床医学研究中心人脑组织库(以下简称国家中心脑库)完成脑组织捐献及接受工作。患者17年前(2002年)无明显诱因出现行走时左下肢不利,继而出现左手精细活动迟缓,伴左侧肢体不自主抖动,静止和紧张时明显,上述症状逐渐进展至双侧肢体。15年前(2004年)在当地医院诊断为帕金森病,予苯海索(安坦)、金刚烷胺、司来吉兰(具体剂量不详)治疗后症状部分改善。13年前(2006年)动作笨拙加重,出现小碎步、行走前冲,夜间翻身费力,先后予以多巴丝肼(美多芭)、培高利特、吡贝地尔(具体剂量不详)治疗,患者症状改善时间逐渐缩短。11年前(2008年)出现行走困难伴跌倒,存在“剂末现象”和“开关现象”且部分“关”期不可预测,简易智能状态检查量表(MMSE)评分28、汉密尔顿抑郁量表17项(HAMD-17)评分9、Beck抑郁量表(BDI)评分7、匹兹堡睡眠质量指数(PSQI)评分6、帕金森病非运动症状问卷(NMSQuest)评分12。2008-2011年定期随诊并调整药物,先后予多巴丝肼、卡左双多巴(息宁)、恩他卡朋、金刚烷胺、司来吉兰等(左旋多巴等效剂量700~1066 mg/d),最初效果良好,后逐渐出现“开”期缩短伴异动。8年前(2011年)因药物治疗效果不满意,于首都医科大学宣武医院行脑深部电刺激术,术后“关”期症状显著减轻,症状波动改善。5年前(2014年)术后再次出现“关”期行走困难,偶有冻结步态,调整药物为卡左双多巴、恩他卡朋、司来吉兰、金刚烷胺和罗匹尼罗[左旋多巴等效剂量(LED)1400 mg/d]后症状改善。3年前(2016年)出现烦躁、易激惹、情绪低落,先后予以文拉法新、氯氮平(具体剂量不详)等药物治疗。2年前(2017年)脑深部电刺激装置电池逐渐耗尽,患者生活不能自理。2019年9月3日于养老院中死亡,死因为猝死。既往有缺血性卒中和糖尿病病史10余年(药物应用和控制情况不详);吸烟史11年,已戒烟40年;31岁时(1981年)曾发生一氧化碳中毒,未遗留后遗症;余个人史及家族史无特殊。
国家中心脑库处理 国家中心脑库于患者死亡后9.50小时完成脑组织捐献及接受工作,并按照国际标准化脑库的脑组织处理流程,将一半脑组织(左侧)固定、另一半脑组织(右侧)新鲜保存[7]。称重整个脑组织1.44 kg,表面脑沟无增宽、脑回无萎缩,双侧大脑额中回上部可见电极插入的凹陷。左侧脑组织置于10%中性甲醛溶液中浸泡固定4周后,制备层厚3 mm的冠状切片;右侧脑组织直接制备层厚1.20 cm的冠状切片。大体标本观察,双侧电极自大脑皮质插入后向斜下方走行,途经双侧大脑皮质下白质、尾状核头外侧白质和内囊膝部,达苍白球内侧部(GPi),电极途径的周围脑组织质地柔软;右侧枕叶白质可见大小约15 mm×10 mm的软化灶;脑干黑质和蓝斑显著色素脱失;小脑未见异常(图1)。进一步对关键脑区(包括额叶、运动区、颞叶、海马、基底节区、中脑、脑桥、延髓、小脑)和兴趣区(ROI,包括尾状核头部电极入路和大脑皮质电极入点)取材,取材后固定的脑组织经脱水、石蜡包埋,制备层厚5μm的切片,行HE染色和免疫组化染色,免疫组化检测用抗体包括磷酸化α-Syn(1∶2000,首都医科大学杨慧教授惠赠)、α-Syn(1∶2000,美国BD Transduction Laboratories公司)、β-淀粉样蛋白(Aβ,克隆号:4G8,1∶2000,美国Biolegend公司)、微管相关蛋白tau蛋白(MAPT,克隆号:AT8,1∶2500,美国Thermo Scientific公司)。组织学形态可见黑质和蓝斑区含黑色素的神经元明显减少,一些残留的神经元内含有嗜伊红染色的路易小体。免疫组化染色显示,除顶叶和小脑外,额叶、颞叶、扣带回、基底节区、脑干等区域均存在广泛的α-Syn高表达,以及不同程度的α-Syn聚集和路易小体形成病理改变,即路易相关性病理(LRPs),尤以磷酸化α-Syn阳性提示更显著的神经轴索和星形细胞斑(astrocytic plaques)病理改变,表明磷酸化α-Syn参与早期的路易相关性病理形成和特征性改变(图2),亦可见Thal分期2期、阿尔茨海默病联合登记组织(CERAD)神经斑分期2期的神经炎性斑[NPs,亦称老年斑(SPs)],但未见tau蛋白病理改变[8-9],符合帕金森病晚期(Braak分期Ⅴ期)病理表现[10]。除帕金森病病理改变外,还可见电极路径存在明显的神经元缺失,以及星形胶质增生和炎性细胞浸润的炎症性改变,符合脑深部电刺激术后病理改变(图3a)。额叶、颞叶、扣带回、基底节区和脑干等区域存在微小血管平滑肌细胞增生、管壁增厚变硬、玻璃样变、管腔狭窄,小血管周围间隙扩大,白质微梗死和小血管微出血,大脑皮质未见明显神经元减少,符合脑小血管病病理改变(图3)。最终病理诊断为帕金森病(Braak分期Ⅴ期);脑深部电刺激术后;脑小血管病。
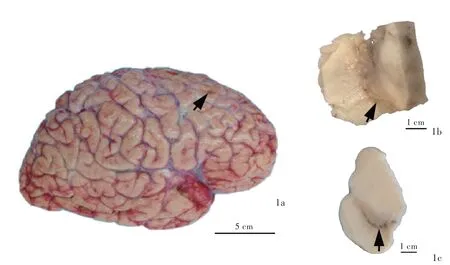
图1 大体标本观察所见 1a 整个脑组织表面正常,脑沟无增宽、脑回无萎缩,双侧大脑额中回上部可见电极插入点(箭头所示) 1b 中脑黑质明显色素脱失(箭头所示) 1c 正常脑组织黑质正常(箭头所示)Figure 1 Gross examination of the brain The surface of the brain was normal without sulcus widening and atrophic gyri.The insertion sites of DBS were on bilateral upper midfrontal gyrus(arrow indicates,panel 1a).The substantia nigra of the midbrain was decolorized(arrow indicates,Panel 1b).At normal brain tissue,the substantia nigra was normal(arrow indicates,Panel 1c).
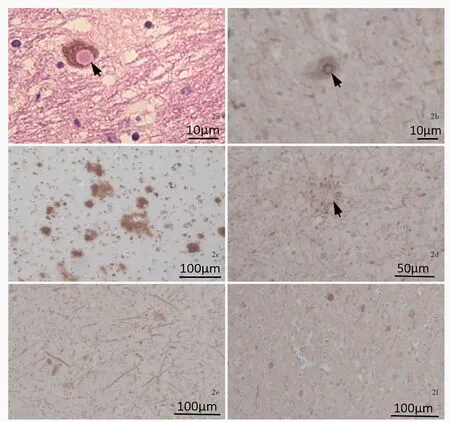
图2 光学显微镜观察所见 2a 黑质多巴胺能神经元胞质内可见路易小体形成(箭头所示),周围包绕清晰且略淡染的嗜伊红圆边 HE染色 ×400 2b 黑质多巴胺能神经元胞质内可见路易小体形成(箭头所示),强阳性表达磷酸化α-Syn 免疫组化染色(EnVision二步法) ×400 2c 颞叶皮质Aβ呈阳性,提示神经炎性斑形成 免疫组化染色(EnVision二步法) ×40 2d 斑片样富集磷酸化α-Syn呈阳性(箭头所示) 免疫组化染色(EnVision二步法) ×200 2e 黑质和海马CA2区强阳性表达磷酸化α-Syn,提示大量路易轴突 免疫组化染色(EnVision二步法) ×40 2f 额叶、颞叶、扣带回和基底节区可观察到磷酸化α-Syn和α-Syn聚集的神经元 免疫组化染色(EnVision二步法) ×40Figure 2 Optical microscopy findings There was Lewy body formation in the cytoplasm of dopaminergic neurons in the substantia nigra(arrow indicates).The eosinophilic inclusion was surrounded by a pale ring(Panel 2a). HE staining ×400 There was Lewy body formation in the cytoplasm of dopaminergic neurons in the substantia nigra(arrow indicates),which was strong positive for phosphorylated α-Syn immunostaining at the edge (Panel 2b). Immunohistochemistry staining (EnVision) × 400 Aβ immunohistochemistry revealed the senile plaque formation in the temporal cortex(Panel 2c). Immunohistochemistry staining(EnVision) ×40 Phosphorylatedα-Syn immunohistochemistry also revealed plaque like staining(arrow indicates,Panel 2d).Immunohistochemistry staining(EnVision) ×200 There were many phosphorylatedα-Syn positive neurites in the substantia nigra and hippocampal CA2,revealed a lot of Lewy axon(Panel 2e). Immunohistochemistry staining(EnVision) ×40 There were many phosphorylatedα-Syn andα-Syn positive neurons in the basal ganglia,anterior cingulate,frontal and temporal cortices(Panel 2f).Immunohistochemistry staining(EnVision) ×40
讨 论
帕金森病是仅次于阿尔茨海默病的老年人群常见神经变性病,其65岁以上人群患病率为1%~2%[11]。典型病理改变为黑质多巴胺能神经元减少,同时可见残留的多巴胺能神经元存在α-Syn聚集和路易小体形成[1]。Braak等[10]将散发性帕金森病的病理分期共分为6期,Ⅰ期,累及嗅球和前嗅核、舌咽神经延髓段和迷走神经背核;Ⅱ期,累及延髓脑桥被盖,包括网状结构、中缝核、网状核和蓝斑;Ⅲ期,累及中脑特别是黑质致密部;Ⅳ期,累及中脑深部神经核团和前部脑叶;Ⅴ期,累及前额叶和新皮质高级感觉联合区;Ⅵ期,累及新皮质一级感觉联合区和运动前区,偶有初级感觉皮质(S1)和初级运动皮质(M1)受累。该病理分期目前已受到
广泛认可和应用[12-16]。该例捐献者脑组织病理改变为黑质神经元丢失和神经元内路易包涵体形成,路易相关性病理累及Braak分期Ⅰ~Ⅴ期相关脑区,尚未累及Ⅵ期相关脑区,故病理诊断为Braak分期Ⅴ期。帕金森病晚期(Braak分期Ⅴ~Ⅵ期)通常在大脑皮质可见老年斑,但其分布和严重程度较阿尔茨海默病轻微,该例捐献者老年斑Thal分期2期、CERAD分期2期,无神经原纤维缠结(NFTs),符合帕金森病晚期病理改变。
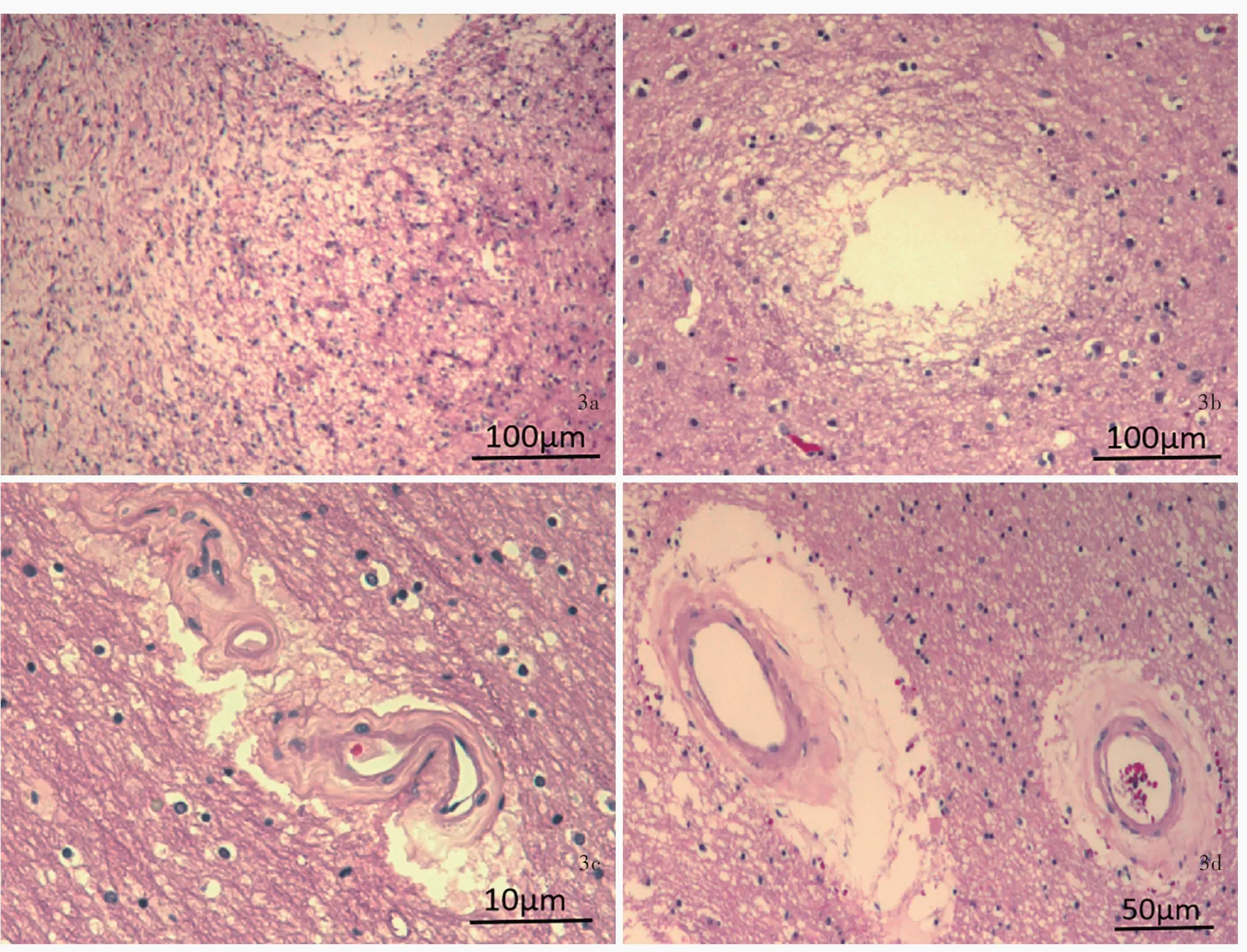
图3 光学显微镜观察所见 HE染色 3a 脑深部电刺激电极导管周围可见明显的神经元缺失,以及显著的星形胶质增生和海绵样变,符合脑深部电刺激术后病理改变 ×40 3b 额叶灰质可见陈旧性微梗死,未见明显炎症性改变 ×40 3c 微小动脉迂曲延长,管壁增厚,部分血管壁可见玻璃样变 ×400 3d 血管周围间隙扩大,管壁增厚,可见纤维性变性 ×200Figure 3 Optical microscopy findings HE staining There was severe neuronal loss and gliosis around the DBS tracts with spongiosis,which was accorded with pathological changes after DBS surgery(Panel 3a). ×40 There was a microscopic lesion in the grey matter of frontal cortex without gliosis,indicating an old infarct(Panel 3b). ×40 There were distorted small vessels with thickened vessel walls showing hyalinosis(Panel 3c). ×400 There were severe perivascular dilatation and thickened vessel walls with fibrohyalinosis(Panel 3d). ×400
帕金森病患者脑深部电刺激术后脑组织尸检和病理学检查国外已见诸多篇报道[17-23],亦有专业的脑深部电刺激术脑库(Deep Brain Stimulation Brain Bank)行术后脑组织病理学研究,迄今已收集100余例脑深部电刺激术后脑组织[21],但目前国内尚无相关尸检研究。脑深部电刺激术后病理改变主要为慢性炎症反应,Haberler等[23]在此类患者的尸检脑组织中发现,电极导线周围存在典型三层病理反应,内层为<25μm的纤维组织、中间层为<500μm的纤维性神经胶质增生、外层为约1 mm厚的松散胶质纤维酸性蛋白(GFAP)反应性星形胶质细胞,此外,电极导线周围脑组织中间和周围还可见少量单核细胞和多核巨细胞。该例捐献者脑组织导管路径周围亦存在显著的星形胶质增生。激活的星形胶质细胞可产生多种神经营养因子,如中脑星形胶质细胞源性神经营养因子(MANF)、重组多巴胺能神经营养因子(CDNF)等[19],从而发挥神经保护或神经恢复作用。有学者提出,脑深部电刺激术治疗帕金森病的作用机制是抑制小胶质细胞和促进神经祖细胞增殖[18,24]。脑深部电刺激术对帕金森病的治疗作用机制尚待进一步研究。
脑小血管病是一种由高血压、糖尿病等多种病因引起的脑小动脉、小静脉和毛细血管病变导致的疾病,发病隐匿,临床表现为认知功能障碍、步态平衡障碍、情绪低落、尿失禁等,易与其他神经系统疾病混淆[2]。该例捐献者生前采取帕金森病长期治疗方案,并无脑小血管病的诊断,但脑组织尸检除帕金森病病理改变外,还存在脑小血管病病理改变。关于两种疾病的关联性研究,目前尚无定论。Schwartz等[3]的病理学研究显示,帕金森病患者出现脑小血管病病理改变的概率低于正常对照组(P=0.03)。Bergkamp等[4]发现,脑白质高信号(WMH)和脑萎缩等脑小血管病影像学改变可增加帕金森病风险。Wan等[5]认为,帕金森病患者脑小血管病与帕金森病运动症状相关,基底节区血管周围间隙扩大与静止性震颤相关,额叶白质高信号与步态障碍相关。然而上述研究样本量均较小,尚待进一步行大样本临床病理研究以探究二者的关联性。虽然有证据表明脑深部电刺激术可以调控血管内皮生长因子(VEGF),增加血管内皮细胞厚度,改善帕金森病受损微血管的完整性[19],但该例捐献者脑小血管病变涉及范围较广,不仅仅局限于基底节区以及额叶和额叶皮质下结构,故与脑深部电刺激术并无直接联系。
该例捐献者的病理学所见提示,脑小血管病在临床上易被其他疾病掩盖。尽管帕金森病患者合并脑小血管病的发生率较小[3],可能导致帕金森病快速进展或与帕金森病运动症状相关[5-6]。因此,有必要在帕金森病患者特别是合并高血压或糖尿病等脑血管病危险因素的患者中,筛查有无脑小血管病的可能。然而,我国的脑组织病理学研究尚与国外存在一定差距,国外已有成熟的脑库(如哈佛脑库、欧洲脑库联盟、悉尼脑库等)助力脑组织病理学研究[25-26]。目前我国的脑库建设正在逐步发展过程中,随着法规和政策的完善、社会组织的宣传、群众观念的转变,大力推广临床病理相关性研究有利于我国神经科学的发展。
志谢感谢首都医科大学基础医学院神经生物学系杨慧教授提供磷酸化突触核蛋白抗体、首都医科大学附属北京天坛医院病理科董格红主任对样本处理及染色的支持,以及感谢为医学事业进行遗体组织捐献以促进医疗卫生事业发展的无私捐献者们!
利益冲突 无
