脑卒中康复患者脂代谢与骨密度的相关性
2021-07-06郑紫萱姚雅琦吴雪娇
陈 成,郑紫萱,姚雅琦,汝 毅,吴雪娇,陈 真
(1.上海市第一康复医院/同济大学附属康复医院(筹)神经康复中心,上海 200090;2.同济大学医学院,上海 200092)
骨质疏松(osteoporosis)是一种由于单位骨密度少于正常骨组织导致骨脆性增加的多元化临床综合征[1]。世界卫生组织将骨密度(bone mineral density,BMD)低于健康青年成人平均谷峰值的2.5个标准差定义为骨质疏松[2]。预计到2050年,全世界每年髋部脆性骨折的患者将增加到626万,而髋部骨折的致死率高达20%[3]。此外,骨折后的长期卧床患者极易并发肺部感染、泌尿系统感染及压疮等疾病,这将给患者家庭及社会带来沉重的经济负担。
研究表明,骨代谢和脂代谢之间存在着很强的关联,骨代谢过程中的成骨细胞和脂代谢中的脂肪细胞均由骨髓间充质干细胞分化而来,成骨细胞和脂肪细胞之间是此消彼长的关系,骨密度的减少常常伴随着骨髓腔内脂肪增多[4],而临床上高脂血症患者也常合并骨质疏松。近年的一些研究显示,由于高脂血症导致的骨代谢紊乱现象增多,加剧了骨质疏松疾病的发展[5,6-8],然而两者的关系并未完全确定。研究骨代谢与脂代谢指标之间的确定关系,可以为骨质疏松的防治提供理论依据。
以往研究[9]发现,与同龄健康男性和女性人群相比,中风患者发生髋部骨折的风险增加50%。因此充分认识脑卒中患者发生骨折的危险因素,及早有效控制危险因素可以减少骨折的发生,显著提高脑卒中患者的预后。本研究通过分析111例脑卒中住院康复患者的脂代谢指标及骨代谢指标与骨密度的关系,为脑卒中患者骨代谢异常发生机制的研究提供线索,以期为骨质疏松患者的治疗和预防提供理论依据。
1 资料与方法
1.1 一般资料
本研究采用回顾性研究方法,选取自2018年1月—2019年4月在上海市第一康复医院神经康复中心接受过骨密度检测的住院康复脑卒中患者111例。其中男性患者66例,女性患者45例(均为绝经后妇女),平均年龄(67.18±11.80)岁。所有患者均符合1995年中华医学会第四届脑血管疾病会议制定的诊断标准,并经头颅CT或头颅MRI证实。所有患者排除影响骨代谢性的疾病(原发性或继发性甲状旁腺功能异常、血液系统疾病、肾脏疾病、骨髓瘤或骨转移、严重肝功能不全及其他继发性骨质疏松的疾病),没有排除既往诊断骨质疏松用抗骨质疏松药物治疗的患者,所有患者均为脑卒中初发病例,在入院后启用抗骨质疏松治疗,入院后抗骨质疏松治疗病程不足1个月。骨质疏松是一种需要长期服药的慢性疾病,需要高达80%以上的依从性和至少3年的长期治疗时间才能达到最大的治疗效果[10]。Blackd等[11]更认为需要长达5年以上的治疗时间,甚至有的学者主张终身服药。
1.2 方法
采用美国通用公司(GE Medical Systems)的双能X线骨密度检测仪检测患者腰椎L1~L4、健侧股骨颈和健侧股骨近端的骨密度BMD(g·cm-2)。根据检测结果将患者分为骨密度正常组和异常组。收集患者一般资料,包括性别、年龄、现病史、既往史、家族史等。为排除治疗因素干扰,根据每位患者病史资料及检验报告,采集每位患者初入院时的血、尿、粪常规、血糖、血脂谱如总胆固醇、低密度脂蛋白(low-density lipoprotein,LDL)、高密度脂蛋白(high-density lipo-protein,HDL)、三酰甘油、载脂蛋白A1、载脂蛋白B、载脂蛋白E、脂蛋白a及同型半胱氨酸等数据。
1.3 评价标准
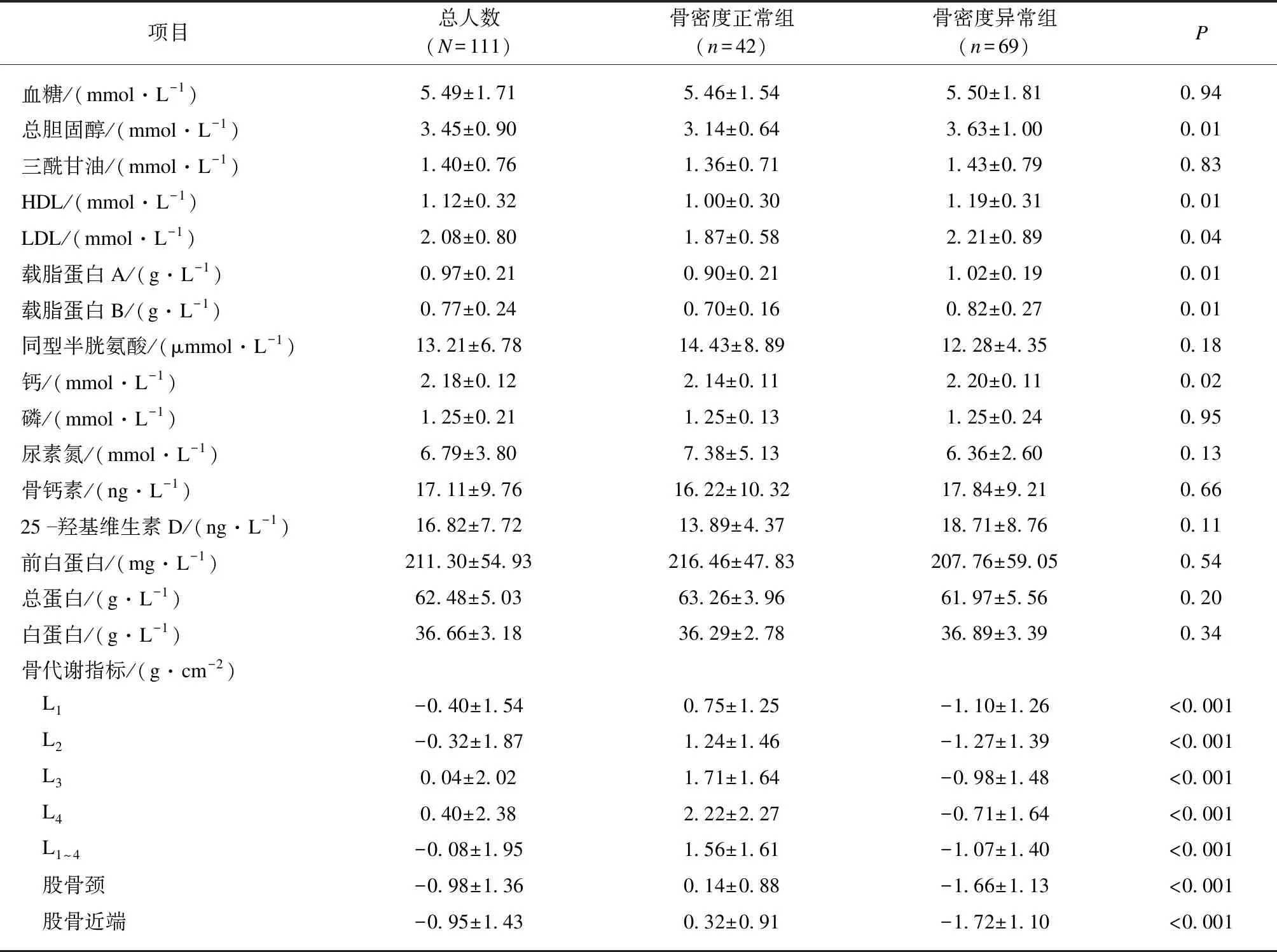
骨质疏松的诊断标准按照WHO制定的诊断标准,绝经后妇女和大于50岁男性的骨密度水平用T值表示。正常:T值≥-1.0、骨密度减少:-2.5 本研究共纳入111例脑卒中康复患者。根据双能X线检查结果分为骨密度正常组(n=42)和骨密度异常组(n=69)。骨密度正常组男性36例,女性6例,平均年龄(65.95.82±12.36)岁;骨密度异常组男性30例,女39例,平均年龄(67.92±13.44)岁,包括43例骨密度减少患者和26例骨质疏松患者。骨密度正常组13例有吸烟史,9例有饮酒史,骨密度异常组17例有吸烟史,10例有饮酒史。两组的基本信息差异无统计学意义。 骨密度正常组男性占比较大,骨密度异常组女性占比较大,差异有统计学意义(P<0.001)。两组间的胆固醇、HDL、LDL、载脂蛋白A、载脂蛋白B、血清钙以及各腰椎的骨密度、股骨颈骨密度和股骨近端骨密度的差异有统计学意义(P<0.05)。骨密度异常组总胆固醇、HDL、LDL、载脂蛋白A、载脂蛋白B、血清钙含量高于骨密度正常组,差异有统计学意义(P<0.05)。骨密度异常组的L1~L4的骨密度、股骨颈骨密度和股骨近端骨密度都显著低于骨密度正常组,差异有统计学意义(P<0.05),见表1。 表1 111例研究对象按骨密度的分组比较Tab.1 Comparison of BMD in between two groups 通过Pearson或者Spearman对各生化指标与骨密度的关系进行分析,结果显示,L1~L4骨密度平均值(L1~4)与总胆固醇(r=-0.19,P<0.001)、HDL(r=-0.35,P<0.001)、载脂蛋白A(r=-0.19,P=0.04)的水平呈负相关,与同型半胱氨酸(r=0.22,P=0.03)的水平呈正相关;股骨颈骨密度与血清HDL(r=-0.32,P<0.001)和载脂蛋白A(r=-0.27,P=0.004)呈负相关;股骨近端的骨密度与HDL(r=-0.28,P=0.001)和载脂蛋白A(r=-0.25,P=0.009)的水平呈负相关,且相关系数具有统计学意义。 以骨密度是否正常为应变量,分析脂代谢指标与骨密度的相关性。由于骨密度是否正常受患者各腰椎骨密度数值影响较大,所以在模型2中,本研究以骨密度分组(正常/异常)为因变量,以各腰椎(L1、L2、L3、L4、L1~4及股骨颈)骨密度值为共同的协变量,分析各脂代谢指标对骨密度的影响。结果显示,校正各腰椎骨密度数值后,性别、总胆固醇、三酰甘油、HDL、LDL和载脂蛋白B与脑卒中患者骨密度正常与否显著相关。其中,女性相对于男性是脑卒中康复患者骨密度降低的一个风险因素(OR:107.43,95%CI:5.31~2 175.09),此外风险因素还有总胆固醇(OR:7.20,95%CI:1.68~30.92)、三酰甘油(OR:4.77,95%CI:1.43~15.86)、LDL(OR:5.30,95%CI:1.42~19.82)和载脂蛋白B(OR:33.71,95%CI:1.74~653.24),均有统计学意义。 表2 脑卒中患者脂代谢指标与骨密度的二元Logistic回归分析Tab.2 Logistic analysis of BMD and clinical features 全世界每年因骨质疏松导致的骨折约900万例次。在一些发达国家,骨质疏松导致的手腕、髋部和脊椎骨折的终身风险为30%~40%[3],骨折等并发症严重影响患者的生活质量甚至增加患者的死亡风险。研究表明,成年人骨质疏松性骨折的患病率会随着年龄的增长而增加,在65~69岁的受试者中,大约50%受试者的骨矿物质含量低于骨折阈值,而几乎所有85岁以上的受试者骨矿物质含量都达到骨折的阈值,尤其老年女性具有较高的骨折风险[1]。目前,中国已经进入人口老龄化的时代,60岁及以上的老年人口约占总人口的17.9%,动脉粥样硬化和骨质疏松症等疾病的发病率也随着人口老龄化进程不断增加。近年的研究表明,脂代谢的紊乱不仅可以引起脂肪肝、冠心病、肾病综合征等疾病,脂代谢平衡的打破还能引起骨质疏松、骨质流失、骨关节炎等骨代谢相关疾病。骨质疏松症与高脂血症关联较大且随年龄增长,其原因可能为骨髓内骨细胞和脂肪细胞平衡被破坏。本研究着重分析脑卒中患者脂代谢与骨密度的关系,以期为脑卒中患者骨质疏松的早发现、早治疗提供指导,提高患者的生活质量和康复预后。 本研究结果显示,在康复科住院的脑卒中患者中,骨密度异常组女性比例高于骨密度正常组。骨密度异常组的总胆固醇、HDL、LDL、载脂蛋白A和载脂蛋白B含量高于骨密度正常组,而L1~L4,股骨颈和股骨近端的骨密度都低于骨密度正常组,提示脑卒中患者的脂代谢水平可能是其骨密度的影响因素,进一步的相关性分析显示,胆固醇、LDL、HDL、载脂蛋白A与股骨近端和股骨颈的骨密度呈负相关关系。 有研究表明,高龄人群的骨密度T值与颈动脉内膜中层厚度(intima media thickness,IMT)呈负相关,提示骨质疏松与动脉粥样硬化的发生有一定相关性[13]。其原因可能为骨髓中的钙溶解后进入体循环并最终沉积在动脉壁的内膜中,引起动脉粥样硬化,进而导致心脏、大脑、肾脏发生病理改变,造成骨组织的病理变化,如骨矿物质含量减少等,最终发展成为骨质疏松[14-16]。此外,脂代谢影响骨代谢还有可能与高脂导致抗氧化能力受损相关,氧化应激被认为是高脂血症导致动脉粥样硬化的原因之一,近年来的研究发现,一些氧化脂质既能引起心血管疾病也能导致骨质疏松症[5,17]。氧化脂质能够促进骨髓间充质干细胞向脂肪细胞分化,同时还能刺激破骨细胞生成、诱发炎症反应从而促进骨吸收,加剧骨的破坏[18]。还有研究显示,氧化LDL可以直接阻断成骨细胞分化,提示LDL是骨质疏松症的危险因素[19-20]。细胞识别和摄取LDL主要通过识别载脂蛋白B实现。载脂蛋白B由肝脏合成,存在于低密度脂蛋白表面,有向组织及细胞内运输胆固醇的功能,会促进动脉粥样硬化的发生。当载脂蛋白B增多时,即使LDL水平正常,也可以使动脉粥样硬化的发病率增高。本研究发现,脑卒中患者中骨密度异常组的血清LDL和载脂蛋白B的水平显著高于骨密度正常组;且二者都与骨密度呈显著的负相关,并且均为脑卒中患者骨密度降低的危险因素。 本研究还发现,总胆固醇和三酰甘油是脑卒中患者骨密度降低的危险因素。动物实验研究也表明脂代谢紊乱会造成破骨细胞活性增加。高脂饮食能促进前破骨细胞向破骨细胞分化,使破骨细胞体积增大、活性增强,从而促进骨吸收增加骨质疏松风险[21]。其次,脂代谢紊乱会造成骨髓腔内微循环障碍。在高脂血症大鼠模型中,骨髓腔中脂肪组织占比明显增高,血窦组织占比减少。脂肪堆积还增大了骨间隙压力,压迫腔内血管,最终导致骨组织血液供应不足,骨髓微循环减少,成骨减少,最终骨密度降低[22]。 多病共存是老年患者的特点,对于老年患有高胆固醇血症、冠心病、动脉硬化、代谢综合征、骨质疏松的患者来说,配合低脂饮食方式、适当应用降脂治疗,既可调脂干预心脑血管疾病的高危因素,又可以防止或延缓骨质疏松的进展[2]。2型糖尿病和骨质疏松是内分泌代谢领域最常见的慢性疾病,两者在老年人中往往同时存在,糖尿病患者代谢性骨病的发病率和骨质疏松骨折的危险性明显高于普通人群,其骨质疏松的发生率可达20%~60%[23]。长期的高血糖引起高渗状态导致渗透性利尿,促进钙、磷的排出,抑制钙磷的重吸收,低钙又会刺激甲状旁腺激素的分泌,高血糖可致成骨细胞对甲状旁腺激素敏感性降低,最终引起甲状旁腺激素升高动员骨钙入血,引起骨密度降低[24];糖尿病病程越长,高渗状态的毒性越大,引起骨质疏松的风险也越大;长期的高血糖,会逐渐形成糖基化终末产物,促进IL-1、IL-6、TGF等细胞因子的释放,导致骨质疏松。 脑卒中后患者运动障碍肢体活动减少,使骨骼组织失去了机械应力的刺激,当骨骼受到的机械应力刺激减少时可导致破骨细胞的活性增强,进而导致骨骼组织容易被吸收,机体内骨密度明显减少,最终引起不同程度的骨质疏松症[25],增加日常活动量可降低骨质疏松的发病率,而中、重度卒中患者,特别是老年人群,往往瘫痪后卧床,卧床后的制动可引起高钙血症、高钙尿症,加速骨的吸收引起骨质疏松。有研究表明,在卒中发病后1年内一直坐轮椅的患者中,偏瘫侧股骨颈BMD的骨量丢失高达13%;卒中发病后2个月内重新学习行走以及在研究期间始终能行走的患者骨量丢失分别为8%和3%[26]。另一项研究显示,健康青年男性志愿者卧床仅5周,胫骨BMD减少高达3%[27],卧床后随着瘫痪肌肉机械运动频率和对骨组织的作用力大小和方向,引起骨胶原基质缩短和电信号减弱,引发废用性骨质疏松。有多项研究证实,运动锻炼有助于增加骨量改善骨质疏松,因此增加相应的康复训练,可能有助于预防骨质疏松[28-29]。 本研究聚焦于分析脑卒中这一特定疾病人群脂代谢与骨密度的相关性,但仍存在不足之处,样本量小,未设置非脑卒中组作为对照。因大部分受试者独立的站立位功能障碍,不便测量体质量,导致体质量指数(body mass index,BMI)无法获取,未能分析BMI对骨密度的影响。以往有研究认为抗骨质疏松药物治疗需要高达80%以上的依从性和至少3年的长期治疗时间才能达到最大的治疗效果,今后的多中心研究中应更全面地考虑抗骨质疏松药物对骨密度的影响。本研究为回顾性分析,仅通过患者的病历资料分析脂代谢、骨代谢与骨密度的相关性,具体分子学机制及防治措施以及其他可能影响骨密度的因素仍需要开展进一步的临床试验与基础试验加以研究和证实。 综上所述,脑卒中后康复患者的脂代谢异常与骨质疏松症发病有一定的相关性。脑卒中后康复患者需要注意血脂的监测和相关治疗,对于早期发现骨密度减少并预防其进一步发展为骨质疏松有着重要作用,也为患者的康复治疗及预防骨折的发生提供参考。1.4 统计学处理
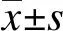
2 结 果
2.1 一般资料
2.2 脂代谢及骨代谢指标的比较
2.3 骨密度与各生化指标的相关性分析
2.4 脑卒中患者脂代谢指标与骨密度的二元Logistic回归分析

3 讨 论
