间断束缚和单次束缚对抑郁小鼠模型建立的影响
2021-07-06夏忠源秦家骏陈先震
夏忠源,秦家骏,陈先震
(南京医科大学上海十院临床医学院神经外科,上海 200072)
慢性束缚应激模型是将啮齿类动物重复地置于束缚器具内,在一段时间内限制其行动自由来达到造模目的。尽管已有大量文献证实慢性束缚能够诱导产生抑郁样行为[1-2],但也有报道表明随着束缚时间的延长,动物逐渐适应被束缚的状态,机体应激反应也会随之减弱[3]。慢性不可预知温和刺激(chronic unpredictable mild stress,CUMS),是一种经典的抑郁动物建模方法。根据CUMS原则,在每日束缚总时长不变的情况下,适当增加束缚次数更符合CUMS中的不可预知原则,或可提高建模效果并减少实验动物对刺激的适应。本研究据此假设开展实验,比较两种不同束缚频次对小鼠抑郁模型建立的影响。
1 材料与方法
1.1 试剂与仪器
自制可调节束缚管、悬尾装置见图1A、B;Med旷场红外追踪系统(型号:MED-OFA-RS)购自美国MED Associates公司;冰冻切片机购自德国Leica公司;激光共聚焦显微镜购自日本Nikon公司;立体定位仪购自中国深圳市瑞沃德生命科技有限公司。
AAV2/9-hSyn-CRE-EGFP-3Flag-WPRE-PA和AAV2/8-hSyn-DIO-tdTomato-WPRE-bGHpA购自上海泰儿图生物科技有限公司;兔抗Iba1、兔抗PTEN和兔抗BDNF购自Abcam公司;兔抗GAPDH购自上海雅酶生物医药科技有限公司;增强化学发光试剂显影购自默克公司;小鼠 IL-1βELISA Kit、IL-6 ELISA Kit和TNF-α ELISA Kit购自上海碧云天生物技术有限公司。
1.2 实验动物
6周龄SPF级雄性C57BL/6J 小鼠75只购自北京维通利华实验动物技术有限公司,随机分为对照(Con)组、单次束缚(constant group,CR)组和间断束缚(intermittent restraint,IR)组,每组各25只,常规饲养于同济大学医学院实验动物中心。
1.3 方法
束缚开始前所有小鼠进行1次糖水偏好实验(sucrose preference test,SPT),悬尾实验(tail suspe-nding test,TST)和强迫游泳(forced swimming test,FST)。之后CR组和IR组每2周进行SPT、TST和FST。所有小鼠每周称体质量。为了减少对照组受到的刺激,对照组除了每周常规称量体质量之外不再进行行为学检测。行为学检测顺序:完成SPT后,次日进行TST,再次日进行FST。每项行为学测试结束当天让小鼠休息,不再进行束缚操作。CR组每日7:00开始不间断束缚6 h。IR组每天束缚3次,每次2 h,总时长亦为6 h。每次束缚中间间隔时间至少2 h。控制IR组束缚时间段为7:00~19:00。一共束缚6周。束缚刺激结束后所有小鼠进行旷场实验。最后进行组织学实验。
1.3.1 束缚 将小鼠装进束缚管内,见图1A,调整至适当的松紧度,环境温度维持26 ℃。束缚管每日清洗1次。
1.3.2 称量 实验期间75只小鼠每周称量一次体质量。完成体质量称量后让小鼠休息2 h,然后进行后续行为实验。
1.3.3 SPT 开始束缚前,75只小鼠进行SPT,糖水浓度为1%。检测结果作为束缚后观察组小鼠的对照使用。随后对CR和IR组每2周检测1次糖水偏好值。本实验糖水偏好实施简要过程:所有小鼠断水断粮孤养12 h,随后每笼放入预先称好重量的糖水瓶和白水瓶各1只,水瓶外观均相同,对称放置,相对固定在笼盖上,水瓶出水口高度基本一致,同时确保水瓶无滴漏现象,小鼠自由饮水。并且测试中间时间点更换1次糖水瓶和白水瓶位置,以尽量减小可能存在的小鼠饮水的位置偏好性。记录12 h后各水瓶重量。测试前后水瓶重量差即为糖水或白水消耗量。糖水偏好值=糖水消耗量/(糖水消耗量+白水消耗量)。
1.3.4 悬尾实验 小鼠尾部套圆柱形透明管,防止悬挂过程中小鼠抱腿。胶带一端粘住鼠尾,另一端用胶带固定在自制的悬尾支架上。尽量保证每只小鼠头部到平台距离相同,见图1B。悬挂6 min,记录后4 min小鼠相对静止的时间。本次实验中,相对静止时间包括但不限于完全静止状态,小鼠四肢仅微动也视为放弃挣扎或相对静止。强迫游泳计时方法同理。悬尾实验和强迫游泳当天均不再进行束缚操作。
1.3.5 强迫游泳 在悬尾实验之后次日进行。取容积为2 L的透明玻璃大烧杯,装无菌蒸馏水到适当高度(约1 800 mL,保证小鼠有效悬浮)。水温(25±1) ℃,每次均于同一方向同一位置放入小鼠,开始录像并计时6 min,记录后4 min内小鼠放弃挣扎的时长。计时结束后取出小鼠,用吸水纸轻擦多余水分。放回笼内充分休息。更换蒸馏水进行下一只测试,见图1C。
1.3.6 旷场实验(open field test,OFT) 旷场等分为25个相同方块。周边16块为周围区域,中间9块为中间区域。小鼠运动数据由Noldus information technology Inc.Nethelands记录,探索行为由小鼠在不同区域停留时间反映,见图1D。

图1 实验实拍图片Fig.1 Live shots in experimentA:可调节束缚器具;B:自制悬尾装置;C:强迫游泳;D:旷场实验
1.3.7 病毒颅内注射 Con、CR、IR每组小鼠各3只进行颅内药物注射。AAV2/9-hSyn-CRE-EGFP-3Flag-WPRE-PA和AAV2/8-hSyn-DIO-tdTo-mato-WPRE-bGHpA按照1∶2 000稀释后混合使用(以下简称AAV)。(1) 麻醉:戊巴比妥钠按照1 g/kg 体质量腹腔给药;(2) 小鼠开颅:固定小鼠头部;酒精消毒,刀片备皮,眼科剪刀剪开头皮,双氧水棉球擦拭以显露颅缝;立体定位仪确定进针部位,磨钻磨开颅骨,显露前额叶脑组织表面;(3) 注射:玻璃毛细管加热制作细针,吸取500 nL AAV混合液;注射位置为中线旁开0.5 mm,Bregma前1.5 mm,深度1.8 mm。针尖在颅内维持5 min后拔针;安尔碘消毒,丝线妥善缝合头皮,消毒;次日开始束缚实验。
1.3.8 脑组织切片 神经元形态观察与统计行为实验结束后取AAV注射后小鼠,4%PFA灌流取脑,制作冰冻切片,尼康显微镜下观察被病毒示踪的神经元,Image J软件统计神经元包体大小,Sholl analysis软件统计神经元树突数量,每组小鼠神经元计数大于20个。
行为实验结束后取3组小鼠各3只,4%PFA灌流取脑,制作冰冻切片,进行组织化学染色,荧光显微镜下观察海马区小胶质细胞。抗体选用兔抗Iba1。
1.3.9 Western印迹法检测小鼠前额叶PTEN和海马BDNF表达 取3组小鼠各3只,脱颈处死取脑组织,分离出前额叶(prefrontal cortex,PFC)与海马(hippocampus,HPC),RIPA裂解液处理提取组织蛋白。上样缓冲液稀释,煮沸10 min备用。上样体积20 μL,SDS-PAGE浓度10%。抗体选用兔抗PTEN、兔抗BDNF、兔抗GAPDH。蛋白条带通过增强化学发光试剂显影。
1.3.10 酶联免疫吸附实验 (1) 准备组织样品行为实验结束后取各组小鼠各3只,脱颈处死,取脑组织,分离出前额叶和海马部分,放于预冷PBS(0.02 mol/L)中清洗去除血液,称重备用;每1 g 样品加入5 mL PBS匀浆,先用玻璃匀浆器,进一步用超声破碎匀浆液;离心半径 9.5 cm,5 000 r/min,离心5 min,留取上清液备用。(2) 严格按照IL-1β试剂盒使用说明书进行检测。检测孔颜色的深浅与样品中IL-1β水平呈正相关。用酶标仪在450 nm波长处测定吸光度(A450)值,IL-1β与吸光度值之间呈正比,通过绘制标准曲线计算样品中IL-1β的浓度。同法可测得IL-6和TNF-α浓度。
1.4 统计学处理
采用GraphPad Prism 8.2软件,计量资料的多组间单因素分析采用单因素方差分析或秩和检验,两组比较采用t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 体质量比较
束缚第3周IR组和对照组小鼠体质量差异有统计学意义(P<0.000 1)。到第5周时,IR组小鼠体质量明显低于CR组,差异具有统计学意义(P=0.008 4),见图2A。
2.2 糖水偏好值比较
SPT被认为可以反映动物快感缺失程度,目前广泛应用于抑郁相关动物实验研究中。本实验中分别在束缚开始前以及束缚过程中的第2、4、6周检测小鼠的糖水偏好值,并比较各组间差异。束缚第4周时CR组SPF较束缚前有下降,差异有统计学意义(P=0.043 7)。此时CR组和IR组尚无差异,至第6周时,CR组SPF值基本稳定,但IR组SPF值进一步下降,CR组和IR组间比较差异具有统计学意义(P=0.040 7),见图2B。
2.3 悬尾静止时间比较
束缚2周后悬尾不动时间较束缚前延长(P<0.000 1),但CR组和IR组之间差异无统计学意义(P=0.297 3)。束缚4周时,两组小鼠不动时间均较束缚前显著延长,且IR组较CR组延长更明显,两组间差异有统计学意义(P=0.003 3),见图2C。
2.4 强迫游泳静止时间比较
经过2周的束缚后,CR组和IR组小鼠后4 min内不动时间与束缚前相比均有所延长,但各组间差异不明显(P>0.05)。束缚4周后两组不动时间均延长,IR组平均不动时间长于CR组,差异有统计学意义(P<0.000 1),见图2D。

图2 各组间小鼠体质量和行为学实验结果比较Fig.2 Body weight and behavioral tests of Con,CR and IR miceA:小鼠体质量随束缚时间变化图;B:糖水偏好值随束缚时间变化图;C:悬尾不动时间随束缚时间变化图;D:强迫游泳不动时间随束缚时间变化图;E:旷场实验各组小鼠周围区域停留时间;F:旷 场实验各组小鼠中央区域停留时间;*P<0.05,**P<0.01
2.5 OFT比较
OFT结果显示,经过束缚后各组小鼠探索行为较对照组减少,间断束缚小鼠探索行为减少更明显,表现为CR和IR组小鼠中央区域停留时间明显少于对照组,且IR组中央区域停留时间短于CR组,差异有统计学意义(P<0.05)。
2.6 各组小鼠前额叶PTEN和海马BDNF表达水平
Western印迹法检测海马组织BDNF以及前额叶PTEN,发现间断束缚小鼠海马组织BDNF表达水平最低,前额叶PTEN表达水平明显高于对照组和单次束缚组。对照组和单次束缚组之间BDNF与PTEN表达差异不明显,见图3。
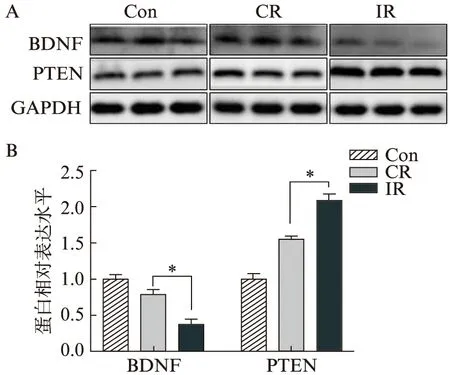
图3 各组小鼠前额叶PTEN和海马BDNF表达水平Fig.3 Results of PTEN expression level in PFC and BDNF expression level in HPCA:Western印迹条带图;B:各组蛋白相对表达水平比较;n=3,*P<0.05
2.7 不同束缚频次小鼠前额叶炎症因子表达水平
经过束缚后,小鼠前额叶皮层和海马IL-1β、IL-6和TNF-α炎症因子水平升高;IR小鼠海马区产生较多IL-1β和IL-6,且与CR小鼠相比,差异有统计学意义(P=0.012,P=0.008),见图4。
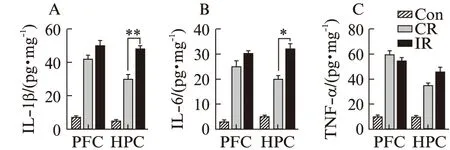
图4 各组小鼠前额叶和海马区炎症因子水平Fig.4 Expression levels of proinflammatory cytokines in depression-related brain areas(shown by ELISA)各组小鼠抑郁相关脑区炎症因子表达水平;A:IL-1β;B:IL-6;C:TNF-α
2.8 小鼠PFC区神经元和海马小胶质细胞的比较
单次束缚组小鼠PFC区发现部分锥体神经元胞体变小,树突分支减少,见图5A。Image J软件和Sholl analysis软件定量统计结果显示,IR组小鼠神经元的胞体大小与CR组相比明显减小,见图5B;树突分支数量减少,见图5C。IR组小鼠海马Iba1标记的小胶质细胞数量较多,且存在局部聚集性分布现象,CR组和Con组小鼠小胶质细胞数目和分布表现相似,见图5A。镜下活化的小胶质细胞胞体变大,突起变短。比较单位面积内前额叶和海马区域小胶质细胞数目发现束缚后小胶质细胞数目增多,但CR与IR组间差异不明显,见图6。
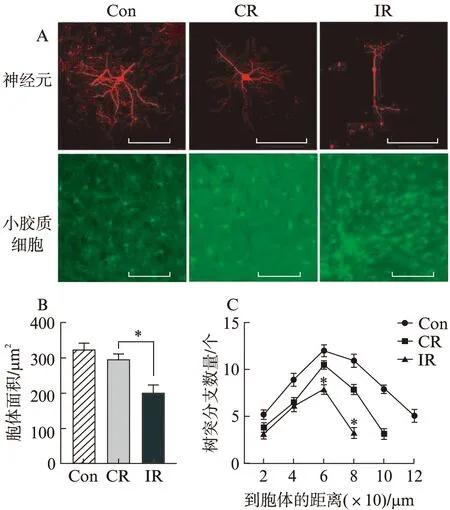
图5 小鼠PFC神经元和HPC小胶质细胞形态Fig.5 Morphology of nerons in PFC and morphology of microglia in HPCA:小鼠PFC神经元和HPC小胶质细胞形态,标尺为100 μm;B:各 组小鼠神经元胞体大小;C:各组小鼠神经元树突分支情况;每组小鼠的神经元个数≥20个,与CR组相比,*P<0.05
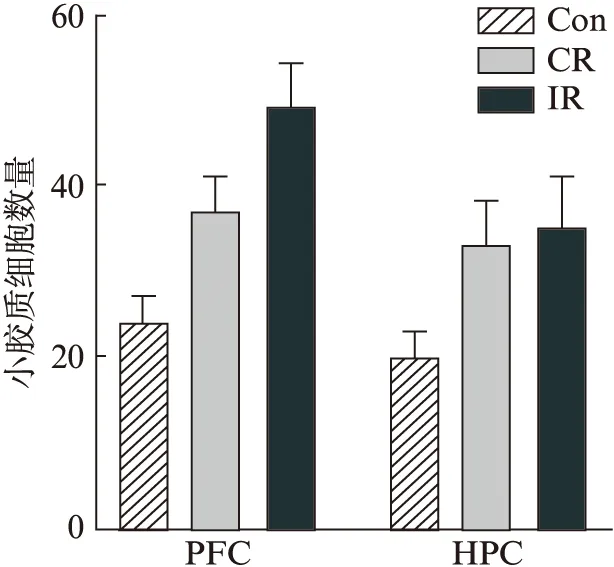
图6 各组小鼠PFC和HPC区小胶质细胞密度的比较Fig.6 Comparison of microglia density among groups
3 讨 论
抑郁呈现持续性精神低落和情绪障碍,是全世界最常见和最突出的精神障碍之一[4]。抑郁症与平时的情绪波动和日常生活中短暂应激造成的情绪反应不同,抑郁症尤其是持续的中度或重度抑郁可对健康状况造成严重损害。合理有效的抑郁动物模型对于抑郁症的研究至关重要。抑郁症的病因多种多样[5],相应地,抑郁动物模型的建立方法也不单一,研究者们常根据不同的实验目的和需求等采取不同的造模方法。抑郁动物模型根据其造模方法不同可分为以下几种:获得性无助模型、慢性不可预知温和应激模型、嗅球损伤模型、糖皮质激素/皮质酮诱导模型、社会失败模型、早期应激模型、先天获得性无助模型以及转基因模型等[6]。束缚是一种慢性温和刺激,该种应激特征类似于引起人类抑郁症的各种慢性持续的可预知的应激,因而被广泛应用于抑郁症的相关研究[7]。但是束缚法建立抑郁小鼠模型目前尚无统一建模标准,具体实施方法存在差异,必然对建模成功率有影响。实施方法的差异主要体现在束缚时间、束缚次数、束缚器具和束缚环境等方面。目前较主流的束缚小鼠方法是用50 mL 带孔离心管,每天束缚6 h。Chiba等[8]每天束缚6 h,连续28 d。Hageman等[9]每天束缚6 h,连续21 d。孙楠楠等[10]每天4 h,连续束缚21 d,建立慢性束缚刺激抑郁症模型。本实验采取可调节束缚管,每天束缚6 h,连续束缚6周。然而有文献报道,由于束缚刺激的应激因子过于单一,长时间束缚或可导致小鼠适应束缚环境,导致模型不稳定[11],偏离CUMS不稳定原则,因此在保证总时长相同的情况下,采用分次束缚避免小鼠对长时间单一刺激因素的适应,不仅具有可行性,而且更符合CUMS原则。因此本实验在以往慢性束缚方法基础上进行改良,在每日束缚总时长不变的情况下通过增加每日束缚次数建立C57BL/6J小鼠抑郁症模型,并通过体质量及4项行为学实验、前额叶PTEN和海马BDNF表达水平、镜下观察前额叶锥体神经元胞体大小和树突分支数量以及海马区小胶质细胞表型等比较两种频次束缚方式的实际效果。
在CUMS抑郁症动物模型中,模型组小鼠较正常对照组体质量减轻。通过小鼠体质量变化模拟人类抑郁症患者体质量降低,间接反映束缚刺激对小鼠带来的影响大小。本实验中每周测量体质量发现束缚第2周开始,两束缚组小鼠体质量即呈下降趋势,对照组体质量仍继续缓慢升高。说明束缚2周即会对小鼠体质量产生影响。尽管在TST中第2周就检测到IR组与Con组差异有统计学意义,但本研究不认为束缚1~2周可以导致动物抑郁。因为短时间刺激导致动物产生焦虑情绪,而长时间应激反应能使动物抑郁情绪显著增加[12]。焦虑和抑郁同属一种类型的神经疾病,两者的生物学基础和临床表现具有一定的相似性。但是焦虑和抑郁之间的转化往往存在一个时间节点,该时间节点的标准尚未有定论[13-14]。因此为了获得稳定可靠的抑郁小鼠模型,较长周期束缚是较为稳妥的选择。
糖水偏好实验是根据动物对甜味的偏好而设计的一种检测方法,用实验动物的糖水偏好降低来模拟人类抑郁症患者快感缺失。当动物出现抑郁样行为时,其对糖水的偏好程度降低。本实验中束缚后的小鼠糖水偏好值均降低,即两组小鼠均出现快感缺失症状。仅在第6周结束后才检测到两观察组组间具有差异。结合第5周IR组小鼠体质量继续下降,但CR组体质量停止下降的现象,提示间断束缚随束缚周期的增加对小鼠的影响越来越多大。而单次束缚对小鼠的刺激相对温和,引起的抑郁样表现随时间变化相对平缓。
研究表明,慢性束缚不仅可以引起实验动物抑郁样行为,如糖水摄入量减少[15-16],还可引起前额叶和其他脑区神经元突触萎缩、突触数量减少[17-18]。本实验分别计数3组小鼠PFC区神经元突触数量,发现间断束缚小鼠PFC区神经元突触数目减少更明显,另外发现IR组部分神经元胞体缩小现象,该结果佐证了以往研究,表明通过间断束缚建立了一批行为学与组织学特征较明显的抑郁小鼠模型。
抑郁症被认为与HPA轴过度激活有关。研究表明,PTEN通过影响HPA轴引起小鼠抑郁样表现[19]。PTEN表达上调导致神经元树突分支减少[20]。BDNF是哺乳动物神经系统最丰富的神经营养因子[21]。慢性应激使HPA轴被激活,糖皮质激素水平升高,过多的糖皮质激素对于海马颗粒细胞具有明显的神经毒性,这种毒性和刺激因子会导致海马体和cAMP反应元件结合蛋白减少,从而影响BDNF的表达。因此PTEN表达上调和BDNF表达下调与慢性束缚引起的HPA轴过度激活有关。本实验通过Western印迹法显示间断束缚小鼠PFC区PTEN高表达,海马BDNF低表达,该结果较好地反映了间断束缚更容易导致HPA轴的过度激活。
炎症因子与抑郁症关系密切。研究表明,抑郁症与炎症分子的表达增加有关。心理和社会压力会增加人体炎症细胞因子的水平,而炎症细胞因子的注入(例如干扰素)会产生具有抑郁特征的疾病行为。抑郁症患者血清中IL-1、IL-6和TNF-α水平升高,抗抑郁治疗后细胞因子水平恢复正常。最近的研究表明,炎症小体激活在应激效应中发挥作用[22]。TNF-α和IL-1β通过调控PI3K-Akt信号通路,抑制突触可塑性进而加重抑郁症的症状[23]。
小胶质细胞是大脑内常驻的免疫细胞,对调节大脑发育、维护神经网络,以及组织损伤修复等多种中枢神经系统生理功能中发挥重要作用。暴露于慢性应激条件下的小鼠小胶质细胞发生分支变短变粗,胞体变大,细胞数量增加[24]。通过对各组小鼠海马区小胶质细胞Iba1进行染色发现,间断束缚后的小鼠海马区小胶质细胞数量明显增多,反映海马中炎性反应更明显,间接反映抑郁程度更明显。
综上所述,本实验采取两种不同频次的束缚方法(间断束缚和单次束缚法)经过6周束缚均可以成功地建立一批具有行为学改变特征以及组织、细胞水平改变特征的抑郁小鼠模型。且间断束缚的小鼠无论是从行为学或是组织学、细胞学方面均优于单次束缚组。因此本次研究初步证明在每天总束缚时长不变的情况下适当增加束缚次数更容易引起小鼠C57BL/6J小鼠抑郁样表现。研究结果为慢性束缚法建立小鼠抑郁模型提供了参考依据。
