棘胸蛙蝌蚪尾部皮肤和肝脏对pH 急性胁迫及恢复的抗氧化应答特征
2021-07-06刘哲宇申屠琰朱卫东王志铮
刘哲宇,申屠琰,杨 程,朱卫东,王志铮
(1.浙江海洋大学水产学院,浙江舟山 316022;2.余姚市水产技术推广中心,宁波余姚 315400)
棘胸蛙Quasipaa spinosa 素有“百蛙之王”之美誉,是一种极具养殖开发潜力的经济蛙种。开展棘胸蛙养殖已成为当前我国南方丘陵山区脱贫致富的重要途径之一。近年来,随着我国生态环境保护力度的加大以及各地新一轮养殖水域滩涂规划的密集出台和坚决落实,棘胸蛙山区传统养殖发展空间日益受限,大力实施棘胸蛙平原集约化养殖与山区生态化放养相结合的养殖新模式现已成为推进我国棘胸蛙养殖产业转型和健康可持续发展的必由之路。蝌蚪既是棘胸蛙在水体环境中生长发育的关键阶段,也是实施棘胸蛙平原集约化养殖的重要环节。基于环境友好的水质控制是保障水产动物集约化养殖正常运行的关键,因此精准掌握水产动物适宜的水质理化环境要求就显得十分必要。但目前国内关于水质理化因子对棘胸蛙蝌蚪生理生态的影响研究仅涉及水温和氨氮[1-5],而有关pH 的影响研究则迄今尚未见报道。
pH 因作为指示水体酸碱电离平衡状况和综合反映水质优劣程度的重要理化指标,而成为评价水产养殖水体环境是否达标的必检项[6]。研究表明,pH 易变的养殖水体,不仅可通过影响水中物质的存在形式和迁移过程间接毒害水生动物,而且还可通过直接影响水生动物的载氧能力麻痹其呼吸中枢,pH 过高或过低均可以破坏水生动物的抗氧化酶活性并引发多种机体损伤症状[7-8]。因此,找寻养殖对象的适宜pH 范围并探究其对pH 胁迫的生理生态应答过程与机制一直是水产养殖生态学研究的常规命题之一。无尾类蝌蚪皮肤具高渗透性,具呼吸和渗透压调节等多种功能,且机体总耗氧量的60%源自于皮肤[9],当其受到污染胁迫时,在细胞、组织及生理生化水平上都会发生显著变化,而被认为是开展毒理学研究的理想材料之一[10-11];肝脏是脊椎动物的代谢中枢、解毒中心和主要耗氧器官,具较强的抗氧化酶系统[12],环境因子的剧烈变化能增强肝脏细胞中氧化酶系统的活力,从而产生较多的活性氧自由基[13],两者均是棘胸蛙蝌蚪响应水质理化因子急性胁迫的重要靶器官[1-3]。鉴于此,本文作者较系统地开展了棘胸蛙蝌蚪尾部皮肤和肝脏对pH 急性胁迫及恢复的抗氧化应答研究,以期为棘胸蛙蝌蚪的安全养殖和相关抗逆生理学研究提供科学依据。
1 材料与方法
1.1 材料
1.1.1 实验用水
实验水源为经48 h 自然曝气的自来水,水温(24±0.2)℃、DO(7.30±0.01)mg·L-1、pH(7.30±0.01),水质符合《NY 5051-2001 无公害食品 淡水养殖用水水质》要求。采用AR 级浓HCl 及NaOH 调制实验用水的pH,现配现用。
1.1.2 供试蝌蚪
购自余姚市陆埠镇石门村下鲁石蛙养殖场的1 月龄同生群个体。运送至浙江海洋大学水产安全养殖实验室,即刻停食并暂养于若干规格为80 cm×50 cm×42 cm 的白色塑料水槽(实际容积75 L)内,暂养期间及时捞除死亡个体,日换水1 次,换水率为100%。静水停食2 d,待彻底排空体内粪便后,选取其中体表光滑、体色相近、反应灵敏、游动活泼的健康个体作为研究对象,具体规格为体长(1.932±0.204)cm、体质量(1.386±0.055)g。
1.2 实验方法
经预实验,确定pH 急性胁迫下蝌蚪96 h 全活范围后,按等差法设置5.5、6.5、7.0、7.5、8.5 和9.5 等6个pH 实验梯度组,每个实验梯度组设3 个重复,每个重复各投放蝌蚪10 ind(实验密度为200 ind·m-3),采用静水停饲实验法按时随机取样供试蝌蚪作为测定样本。其中,急性胁迫取样时点分别为24、48、72 和96 h;pH 恢复为7.0,取样时点分别6 d 和12 d。每一取样时点各实验梯度组的测定样本量均为3 ind。取样后,即刻将样本置于冰盘上,逐尾剪取肝脏和尾部皮肤组织并依次放入已编号的取样袋后,即刻存放于-80 ℃超低温冰箱内备测。
尾部皮肤组织的测定指标为ATP 酶、SOD 酶和CAT 酶活力,肝脏的测定指标为SOD 酶、CAT 酶和GSH-Px 酶活力。完成上述测定指标所需的测试盒均购自南京建成生物工程研究所,并均按所附说明书要求完成上述指标的测定。
1.3 数据处理
2 结果
2.1 尾部皮肤的ATP 酶活力
由图1 可见,实验期间蝌蚪尾部皮肤ATP 酶活力的变化特征主要表现为:(1)pH 急性胁迫阶段,各测定时点的酶活力随pH 升高大体上均呈先降后升的趋势,且谷底值均出现于pH 7.5 实验组(P<0.05),以pH 7.5 实验组为界,pH 大于7.5 实验组别的酶活力均显著低于pH 小于7.5 的实验组别(P<0.05);(2)pH 恢复阶段各测定时点的酶活力变化趋势与急性胁迫阶段类似,所不同的是pH 7.0 实验组与pH 8.0 实验组之间,以及pH 6.5 实验组与pH 8.5 实验组之间的酶活力均无显著差异(P>0.05),且各实验组组内恢复6 d 和12 d 的酶活力也均无显著差异(P>0.05);(3)以96 h 酶活力为参照,恢复阶段仅pH 7.0 和pH 7.5 两实验组的酶活力与相对应的参照组无显著差异(P>0.05),其它实验组的酶活力均显著大于相对应的参照组(P<0.05)。综上可知,就皮肤ATP 酶活力而言,棘胸蛙蝌蚪偏好弱碱性环境,以pH 7.5 最为适宜,pH 急性胁迫对蝌蚪皮肤生理功能具持久性影响。

图1 不同pH 条件下棘胸蛙蝌蚪尾部ATP 酶活力的变化Fig.1 The ATP activity in Q.spinosa tadpole tail in different pH
2.2 尾部皮肤和肝脏SOD 酶活力
由图2 和图3 可见,实验期间蝌蚪尾部皮肤和肝脏的SOD 酶活力变化特征主要表现为:(1)pH 急性胁迫阶段,各测定时点尾部皮肤和肝脏酶活力均大体上随pH 升高表露先升后降的趋势,且峰值均出现于pH 7.5 实验组(P<0.05);(2)pH 恢复阶段,各测定时点尾部皮肤和肝脏酶活力随pH 升高均表露为“上升—稳定—下降”的趋势,各实验组组内酶活力均无显著差异(P>0.05),其中尾部皮肤和肝脏酶活力组间无显著差异的则分别为pH 7.0、7.5 实验组和pH 7.0、7.5 和8.0 实验组(P>0.05);(3)以96 h 酶活力为参照,尾部皮肤和肝脏在恢复阶段与相对应的参照组无显著差异的实验组仅分别为pH 7.5 实验组和pH 7.0、7.5 实验组(P>0.05),其它实验组酶活力均显著大于相对应的参照组(P<0.05)。综上可知,就SOD 酶活力而言,pH 急性胁迫对棘胸蛙蝌蚪皮肤和肝脏的生理功能具持久性影响,其中皮肤较肝脏对pH 急性胁迫更显敏感,两者均偏好弱碱性环境,适宜范围分别为7.0~7.5 和7.0~8.0,均以7.5 最为适宜。

图2 不同pH 条件下棘胸蛙蝌蚪尾部SOD 酶活力的变化Fig.2 The SOD activity in Q.spinosa tadpole tail in different pH
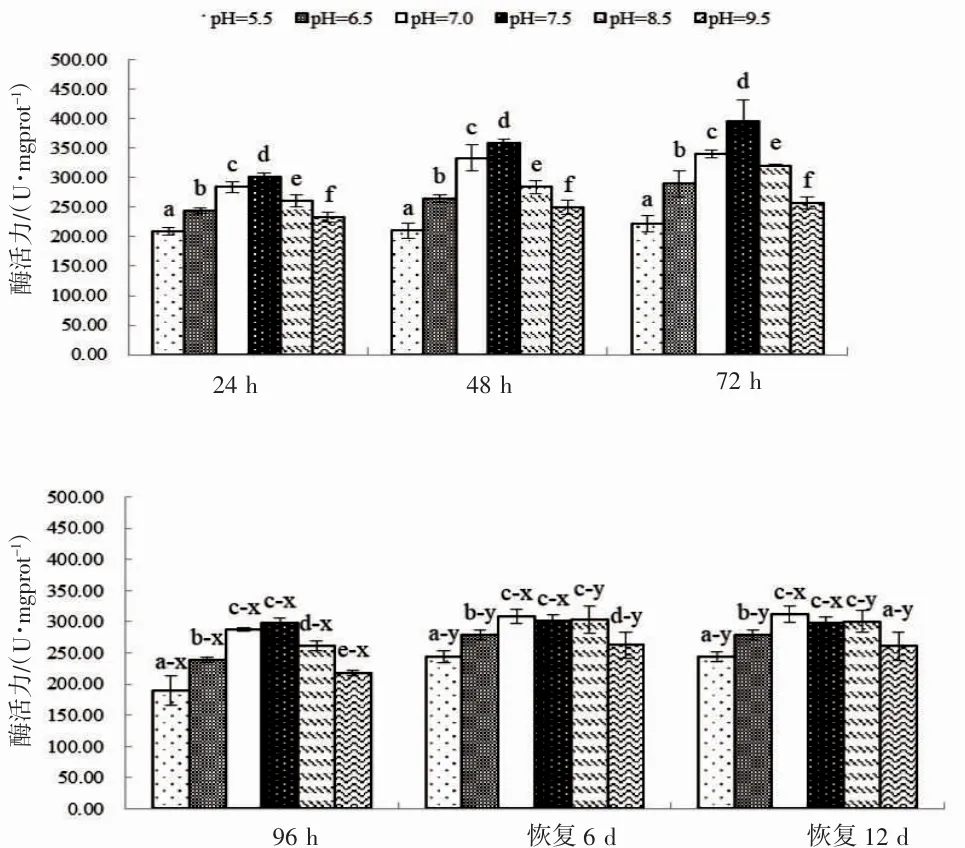
图3 不同pH 条件下棘胸蛙蝌蚪肝脏SOD 酶活力的变化Fig.3 The SOD activity in Q.spinosa tadpole liver in different pH
2.3 尾部皮肤和肝脏CAT 酶活力
由图4 和图5 可见,实验期间蝌蚪尾部皮肤和肝脏的CAT 酶活力变化特征主要表现为:(1)pH 急性胁迫阶段,各测定时点尾部皮肤和肝脏酶活力均大体上随pH 升高表露先升后降的趋势,且峰值绝大多均出现于pH 7.5 实验组(P<0.05);(2)pH 恢复阶段,各测定时点尾部皮肤和肝脏酶活力随pH 升高均表露为“上升—稳定—下降”的趋势,各实验组组内酶活力均无显著差异(P>0.05),组间无显著差异的则仅为pH 7.0 和7.5 两实验组(P>0.05);(3)以96 h 酶活力为参照,尾部皮肤和肝脏在恢复阶段与相对应的参照组无显著差异的均仅为pH 7.0 和pH 7.5 两实验组(P>0.05),其它实验组酶活力均显著大于相对应的参照组(P<0.05)。综上可知,就CAT 酶活力而言,pH 急性胁迫对棘胸蛙蝌蚪皮肤和肝脏生理功能均具持久性影响,其中皮肤与肝脏对pH 急性胁迫的敏感性相近,两者均偏好弱碱性环境,且均以7.5 最为适宜。
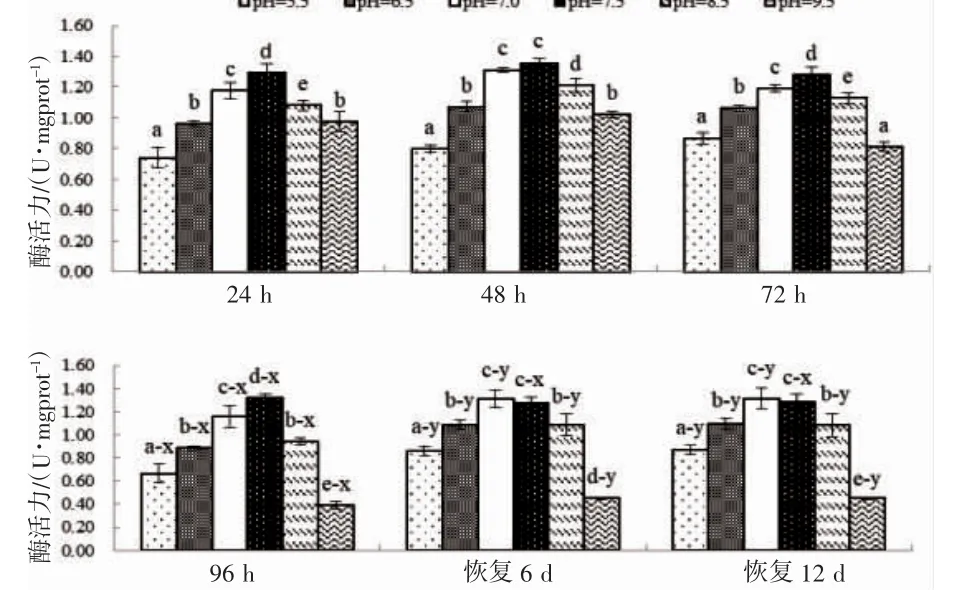
图4 不同pH 条件下棘胸蛙蝌蚪尾部CAT 酶活力的变化Fig.4 The CAT activity in Q.spinosa tadpole tail in different pH

图5 不同pH 条件下棘胸蛙蝌蚪肝脏CAT 酶活力的变化Fig.5 The CAT activity in Q.spinosa tadpole liver in different pH
2.4 肝脏GSH 酶活力
由图6 可见,实验期间蝌蚪肝脏GSH 酶活力的变化特征主要表现为:(1)pH 急性胁迫阶段,各测定时点的酶活力随pH 升高均大体上呈先降后升的趋势,且谷底值均于出现于pH 7.5 实验组(P<0.05),以pH 7.0 实验组为界,pH 大于7.0 实验组别的酶活力均显著低于pH 小于7.0 的实验组别(P<0.05);(2)pH 恢复阶段各测定时点的酶活力变化趋势与急性胁迫阶段类似,所不同的是pH 7.0实验组与pH 8.0 实验组之间,以及pH 6.5 实验组与pH 8.5 实验组之间的酶活力均无显著差异(P>0.05),且各实验组内恢复6 d 和12 d 的酶活力也均无显著差异(P>0.05);(3)以96 h 酶活力为参照,pH 恢复阶段仅pH 7.5 实验组的酶活力与相对应的参照组无显著差异(P>0.05),其它实验组的酶活力均显著大于相对应的参照组(P<0.05)。综上可知,就肝脏GSH 酶活力而言,棘胸蛙蝌蚪偏好弱碱性环境,适宜范围为7.0~7.5,以pH 7.5 最为适宜,pH 急性胁迫对蝌蚪肝生理功能具持久性影响。
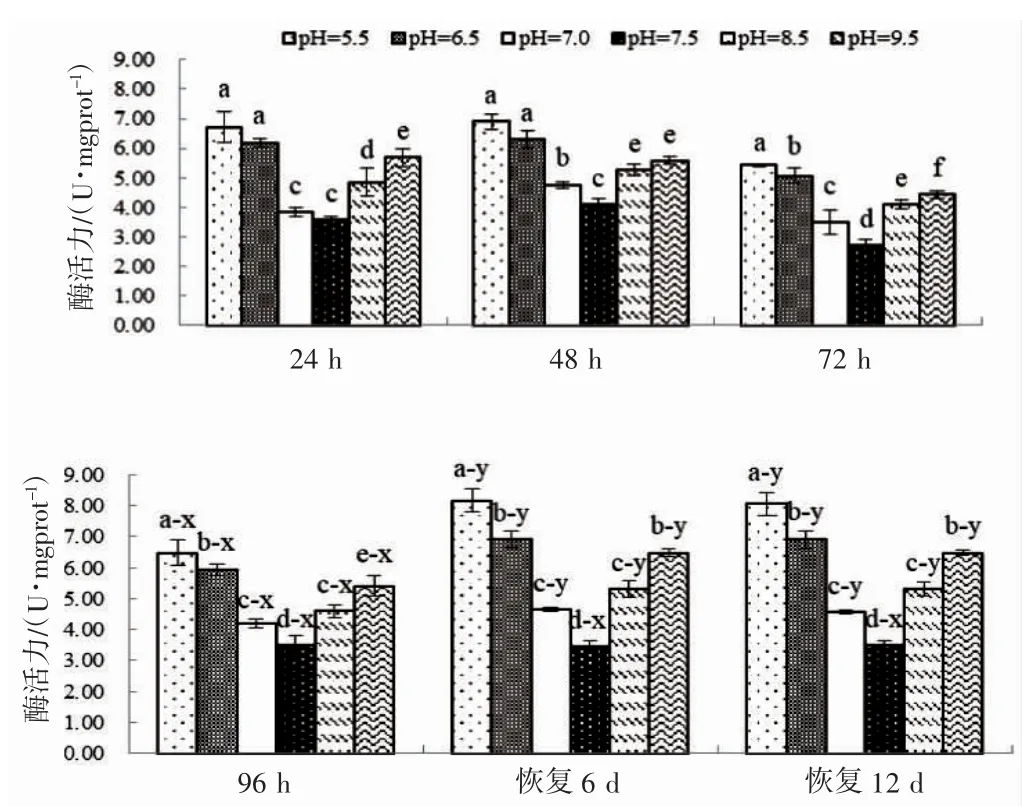
图6 不同pH 条件下棘胸蛙蝌蚪肝脏GSH-Px 酶活力的变化Fig.6 The GSH activity in Q.spinosa tadpole liver in different pH
3 讨论
3.1 棘胸蛙蝌蚪尾部皮肤和肝脏对pH 急性胁迫的抗氧化应答特征
pH 急性胁迫阶段,各测定时点蝌蚪的尾部皮肤ATP 酶和肝脏GSH-Px 酶活力随水环境pH 增加均呈“V”型变化的结果(图1、图6),表明蝌蚪尾部皮肤ATP 酶和肝脏GSH-Px 酶活力均对于偏离其适宜pH 的水环境表露出明显的毒害兴奋效应,与其受水温和氨氮急性胁迫下的情形相反[1-2];各测定时点蝌蚪尾部皮肤和肝脏的SOD、CAT 酶活力随水环境pH 增加均基本呈“Λ”型变化的结果(图2、图3、图4、图5),表明蝌蚪尾部皮肤和肝脏的SOD、CAT 酶活力均对于偏离其适宜pH 的水环境表露出明显的抑制效应,均与其受氨氮急性胁迫下的情形基本相仿[6]。由此可基本认定,增强尾部皮肤ATP 酶和肝脏GSH-Px 酶活力并抑制尾部皮肤和肝脏SOD、CAT 酶活力是棘胸蛙蝌蚪对pH 急性胁迫的抗氧化应答特征。
肝脏是有机体的能量代谢中枢。据统计,有机体内约90%的氧自由基源自能量和氧自由基加工厂的线粒体。尾部是蝌蚪的运动器官。蝌蚪皮肤与水环境直接接触,既是其主要呼吸器官,也是其重要的水—血屏障。故本研究中因pH 不适导致蝌蚪尾部皮肤ATP 酶活力显著增高(图1)的同时,也势必引发蝌蚪尾部皮肤和肝脏氧自由基含量的激增。研究表明,适量的氧自由基可增强对水生动物的免疫保护,为其正常生理活动所必需[14];而当氧自由基过量并超出其机体清除能力时,则会对有机体产生氧化压力[15];SOD、CAT和GSH-Px 是棘胸蛙蝌蚪体内协同参与清除氧自由基的主要抗氧化酶类,其酶活力的高低不仅可映射体内需清除的氧自由基量的多寡,而且也可反映机体受氧自由基氧化损害的程度或水平[1-2]。由此,本研究中棘胸蛙蝌蚪受pH 急性胁迫下尾部皮肤ATP 酶和肝脏GSH-Px 酶活力的显著高起(图1、图6)以及尾部皮肤和肝脏SOD、CAT 酶活力的显著下降(图2、图3、图4、图5),无疑表明棘胸蛙蝌蚪对pH 急性胁迫的抗氧化应答特征与其皮肤呼吸供氧压力和肝脏能量代谢负担同步显著增加有着极为密切的关系,即受抑的皮肤呼吸作用在显著增进蝌蚪尾部运动能量负担的同时,也必将对肝脏产生极为明显的抗氧化损害,这一应答机制所表露的“由表及里”和“表里互通”恶性循环特征,既与棘胸蛙蝌蚪受氨氮急性胁迫的损害情形相似[2,5],也与蟾蜍蝌蚪在除草剂制剂攻毒下的理化应答机制相吻[16],同时也从侧面印证了过低的pH 会影响越冬过程中林蛙皮肤的呼吸作用甚至造成大量死亡现象的可靠性[17]。
3.2 棘胸蛙蝌蚪尾部皮肤和肝脏对pH 急性胁迫后恢复期的抗氧化响应特征
以各实验组pH 急性胁迫96 h 时点的酶活力为参照,诸实验组在pH 恢复阶段除pH 7.0 和7.5 两实验组的尾部皮肤ATP、SOD、CAT 酶活力和肝脏SOD、CAT、GSH-Px 酶活力均与其相对应的参照组无显著差异(P>0.05)外,其余均显著大于与其相对应的参照组(P<0.05)的结果,在进一步说明棘胸蛙蝌蚪生存水环境的最适pH 为7.5 的同时,直接反映了消除pH 急性胁迫后蝌蚪尾部皮肤和肝脏SOD、CAT 酶活力所表露的可逆效应,以及尾部皮肤ATP 酶和肝脏GSH-Px 酶活力的增益效应,从而揭示了蝌蚪可通过改善供氧环境条件和提高供氧效率有效减弱对肝脏能量代谢和尾部运动代谢负面压力的本质。
就图2、图3、图4、图5 中诸实验组酶活力在pH 恢复6 d 和12 d 间均无显著差异(P>0.05),且尾部皮肤ATP 酶和肝脏GSH-Px 酶活力均仍持续显著大于pH 7.5 实验组(P<0.05),和尾部皮肤和肝脏的SOD、CAT 酶活力均仍持续显著小于pH 7.5 实验组(P<0.05)的情形看,pH 急性胁迫对蝌蚪机体正常的抗氧化生理机能可产生持久性影响,且不因pH 急性胁迫的消除而在短期内获得完全修复,这可能与体内短时间大量产生的自由基受链式反应的作用由一个大分子转移到另一个大分子从而导致机体组织的广泛损伤有关[18]。
