乳酸菌的筛选及高产酸菌株的常压室温等离子体诱变选育
2021-07-05林杨布丽根加冷别克孙建谭慧林周洁刘少杰王伟顾美英张志东
林杨,布丽根·加冷别克,孙建,谭慧林,周洁,刘少杰,王伟,顾美英*,张志东, *
1(新疆农业大学 食品科学与药学学院,新疆 乌鲁木齐,830052)2(新疆农业科学院微生物应用研究所,新疆特殊环境微生物实验室, 新疆 乌鲁木齐,830091)3(阿克苏地区食品安全检测中心,新疆 阿克苏,843000)4(阿克苏地区检验检测中心,新疆 阿克苏,843000)
乳酸菌(lactic acid bacteria,LAB)是一类可利用碳水化合物发酵产生大量乳酸的细菌的通称[1],其大部分菌株在宿主肠道定植,并发挥维持肠道平衡、降低胆固醇含量、改善乳糖不耐症及提高机体免疫力等功能[2],被公认为食品安全级微生物(generally recognized as safe,GRAS),常用于酸奶、奶酪等乳制品的生产加工中[3]。乳酸菌的蛋白酶活性及产酸性能作为影响乳酸菌益生作用的重要因素,是筛选性质优良、稳定性强的工业生产菌株的主要指标[4]。然而,传统乳酸菌发酵所产生的蛋白酶及乳酸含量较低,无法满足现代发酵食品工业的需求,因此,需要对菌株进行诱变育种,提高菌株的生产性能。
常规的育种方法有紫外线诱变、重离子束辐照、亚硝基胍诱变等,而常压室温等离子体(atmospheric and room temperature plasma, ARTP)诱变是一种基于大气环境温度和射频等离子体的新型微生物诱变育种技术[5],与其他诱变方法相比,ARTP可在大气压和室温(25~40 ℃)下高效诱导DNA链断裂[6],同时具有操作简单、安全性高、环境友好、突变速度快、突变率高、突变多样性大等特点。目前,它已成功应用于许多不同微生物以改善其基因组[7]。如GAO等[8]使用ARTP诱变技术使得乳酸菌HX-3-3在发酵过程中的γ-氨基丁酸产量提高了25.98%;陈瑞龙[9]以植物乳杆菌-A65为研究对象,通过ARTP诱变技术使其细菌素产量提高了45%以上,大大提高了菌株的抑菌活性。
本研究对新疆乌鲁木齐周边牧区的4种传统酸奶中进行了乳酸菌的分离鉴定,优选出1株蛋白酶高产菌株,并对其进行ARTP诱变,显著提高了该菌的产酸能力,为后续进一步选育和开发相关优质乳酸菌资源提供了坚实的研究基础。
1 材料与方法
1.1 材料
4种传统发酵酸奶,均采集于新疆乌鲁木齐南山牧区。
1.2 培养基
MRS肉汤、MRS琼脂培养基,青岛高科技工业园海博生物技术有限公司。
酪蛋白固体培养基[10](g/L):酪蛋白10,牛肉膏3,NaCl 5,Na2HPO42,MgSO4·7H2O 0.5,琼脂18,pH 7.3±0.2,121 ℃、0.1 MPa灭菌15 min。
1.3 菌株的分离纯化
取各酸奶样品25 mL于225 mL无菌水中,振荡摇匀,依次稀释至10-6。分别取各浓度稀释液100 μL,均匀涂布于含2%(质量分数) CaCO3的MRS培养基上,37 ℃培养48 h。挑取有溶钙圈的单菌落,进行分离纯化。菌株经重复纯化3次后转接至斜面,于4 ℃保藏备用。
1.4 菌株形态及代谢活性分析
菌株的形态特征鉴定参照东秀珠等[11]《常见细菌系统鉴定手册》。
过氧化氢酶试验:滴加3%(体积分数) H2O2于细菌培养物的试管中,产生气泡为阳性,否则为阴性。产蛋白酶试验:将菌株接种于酪蛋白固体培养基上,观察有无透明圈及透明圈的大小。
1.5 菌株的分子生物学鉴定
采用细菌基因组提取试剂盒提取乳酸菌的基因组DNA,具体操作按说明书进行。利用细菌16S rRNA基因通用引物27 F和1495 R进行PCR扩增[12],条件为94 ℃ 5 min;94 ℃ 1 min,56 ℃ 45 s,72 ℃ 2 min,30个循环;72 ℃ 10 min。PCR扩增产物经0.8%(质量分数)琼脂糖凝胶电泳检测后,送往北京鼎国昌盛生物技术有限责任公司测序。
将测序结果在NCBI上进行Blast比对,同时调取同源性最高的模式菌株,利用MEGA 7.0建立菌株Neighbor-joining(N-J)系统发育树。
1.6 菌株产酸量的测定
采用滴定法测定菌株的产酸能力[13]。取活化后的菌株按2%接种量接种于发酵培养基中,37 ℃、150 r/min培养24 h,取各菌株的发酵液10 mL于50 mL蒸馏水中,滴加2~3滴1 g/L的酚酞作指示剂,用0.1 mol/L的NaOH标准溶液进行滴定,以溶液出现粉红色且30 s后不褪色为滴定终点,每个样品3次平行[14]。以未接种的发酵培养基作空白对照,其计算如公式(1)所示:

(1)
式中:V1为样品消耗NaOH溶液的体积,mL;V2为空白对照消耗NaOH溶液的体积,mL;V0为稀释液的总体积,mL;c为标准NaOH的浓度,mol/L。
1.7 蛋白酶活力的测定
采用Folin-酚法[4]测定菌株的蛋白酶活力。蛋白酶活力的计算如公式(2)所示:

(2)
式中:V为酶液的总体积,mL;T为酶解反应时间,min;N为酶液的稀释倍数;K为吸光常数。
通过对分离株产酸量及蛋白酶活力的测定,筛选出产酸量低,但蛋白酶活性高的菌株进行ARTP诱变,以获得高产酸的蛋白酶高产菌株。
1.8 ARTP诱变
1.8.1 菌悬液的制备
将活化后的菌株接种于发酵培养基,37 ℃、150 r/min培养24 h,至对数生长中后期,3 000 r/min离心10 min,弃去上清液。菌体用生理盐水洗涤2次后,重悬,并制成浓度为107~108的菌悬液,备用。
1.8.2 ARTP诱变
无菌条件下,取10 μL稀释好的菌悬液,均匀涂于无菌金属载片表面,以氦气为工作气体,设置电源功率120 W、射频功率13 W、间距2 mm、气流量10 L/min,处理时间分别为0、20、40、60、80、100 s。处理完的载片置于装有MRS液体培养基的离心管中,进行振荡洗脱,形成新的菌悬液。对新的菌悬液进行适当稀释,取100 μL涂布于MRS固体培养基上,37 ℃培养2~3 d,每个处理3次平行,利用公式(3)计算致死率[15]:

(3)
1.8.3 诱变菌株的筛选和遗传稳定性试验
从诱变菌中随机挑选单菌落,点接到含2% CaCO3的MRS培养基上,并以原始菌作对照,37 ℃培养24~48 h。通过测定并统计每个菌落的溶钙圈直径与菌落直径的比值(HC值)及该菌株的产酸量,筛选高产酸的突变菌株。
将筛选出的突变乳酸菌株以2%接种于发酵培养基,37 ℃、150 r/min振荡培养3 d,以此作为1次传代培养,并以每代的发酵液作为下一次传代的种子液,连续传代7次,测定其每一代的产酸能力,每代设置3个重复,从而验证菌株的突变性能是否能够稳定遗传。
1.9 统计分析
试验数据采用Microsoft Excel 2010、MEGA 7.0、SPSS 19.0(SPSS Inc, USA)等数据处理系统进行整理及统计分析。
2 结果与分析
2.1 菌株筛选结果
通过在含有2% CaCO3的MRS培养基上进行溶钙圈和形态观察,从4种样品中共分离出潜在乳酸菌12株,经革兰氏染色和过氧化氢酶检测,所得菌株均为革兰氏阳性、过氧化氢酶阴性,初步鉴定为疑似乳酸菌株。
2.2 菌株的分子生物学鉴定
通过测序获得上述菌株16S rRNA基因序列,与NCBI中相关模式菌株序列进行比对,确定12株细菌分属于乳植杆菌属(Lactiplantibacillus)和链球菌属(Streptococcus)的4个种,代表菌株系统发育树如图1所示。
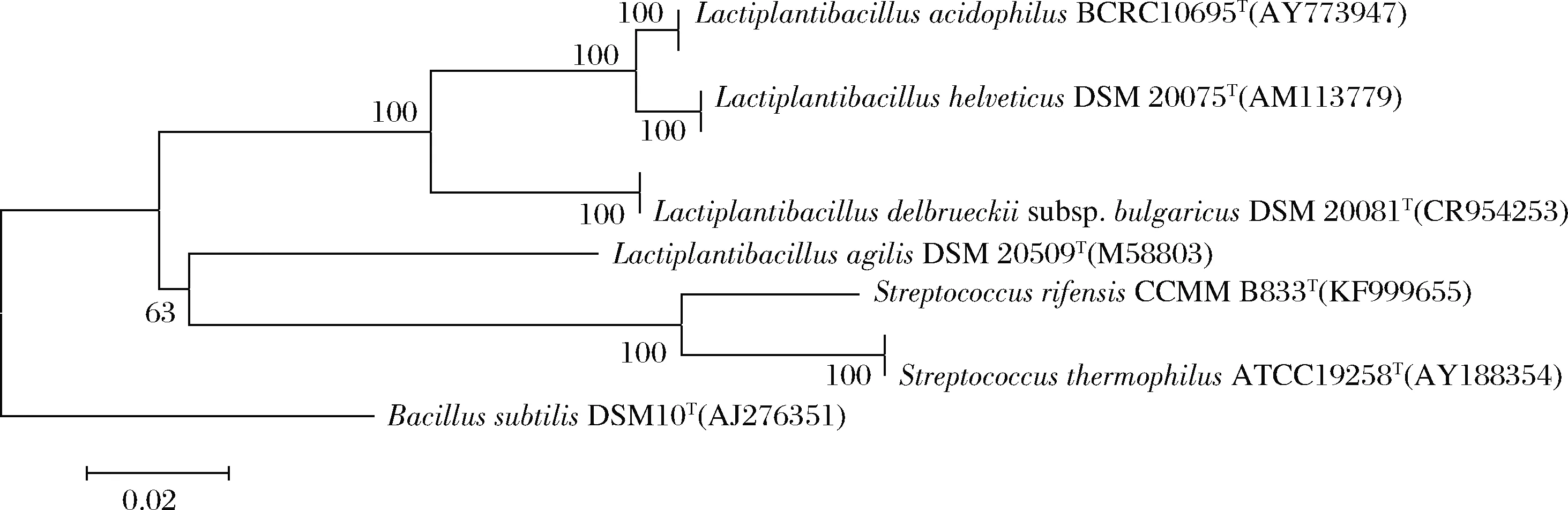
图1 基于16S rRNA序列的代表菌株N-J系统发育树Fig.1 Neighbor-joining phylogenetic tree based on 16S rRNA gene sequences of isolates and close relatives
2.3 不同分离株的产酸量
不同分离株的产酸量如图2所示,12株乳酸菌的产酸量在13~30 g/L,其中菌株T1的产酸量最高,达29.19 g/L;菌株S1、S2、S3、Y1、T2、X1、X2等7株菌的产酸量在19~26 g/L;其余菌株产酸量则较低,在13.5 g/L左右。
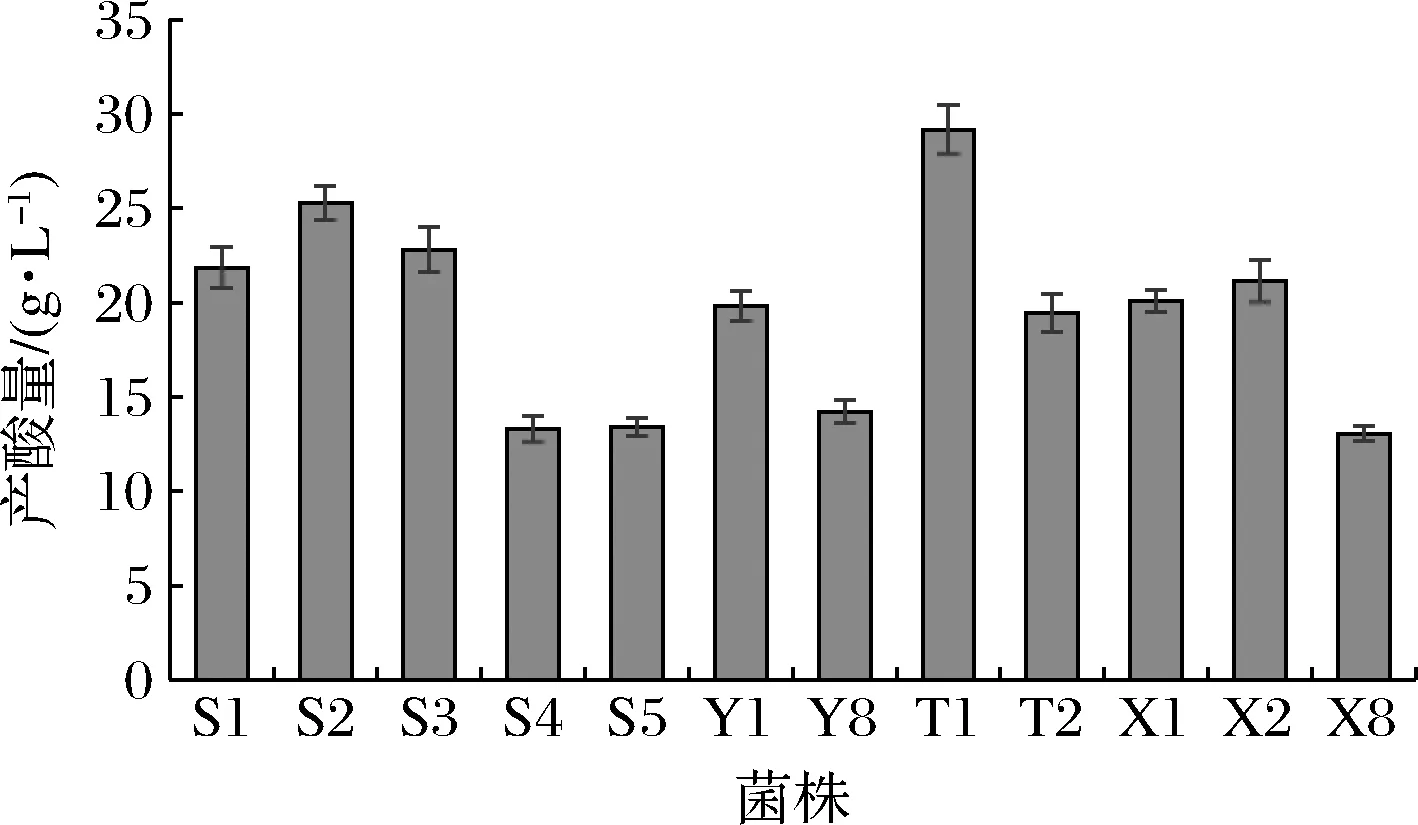
图2 菌株产酸能力Fig.2 Acid-producing ability of isolates
2.4 蛋白酶高产菌的筛选
通过酪蛋白培养基从12株乳酸菌中筛选出透明圈直径较大的5株菌S1、S3、Y8、X2、T1,通过测定其蛋白酶活力可知,菌株Y8的蛋白酶活力最高,达39.14 U/mL;其次为X2,为33.12 U/mL;而S1蛋白酶活力最低,仅为5.82 U/mL。因此,试验选取高产蛋白酶且产酸能力较弱的菌株Y8,进行诱变选育。

图3 菌株蛋白酶活力Fig.3 Protease activities of isolates
2.5 ARTP诱变选育乳酸菌
2.5.1 诱变时间的确定
诱变时间对致死率的影响如图4所示,随着处理时间递增,诱变20 s后致死率大幅度上升,至处理60 s 时致死率已经达91.09%,处理80 s时,菌株存活率几乎为零。一般而言,当致死率在90%以上时,菌株产生高产突变的概率较高,且在此突变率下回复性更小。因此,考虑到突变稳定性,最终选择ARTP诱变处理的时间为60 s。

图4 菌株Y8 ARTP诱变致死率Fig.4 Lethality rate of the isolate Y8 by ARTP
2.5.2 高产酸菌株的筛选结果
试验以菌株Y8作对照,其菌落的平均HC值为3.391,根据MRS-CaCO3培养基的溶钙圈大小初步挑选出较对照株明显变大及变小的菌株58株,同时将菌株重新点接于MRS-CaCO3培养基上测定其溶钙圈直径,进一步得到溶钙圈直径较对照株有差异的突变株,并重新编号,结果见表1。试验将超出对照HC值40%的菌株定义为正突变菌株,否则为负突变菌株,最终得到1株HC值为5.023的高产酸菌株Y8-6。

表1 代表菌株的平板初筛结果Table 1 Screening of acid production ability of mutant isolates on plate
将诱变株分别通过液体发酵培养,测定其平均产酸量,如图5所示,菌株Y8-6的产酸量最高,为 23.41 g/L,与初筛结果一致。

图5 诱变株产酸复筛结果Fig.5 Acid production ability of mutant isolates
2.5.3 遗传稳定性试验
将突变乳酸菌株连续传代7次,测定其每一代的产酸能力,结果如图6所示,正向突变株Y8-6经7次传代培养后,其平均产酸量依次为22.76、23.12、24.00、23.08、23.32、23.00、22.87 g/L,平均值为23.16 g/L。由此可见,突变株的酸产量稳定。
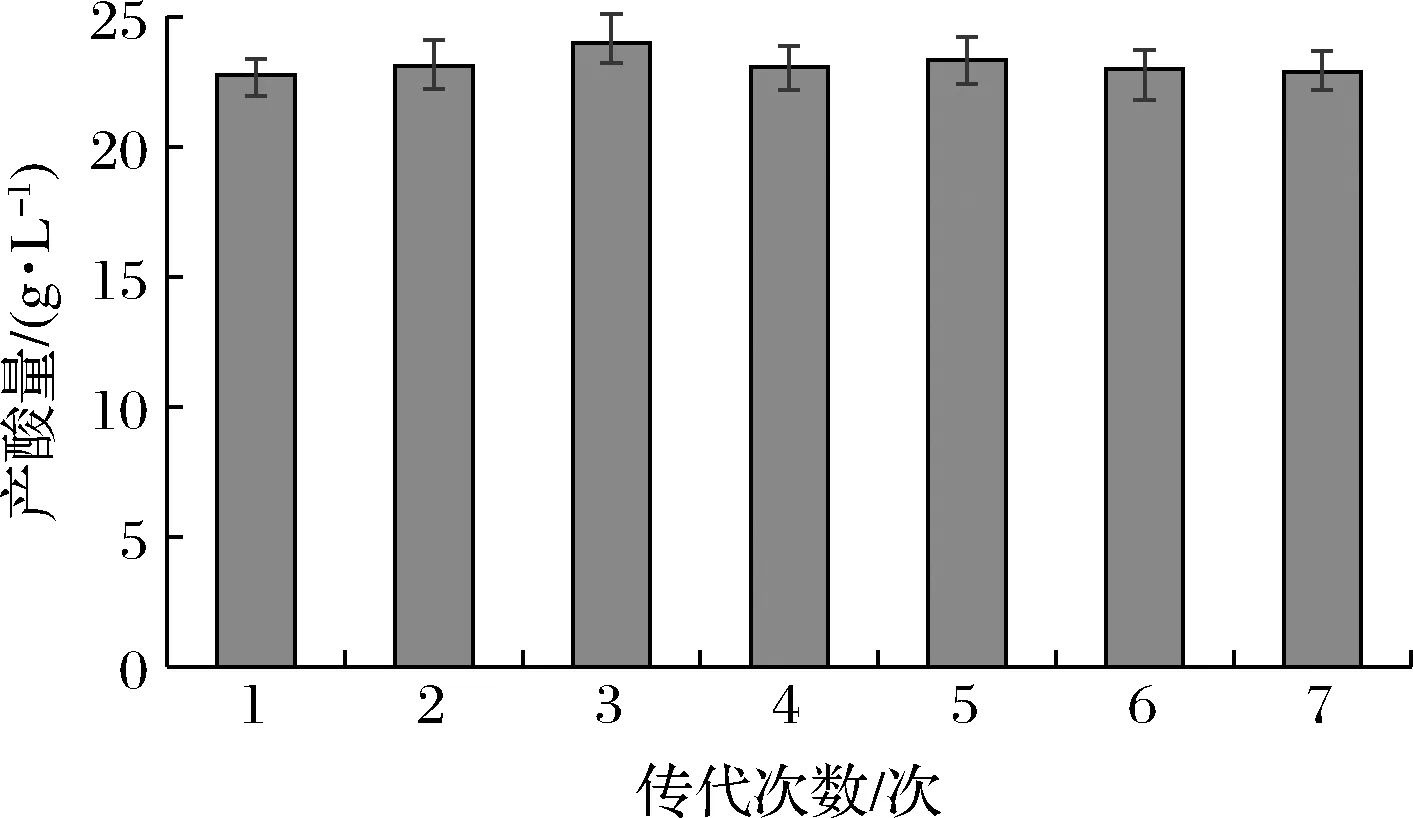
图6 菌株Y8-6连续7代产酸稳定性情况Fig.6 Genetic stability test of acid production by the isolate Y8-6 for 7 successive generations
3 讨论与结论
乳酸菌是目前世界公认的食品安全级微生物,对人体健康具有积极作用。乳酸菌在发酵过程中代谢产生的乳酸,能够降低体系pH,缩短发酵时间[16],提高生产效率,节约成本,同时乳酸还能抑制其他杂菌的生长,有利于发酵环境的保持,且发酵产生的乳酸是重要的呈味物质,能够赋予食物特殊的风味。因此,筛选和保存高产酸性能的乳酸菌,将其利用于生产发酵,能实现更高的利用价值[17]。同时,乳酸菌在发酵过程中产生的蛋白酶能够水解食物中的蛋白质使其生成更小的肽类或氨基酸[18-19],而蛋白质经酶解后生成的多肽,比原蛋白质的营养特性更好,且经消化道酶作用后分解为人体更易吸收的预消化状态,有益于人体对蛋白质、钙、铁离子及维生素的吸收,同时分解产生的多肽具有促进微生物增长、抗氧化、增强免疫力等功能[20]。此外,乳酸菌具有较强的黏附力,更易定植在肠道黏膜上形成屏障保护动物肠道健康,尤其是产蛋白酶乳酸菌在肠道中定植后,不仅能够发挥益生作用,而且能够通过在机体消化道内释放蛋白酶而提高机体对蛋白类食物的利用率[21]。因此,高产蛋白酶、高产酸的菌株在发酵食品的质量控制、风味形成和营养提升中发挥了重要的作用[22]。
新疆有着丰富的传统发酵食品资源,如酸马奶、奶疙瘩、驼乳、干酪等具有独特民族特色的传统发酵制品,其中蕴含丰富的乳酸菌资源[23]。本研究从4种新疆传统酸奶中分离出12株疑似乳酸菌,经16S rRNA基因序列分析鉴定归属为德氏乳植杆菌保加利亚亚种(Lactiplantibacillusdelbrueckiisubsp.bulgaricus)、嗜酸乳植杆菌(Lactiplantibacillusacidophilus)、嗜热链球菌(Streptococcusthermophilus)和瑞士乳植杆菌(Lactiplantibacillushelveticus)。试验通过透明圈法和Folin-酚法进一步筛选到5株产蛋白酶菌株,同时对其中1株蛋白酶活力最高而产酸能力较弱的德氏乳植杆菌保加利亚亚种Y8菌株进行ARTP诱变育种。
ARTP诱变技术是近年来发展起来的一种新颖且高效的物理诱变技术[24],其能够在常压室温下高效诱导DNA和寡核苷酸发生高强度断裂,极大地改变细胞壁和细胞膜的理化性质[25],进而引起组织损伤,迫使细胞以较高的容错水平启动SOS修复机制,从而产生多种不匹配位点,并得到大量高突变体样本[26]。与传统诱变方法相比,其具有突变率高、操作简便、成本低廉、环境友好等特点[27],因此,在微生物突变育种及生物医学领域中显示出广阔的应用前景。目前,有关利用ARTP技术诱变乳酸菌,进行高产酸菌株筛选研究较少。本研究初步确立了ARTP诱变乳酸菌的方法,以氦气为工作气体,设置电源功率120 W、射频功率13 W、间距2 mm、气流量10 L/min、处理时间60 s,此时致死率为91.09%,在该条件下,最终筛选获得1株高产酸菌株Y8-6,其产酸能力较原始菌株提高了64.5%,且蛋白酶活性稳定。
相关研究表明,ARTP诱变高效率突变的同时,其均匀覆盖率及高突变率也可在一定程度上改变菌株的生理特性。进一步验证选育菌种的突变稳定性,开展诱变菌株代谢通路变化分析,仍有待深入研究。
