马铃薯甲虫LdATPaseE调控幼虫蜕皮的分子机制
2021-07-05廖兰兰付开赟丁新华吐尔逊阿合买提郭文超
廖兰兰,王 俊,付开赟,丁新华,何 江,吐尔逊·阿合买提,郭文超
(1.塔里木大学植物科学学院,新疆阿拉尔 843300;2.新疆农业科学院植物保护研究所/农业部西北荒漠绿洲作物有害生物综合治理重点实验室,乌鲁木齐 830091;3. 新疆农业农村厅植物保护站,乌鲁木齐 830049;4.新疆农业科学院博士后工作站/新疆农业大学博士后流动站,乌鲁木齐 830091;5. 新疆农业科学院微生物应用研究所,乌鲁木齐 830091)
0 引 言
【研究意义】液泡型H+-ATP酶(vATPase)定位于几乎所有昆虫上皮组织的顶膜中,激活膜以吸收和/或分泌离子和流体,并在许多生理功能中起重要作用。这类酶可以通过水解ATP成ADP和磷酸,将氢离子泵出膜外,维持细胞膜电位,帮助膜上其它载体吸收或分泌离子或液体。囊泡型H+-ATP酶(vesicular H+-ATPase,vATPase)驱动H+的跨过细胞膜的运输,形成跨膜H+电位差;H+电位差则驱动Na+和/或 K+/H+反向转运载体,而Na+/K+通过主动运输从血淋巴中运往中肠肠腔,肠腔内Na+/K+则激发Na+/K+依赖的氨基酸吸收[1]。vATPase驱动的H+的跨膜运输是昆虫吸收氨基酸的动力基础,因此,在昆虫营养吸收过程中具有非常重要的作用,沉默vATPase的亚基常导致昆虫死亡[2-7]。【前人研究进展】前人的研究已克隆出马铃薯甲虫中vATPase 3个亚基A、B和E的基因片段,并发现这3个亚基的dsRNA均引起马铃薯甲虫二龄幼虫的死亡[5,8]。【本研究切入点】通过喂食马铃薯甲虫不同剂量的dsLdATPaseE,可导致幼虫在取食量、行动力、入土能力、化蛹率、羽化率随dsLdATPaseE剂量依赖性的下降现象。采用RACE技术克隆了马铃薯甲虫vATPaseE的编码基因LdATPaseE全长,应用RNAi技术测定了敲低LdATPaseE对马铃薯甲虫幼虫蜕皮的影响,阐明马铃薯甲虫ATPaseE基因调控幼虫蜕皮分子机制。【拟解决的关键问题】干扰LdATPaseE了解影响幼虫体重及化蛹的分子机理,LdATPaseE通过IIS信号途径,调节保幼激素(JH)和蜕皮激素(MH)信号途径,以及影响幼虫生长和发育。
1 材料与方法
1.1 材 料
1.1.1 马铃薯甲虫
马铃薯甲虫于2018年5月源于新疆农业科学院安宁渠综合试验场天敌资源繁育研究中心,其饲养条件为温度(26±1)℃、相对湿度50%~60%和光周期16L∶8D。收集的幼虫在养虫室用新鲜马铃薯嫩叶饲养,分别饲养至二龄、三龄和四龄开始用于试验。
1.1.2 主要药剂
总RNA提取试剂(TRIzol)购自Invitrogen公司,引物合成购自南京金斯瑞公司、SuperScript III反转录酶、Oligo (dT)18随机引物、TaqDNA聚合酶、dNTP mixture (2.5和10 mmol/L) 、RNase抑制剂、DNA Marker购自TaKaRa宝生物公司。pGEM-T easy vector购自Promega公司。DNA凝胶回收试剂盒为AXYGEN公司或Promega公司产品;感受态细胞购自北京全式金公司;其他试剂为国产AR级或进口产品如酵母提取液(yeast extract)和胰蛋白胨(tryptone) 为Oxiod公司产品。保幼激素类似物吡丙醚(Pyr)和蜕皮酮类似物氯虫酰肼(Hal)为南京农业大学友情提供。
1.2 方 法
1.2.1 马铃薯甲虫ATPase基因表达载体的构建1.2.1.1 马铃薯甲虫vATPase基因的克隆
马铃薯甲虫vATPase的E亚基首先是由报道的E亚基序列为基础[5],搜索马铃薯甲虫转录组数据,并获得ATPaseE的完整序列,搜索程序为本地化BLAST程序包(http://www.ncbi.nlm.nih.gov/BLAST/),同源序列搜索过程中选定E值为10-5,获得的目的基因的片段序列经过CAP3组装,组装结果在nr数据库中进行同源搜索分析验证。利用Premier 5.0设计End to End引物验证序列的完整性,5’RACE引物为5’-CGTTTGTGACCTGACCAAGTCGTTTA-3’,3’RACE引物为5’-TCCCAAATCCTGGAAAGCCTCA-3’。
PCR反应体系(25 μL): cDNA 模板1 μL, dNTP 1 μL, 10×Mg2+Buffer 2.5 μL, 上下游引物各1 μL,其余用ddH2O补齐。PCR反应条件: 94℃ 60 s; 94℃ 30 s, 52℃ 30 s,72℃ 2 min, 循环40次; 72℃ 10 min。反应完成后样品通过琼脂糖凝胶电泳检测,目标条带切胶回收,回收样液直接送公司测序。
1.2.1.2 dsRNA原核表达系统的构建
实验用大肠杆菌EscherichiacoliHT115(DE3) RNaseШ 缺失品系和南京农业大学惠赠的pET-2p dsRNA表达载体。载体构建方法参照[9],用于构建ATPaseE-1/2 [(ATPasesubunitE-1/2), 参与H+跨膜运输],FTZ-F1 [蜕皮激素基因(Fushi tarazu-factor 1), 参与蜕皮激素信号转导],AS-C[咽侧体静止激素c基因(allatostatin-c gene),参与调节保幼激素合成],JHAMT[保幼激素甲基转移酶基因(juvenile hormone acid methyl transferase gene),参与保幼激素的合成],SHD(细胞色素314a1和Cyp314a1基因,参与20-羟蜕皮酮的合成)的dsRNA的cDNA片段根据已有报道[10-11],egfp为对照,PCR克隆获得,获得的各个组织的混合模板cDNA 1.0 μL,参照TaKaRa公司rTaq反应体系以25 μL反应体系进行克隆,PCR 反应条件: 94℃ 3 min;94℃ 30 s,52℃ 30 s,72℃ 1 min,循环35次;72℃ 10 min。反应获得的片段连入全式金公司pEasy-T3载体,最终挑取获得的阳性克隆送南京金斯瑞测序,测序获得的结果通过GeneDoc比对序列的正确性。验证的片段通过菌液扩大培养并提取含有片段的Transit-T1载体,通过EcoRI酶切产生粘性末端,目标片段通过琼脂糖凝胶电泳分离后通过胶回收纯化,利用T4连接酶连入已通过EcoRI产生粘性末端的pET-2p载体,连接完成的载体转入HT115(DE3)细胞中在含有卡那霉素(50 μg/mL)和四环素(12.5 μg/mL)的固体培养基筛选阳性克隆。获得的阳性克隆通过测序和异丙基硫代半乳糖苷 (isopropyl β-D-thiogalactoside, IPTG)诱导发酵dsRNA验证结果。诱导发酵的步骤参照吕东摸索的条件[12],在菌液重新扩大培养至OD600=1.0时加入IPTG至终浓度为0.1 mmol/L,发酵表达dsRNA 6 h即可获得稳定表达的浓度约为0.05 μg/μL的dsRNA[8]。以上所用试剂盒均按照其说明书的标准化程序进行。表1
表1 用于构建dsRNA表达载体的引物Table 1 Primers used in dsRNA synthesis
1.2.2 生物测定
根据方法[13-14],试虫对菌液有显著的拒食作用,以及取食dsLdATPaseE1/dsLdATPaseE2处理叶片1 d即能达到最佳效果[9],以及0.05和0.1 μg/mL的保幼激素吡丙醚类似物(Pyr)和氯虫酰肼(Hal)点滴处理幼虫并不会引起可见的负作用[15]。在以上条件下,设计以下10个独立的生物测定实验。
3组实验用于测定20E信号通道对四龄幼虫体内LdATPase的抑制作用。第一组实验测试20E和Hal对LdATPase表达的影响:处理组为(1)ddH2O浸润叶片(对照),(2)20E浸润叶片,(3)Hal浸润叶片,喂食1 d。实验二为敲低LdSHD:处理组为(1)PBS浸润叶片(空白对照),(2)dsegfp浸润叶片(负对照),(3)dsLdSHD浸泡叶片,喂食3 d。实验三为敲低LdFTZ-F1:处理组为(1)PBS浸润叶片(空白对照),(2)dsegfp浸润叶片(负对照),(3)dsLdFTZ-F1浸泡叶片,喂食3 d。以上每个实验处理组均重复3次,用于提取RNA。
3组实验用于测定JH信号通道对LdATPase表达量的影响。实验一测试JH和Pyr对LdATPase表达的影响:处理组为(1) ddH2O浸润叶片(对照),(2) JH浸润叶片,(3) 0.1 μg/mL Pyr浸润叶片,喂食1 d。实验二为敲低LdAS-C:处理组为(1)PBS浸润叶片(空白对照),(2)dsegfp浸润叶片(负对照),(3)dsLdAS-C浸泡叶片,喂食3 d。实验三为敲低LdJHAMT:处理组为(1)PBS浸润叶片(空白对照),(2)dsegfp浸润叶片(负对照),(3)dsLdJHAMT浸泡叶片,连续喂食3 d。以上每个实验处理组均重复3次,然后用于提取RNA。
3组实验用于测定不同浓度dsLdATPaseE-1对三龄和四龄幼虫的影响。7个处理包括PBS、dsegfp、和dsLdATPaseE-1菌液稀释100、101、102、103和104倍。每个处理重复6次。饲喂3 d后,取3个重复用于提取RNA;另3个重复用于测量体重及观察化蛹情况。
2个实验测定敲低三龄和四龄幼虫体内的LdATPaseE对IIS、JH和20E信号转导途径的影响。饲喂方法为1 d’dsRNA+2 d’PBS。共有4组处理:(1) PBS浸润叶片(空白对照),(2)dsegfp浸润叶片(负对照),(3) dsLdATPaseE-1浸泡叶片,(4) dsLdATPaseE-2浸泡叶片。每个处理重复9次。饲喂3 d后,3个重复用于提取RNA;3个重复用于提取JH;另3个重复用于提取20E。
1.2.3 20E与JH
20E由之前报道的超声波方法提取[14]其滴度(ng / g体重)通过LC串联质谱仪-质谱仪系统分析(LC-MS/MS),方法步骤按照之前报道的方法进行试验[15]。
血淋巴与JH的提取参照之前报道的方法[16]。LC-MS用来定量JH的滴度(ng / mL)[17]。
1.2.4 实时荧光定量PCR
qPCR引物利用GenScript在线网站设计,参数选择默认,实时荧光定量PCR 反应采用荧光染料SYBR Green I,在ABI 7500 或ABI 7300 Real-Time PCR System上进行。使用SYBR Premix ExTaq(TIi RNaseH Plus)进行PCR反应,加入的参比染料为Rox Reference Dye II或Dye。
cDNA模板来自于一龄、二龄、三龄和四龄幼虫,每个龄期间隔1 d取样,四龄间隔8 h取样,进入漫游期的幼虫间隔1 d取样。dsRNA处理样品选自3次生物学重复中存活个体。对于组织表达分析cDNA模板取自4龄3 d幼虫的胸肌、脑-咽侧体复合体、腹神经索、前肠(FG)、中肠(MG)、马氏管(MT)、回肠(IL)、直肠(RE)、血细胞(HC)、表皮(EP)、腹神经节(VG)和脂肪体(FB)。对于所有的样品,RNA通过试剂盒SV Total RNA Isolation System Kit (Promega)提取。每一组样品包含5~30的个体并且均有3次生物学重复。定量的mRNA检测通过qRT-PCR检测,均有3次技术重复。基因的相对表达量根据2-△△CT方法计算[18-19], 通过内参基因 (RP18和ARF4)校准[20]。qPCR反应体系为20 μL: RNA使用1 μg, qPCR Mix Buffer 10 μL, qPCR上下游引物各0.8 μL, ROX Reference Dye I 0.4 μL, 剩余ddH2O补齐。qPCR的反应步骤参考ABI 7300默认反应程序: 95℃ 30 s; 95℃ 5 s, 60℃ 31 s, 共40个循环。表2

表2 用于qRT-PCR的引物Table 2 Primers used in qRT-PCR
1.3 数据处理
qRT-PCR数据采用2-ΔΔCT方法计算相对表达量,其中:ΔΔCT=ΔCT样品-ΔCT参照物,ΔCT=CT靶基因-CT内参基因,并以平均数±标准误表示(3次重复),各发育阶段mRNA相对表达量比较采用ANOVA的Tukey-Kramer分析进行统计检验。统计分析使用的软件为SPSS(SPSS Inc.,Chicago,IL,USA)。
2 结果与分析
2.1 马铃薯甲虫发育过程中LdATPaseE的时空表达
研究表明,LdATPaseE在所有测定的组织中均表达。LdATPaseE在回肠、直肠中表达量最高,在马氏管、中肠和前肠中的表达量相对中等,在脂肪体、腹神经索、表皮和血细胞中的表达量最低。
LdATPaseE在各个龄期皆有表达。在一龄、二龄和三龄的幼虫中,LdE75在蜕皮后出现高峰,在龄末期出现低谷。在四龄幼虫中,LdATPaseE的最高峰出现在蜕皮后72 h,低谷出现在蜕皮后96 h。图1
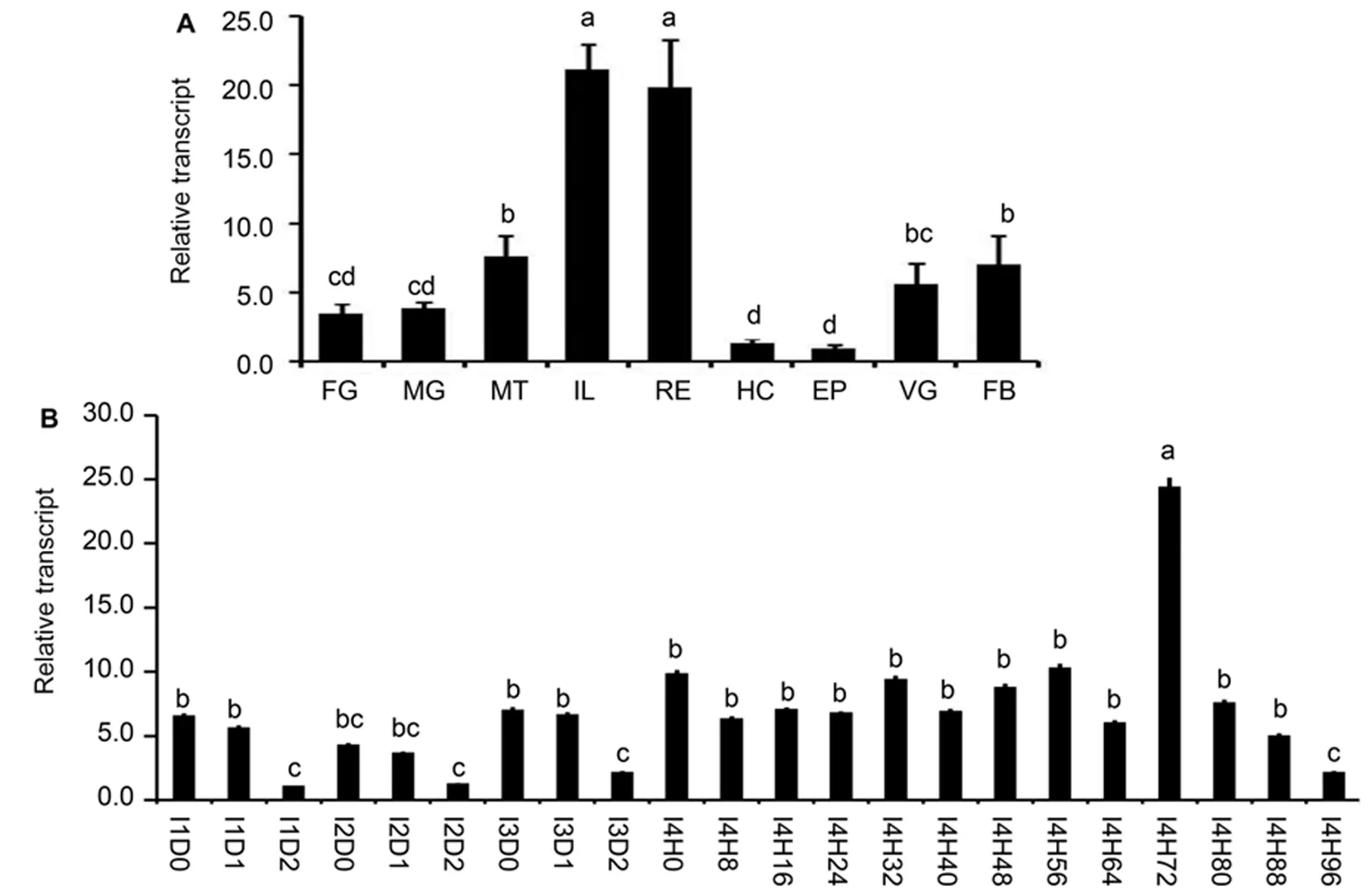
注:测定组织表达时,cDNA模板来自于3日龄四龄幼虫的前肠(FG)、中肠(MG)、马氏管(MT)、回肠(IL)、直肠(RE)、血细胞(HC)、表皮(EP)、腹神经节(VG)和脂肪体(FB)。测定不同发育阶段的表达时,cDNA模板来自于间隔1 d的一龄(I1D0、I1D1、I1D2)、二龄(I2D0、2D1、I2D2)、三龄(I3D0、I3D1、I3D2)幼虫和间隔8 h的四龄(I4H0、I4H8、I4H16、I4H24、I4H32、I4H40、I4H48、I4H56、I4H64、I4H72、I4H80、I4H88和I4H96)幼虫,IxD0/IxH0表示刚蜕皮的幼虫。测定基因的相对表达量时, 共有3个生物学重复,每个重复包括5~30个体。相对表达量经qRT-PCR测定,每个生物学重复设置3个技术重复。柱状图表示平均数±标准误。柱顶不同字母表示P < 0.05水平差异显著
2.2 激素调节LdATPaseE的表达机制
2.2.1 20E抑制LdATPaseE的表达
研究表明,在马铃薯甲虫L.decemlineata中 20E滴度的高峰和LdATPaseE的表达水平的低谷同时出现,这表示20E可能抑制LdATPaseE的表达。测试处理为:喂食水浸泡(CK)、Hal和 20E浸泡的叶片,时间为1 d。相比于对照CK的样品,LdATPaseE的表达量在Hal和20E处理样品中显著下降。
RNAi降低LdSHD的表达水平后,LdATPaseE的表达mRNA水平显著上升。RNAi方法敲低马铃薯甲虫四龄幼虫体内LdFTZ-F1后,LdATPaseE的mRNA水平显著上升。图2

注:A:刚蜕皮的四龄幼虫取食水处理的马铃薯叶片(control)、0.1 μg/mL处理或10-6 M的 20E处理的叶片1 d;B:取食PBS、dsegfp、或dsSHD浸泡的叶片3 d;C:或取食PBS、dsegfp或 dsFTZ-F1浸泡叶片3 d。柱状图表示平均数±标准误。柱顶不同的大写或小写字母表示在P< 0.05或P<0.01水平差异显著
2.2.2 JH不参与调控LdATPaseE的表达
研究表明,马铃薯甲虫四龄幼虫摄取JH及其类似物吡丙醚后,对LdATPaseE表达量不明显影响。采取RNAi方法敲低马铃薯甲虫四龄幼虫体内LdAS-C后,JH滴度应上升,但LdATPaseE的mRNA水平仍无变化。采取RNAi方法敲低马铃薯甲虫四龄幼虫体内LdJHAMT后,JH滴度应下降,但LdATPaseE的mRNA水平仍无变化。在马铃薯甲虫四龄幼虫阶段,JH不参与调控LdATPaseE的表达。图3
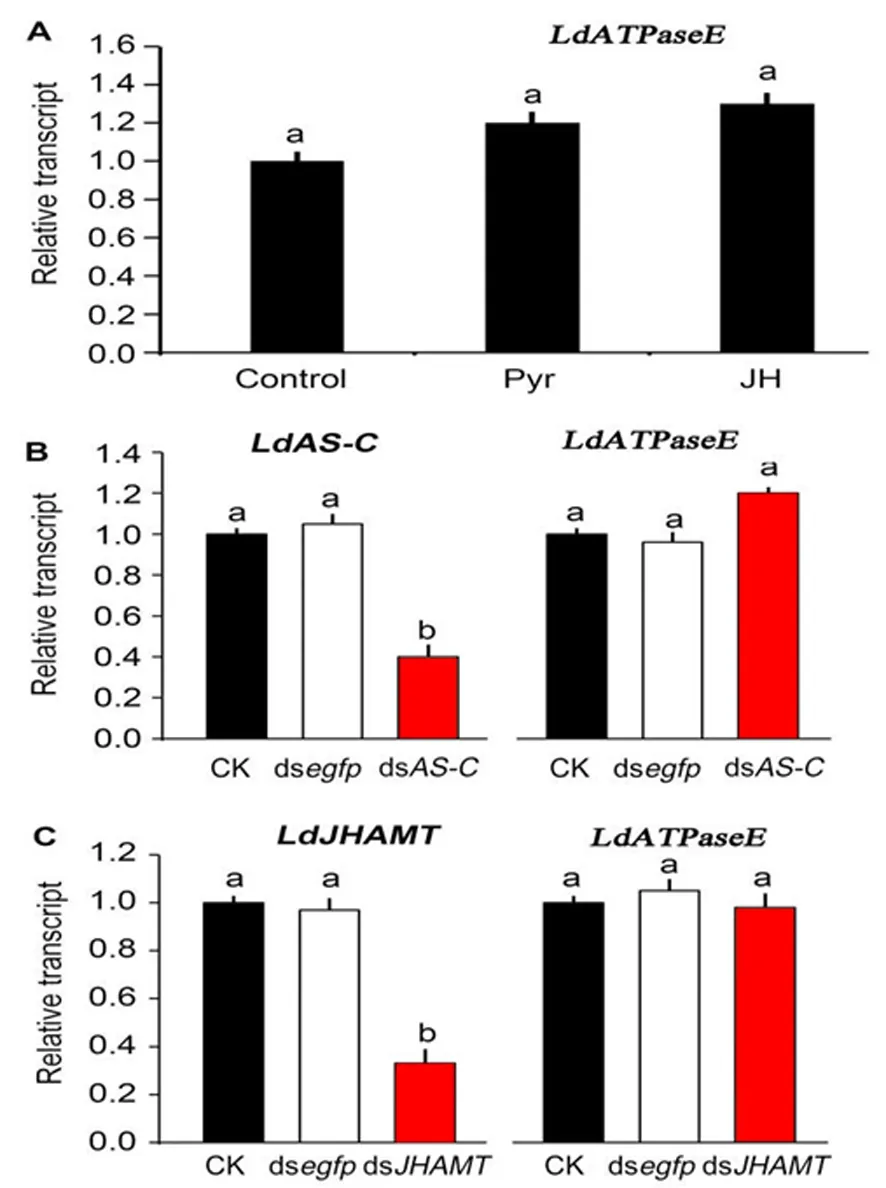
注:A:刚蜕皮的四龄幼虫取食水处理的马铃薯叶片(control)、0.1 μg/mL的吡丙醚或10-6 M的JH1 d。B:或者刚蜕皮的四龄幼虫取食PBS、dsegfp或dsAS-C浸泡的叶片3 d; C:或PBS、dsegfp或dsJHAMT浸泡的叶片3 d。不同的大写和小写字母表示在P<0.05和P<0.01水平差异显著
2.2.3 激素调节LdATPaseE的表达机制
马铃薯甲虫三龄幼虫喂食1 ddsLdATPaseE1/dsLdATPaseE2处理叶片、2或5 d PBS处理叶片后,LdInR的mRNA水平分别上调了2.0和3.3倍,以及2.5和4.0倍。Ld4EBP的表达水平则分别上调了2.3 和3.0倍,以及3.5和4.1倍。马铃薯甲虫四龄幼虫喂食1 ddsLdATPaseE1/dsLdATPaseE2处理叶片、2 d PBS处理叶片后,LdInR的mRNA水平分别上调了4.4和6.0倍。Ld4EBP的表达水平则分别上调了3.5 和2.9倍。可见,取食dsLdATPaseE1/dsLdATPaseE2处理叶片抑制了马铃薯甲虫幼虫体内的IIS信号转导途径。
马铃薯甲虫三龄幼虫喂食1 ddsLdATPaseE1/dsLdATPaseE2处理叶片、2 或5 d PBS处理叶片后,LdAS-C表达水平显著上升了3.6和3.0倍,以及2.5和2.4倍。马铃薯甲虫四龄幼虫喂食1 ddsLdATPaseE1/dsLdATPaseE2处理叶片、2 d PBS处理叶片后,LdAS-C表达水平显著上升了2.8和2.7倍。
马铃薯甲虫中,高水平表达的LdAS-C可能产生大量的AS-C蛋白,抑制JH的合成。测定JH合成关键酶:保幼激素酸甲基转移酶LdJHAMT的转录水平。马铃薯甲虫三龄幼虫喂食1 ddsLdATPaseE1/dsLdATPaseE2处理叶片、2或5 d PBS处理叶片后,LdJHAMT表达水平显著下降了64.0%和88.3%,以及63.2%和51.1% ;JH滴度显著下降了78.2%和75.6%,以及78.9%和66.2%。马铃薯甲虫四龄幼虫喂食1 ddsLdATPaseE1/dsLdATPaseE2处理叶片、2 d PBS处理叶片后,LdJHAMT表达水平显著下降了69.1%和75.0%;JH滴度显著下降了82.4%和88.8% 。图4

注:相对表达量经qRT-PCR测定,每个生物学重复设置3个技术重复。20E的相对滴度通过(LC-MS/MS)系统检测。JH的相对滴度通过LC-MSMS联用测定。柱状图表示平均数±标准误。柱顶不同的小写字母表示在P< 0.05水平差异显著
马铃薯甲虫三龄幼虫取食dsLdATPaseE1/dsLdATPaseE2处理叶片后,其体内LdSHD的表达水平下降,20E滴度降低,LdFTZ-F1-1 转录本也大幅减少。图5

注:相对表达量经qRT-PCR测定,每个生物学重复设置3个技术重复。20E的相对滴度通过(LC-MS/MS)系统检测。JH的相对滴度通过LC-MSMS联用测定。柱状图表示平均数±标准误。柱顶不同的小写字母表示在P< 0.05水平差异显著
取食dsLdATPaseE1/dsLdATPaseE2处理叶片也抑制了马铃薯甲虫幼虫体内的20E信号转导途径。
2.3 dsLdATPaseE的剂量效应
研究表明,LdATPaseE的mRNA 水平、体重和化蛹率显著下降,且下降幅度与使用剂量正相关。重要的是,dsLdATPaseE1/dsLdATPaseE2稀释104倍后处理叶片,仍能显著降低马铃薯甲虫三龄幼虫的化蛹率,而这一浓度仅相当于5 ng/mL的dsRNA浓度。图6

注:5个不同浓度的dsE1(左栏)和dsE2(右栏)分别浸泡叶片饲喂试虫1 d,随后用PBS浸泡叶片饲喂试虫2 d后,测定了试虫的靶标基因表达量(A和B)、幼虫体重(C和D)和化蛹率(E和F)。空白对照(CK)用PBS浸泡叶片、负对照(dsegfp)用最高浓度(即稀释100倍的菌液)连续饲喂幼虫3 d。柱状图表示平均数±标准误。柱顶不同的小写字母表示在P< 0.05水平差异显著
LdATPaseE的mRNA 水平、体重和化蛹率的下降幅度也与使用剂量正相关。对LdATPaseE的mRNA 水平的最低有效浓度为稀释104倍即dsRNA浓度为5 ng/mL。对体重影响的最低有效浓度为稀释102倍即dsRNA浓度为500 ng/mL。对化蛹率影响的最低有效浓度为稀释103倍即dsRNA浓度为50 ng/mL。图7

注:5个不同浓度的dsE1(左栏)和dsE2(右栏)分别浸泡叶片饲喂试虫1 d,随后用PBS浸泡叶片饲喂试虫2 d后,测定试虫的靶标基因表达量(A和B)、幼虫体重(C和D)和化蛹率(E和F)。空白对照(CK)用PBS浸泡叶片、负对照(dsegfp)用最高浓度(即稀释100倍的菌液)连续饲喂幼虫3 d。柱状图表示平均数± 标准误。柱顶不同的小写字母表示在P< 0.05差异显著
3 讨 论
vATPase是一个高度进化保守的古老跨膜转运蛋白复合体,在真核生物中拥有多个重要的功能。研究在马铃薯甲虫L.decemlineata中克隆并描述了囊泡型ATP酶E亚基(vATPase subunit E,LdATPaseE)的基因。在黑腹果蝇中,E亚基被单个基因编码。系统发育的结果证明了ATPaseE亚基的蛋白质在昆虫类群中形成一个大分支,而2个哺乳动物形成了一个小分支,该2支互相分开。这些结果表明,马铃薯甲虫中的LdATPaseE与黑腹果蝇的ATPaseE为直系同源关系。
在昆虫中,vATPases担负肠道的营养吸收、马氏管液体的分泌和卵母细胞的液体吸收等重要功能[21-22]。与vATPase的功能一致,结果表明,LdATPaseE在马铃薯甲虫四龄幼虫肠道和马氏管中表达量很高。
在一至三龄的幼虫中,LdE75在蜕皮后出现高峰,在龄末期出现低谷。在四龄幼虫中,LdATPaseE的最高峰出现在蜕皮后72 h,低谷出现在蜕皮后96 h。可见,在马铃薯甲虫L.decemlineata中20E滴度的高峰和LdATPaseE的表达水平的低谷同时出现。20E的高峰抑制LdATPaseE的表达。
20E和蜕皮酮类似物氯虫酰肼(Hal)在幼虫末龄抑制了LdATPaseE的表达量。相反,喂食LdSHD和LdFTZ-F1的dsRNA降低20E的水平则上调了LdATPaseE的表达量。因此,20E的峰值抑制了LdATPaseE的表达。相反,取食JH及其类似物吡丙醚、敲低咽侧体静止激素基因LdAS-C[23]和保幼激素酸甲基转移酶LdJHAMT[24]都不影响马铃薯甲虫四龄幼虫体内LdATPaseE表达量。JH不参与调控LdATPaseE。
4 结 论
采用RNAi技术敲低LdATPaseE表达量不仅引起二龄幼虫的死亡,而且影响三龄和四龄幼虫的化蛹,可见马铃薯甲虫三龄和四龄幼虫对dsLdATPaseE非常敏感。对于三龄幼虫,dsLdATPaseE1/dsLdATPaseE2稀释104倍后处理叶片,仍能显著降低马铃薯甲虫的化蛹率,而这一浓度仅相当于5 ng/mL的dsRNA浓度。对于四龄幼虫,对LdATPaseE的mRNA 水平的最低有效浓度为稀释104倍即dsRNA浓度为5 ng/mL。对体重影响的最低有效浓度为稀释102倍即dsRNA浓度为500 ng/mL。对化蛹率影响的最低有效浓度为稀释103倍即dsRNA浓度为50 ng/mL。LdATPaseE是应用RNAi技术治理马铃薯甲虫幼虫的候选基因。
敲低LdATPaseE还显著升高了LdInR与Ld4EBP的表达量,抑制一个蜕皮激素合成基因的转录,降低20E滴度和一个20E响应基因的表达。敲低2个LdE75亚型还抑制了一个JH合成酶基因的表达,降低了JH滴度,下调了一个JH早期响应基因的表达量。敲低LdATPaseE通过抑制IIS信号途径,降低20E和JH的滴度、下调20E和JH信号而影响幼虫生长和发育。
在马铃薯甲虫四龄幼虫阶段,20E通过其信号转导途径抑制LdATPaseE的表达。
