飞扬肠胃炎胶囊对实验性胃溃疡的保护作用及机制研究
2021-07-05赵小燕余承莉王四旺
周 丹,田 天,李 骅,舒 庆,赵小燕,余承莉,耿 鑫,王四旺
(1.西安市第九医院药剂科,西安 710054;2.空军军医大学药学系中药与天然药物学教研室,西安 710032)
胃溃疡(GU)是一种影响患者生活质量的常见胃肠道疾病,发病率高达10%,现已成为本世纪重要的公共卫生负担[1]。近年来研究表明,检测核因子NF-E2相关因子(Nrf2)/血红素加氧酶1(HO-1)介导的抗氧化应激是胃黏膜保护作用的重要信号通路[2-3]。飞扬肠胃炎胶囊是由飞扬草、火炭母及救必应组成的方剂,具有泻火解毒、除湿止痛之功效,主治细菌性痢疾和急、慢性肠胃炎,临床应用广泛,疗效确切[4-6]。本研究拟对飞扬肠胃炎胶囊的胃保护作用及其作用机制进行研究,为其临床应用提供参考。
1 仪器与材料
1.1仪器 Eppendorf Certrifuge 5417R型台式高速冷冻离心机(艾本德生命科技集团公司);SCILOGEX型赛洛捷克混匀仪(美国赛洛捷克公司);BioTek酶标仪(美国伯腾仪器有限公司);OLYMPUS CKX 53型荧光显微镜(奥林巴斯公司);ND 5000型超微量紫外可见分光光度计(无锡百泰克生物技术有限公司);PB-10型数字测量仪(赛多利斯仪器系统集团公司)。
1.2试药 飞扬肠胃炎胶囊(批号20151201),陕西君碧莎制药有限公司;兰索拉唑片(批号19020121),扬子江药业集团股份有限公司;无水乙醇,霍尼韦尔国际集团公司;戊巴比妥钠,Sigma公司;阿利新蓝,北京索莱宝科技有限公司;氯化镁,天津市河东区红岩试剂厂;磷酸盐缓冲液(PBS),HyClone公司;4%多聚甲醛,上海尚宝生物科技有限公司;SABC免疫组化试剂盒,博士德生物工程有限公司;前列腺素E2(PGE-2)、过氧化氢酶(CAT)、超氧化物岐化酶(SOD)、硫代巴比妥酸反应物(TBARS)和一氧化氮(NO)试剂盒,均购自武汉伊莱瑞特生物科技股份有限公司;谷胱甘肽(GSH)试剂盒,南京建成生物工程研究所;血红素加氧酶1 (HO-1)抗体,Proteintech公司;核因子NF-E2相关因子(Nrf2)抗体,Elabscience公司;辣根过氧化物酶标记山羊抗鼠,碧云天生物技术有限公司。
1.3动物 清洁级雄性健康成年SD大鼠,体质量为180~230 g,购自空军军医大学实验动物中心,生产合格证号:SCXK(军)字第2012-007号。
2 方法
2.1实验分组及给药 将48只SD大鼠随机分为正常组、模型组、兰索拉唑组以及飞扬肠胃炎胶囊低、中和高剂量组,每组8只。正常组和模型组均给予生理盐水;兰索拉唑组按照30 mg·kg-1的剂量给予兰索拉唑;飞扬肠胃炎胶囊低、中和高剂量组分别按照200、400、600 mg·kg-1的剂量给药;将兰索拉唑、没食子酸、飞扬肠胃炎胶囊分别溶于生理盐水中,每组大鼠均按照10 mL·kg-1灌胃给药。
2.2大鼠GU模型的建立 各组大鼠每日灌胃给药1次,连续7 d。造模前,各组大鼠禁食24 h,可自由饮水,保持胃排空状态。造模前1 h,正常组和模型组分别给予10 mL·kg-1的生理盐水,其余各组分别给予相应的药物。给药1 h后,除正常组外,其余各组大鼠均给予无水乙醇(5 mL·kg-1)灌胃,建立大鼠GU模型[7]。
2.3样本采集与处理 各组大鼠用无水乙醇灌胃4 h后,腹腔注射戊巴比妥钠麻醉,腹主动脉取血,静置1 h后,以4 000 r·min-1离心15 min,取血清,-80 ℃保存,待用。取血后,结扎贲门和幽门,摘下胃部,清洗表面后沿胃大弯剪开,小心收集胃内容物,待用,将胃部在冰上平展开,进行溃疡指数(UI)评分。
2.4UI评分 UI评分由对实验分组情况完全不了解的人员来判定,具体评价标准见表1。保护指数(PI)的百分比按照公式[8]计算:PI=(模型组UI-给药组UI)÷模型组UI×100%。
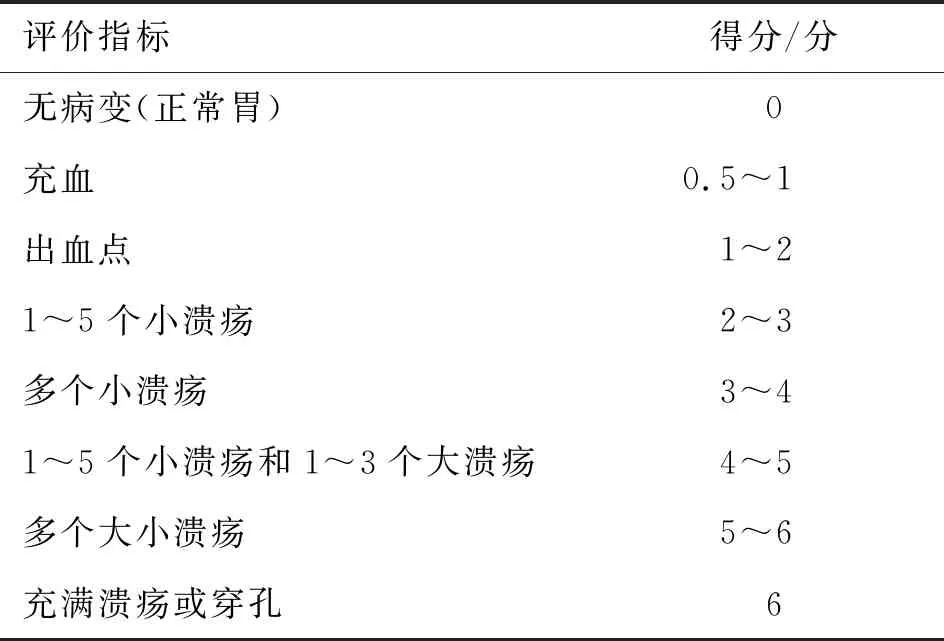
表1 UI评价标准
2.5胃内容物酸度(pH)值测定 将大鼠胃内容物收集在离心管中,以3 000 r·min-1离心10 min,用pH数字测量仪测定上清液的胃内容物pH值[9]。
2.6胃黏液量(GWM)的测定 GWM按照Corne S J等[10]实验方法进行测定:取大鼠胃腺体部分,在阿利新蓝溶液中浸泡2 h,用0.25 mol·L-1蔗糖冲洗多余的染料,用0.5 mol·L-1氯化镁溶液提取30 min,提取液中加入二乙醚,振荡2 min,在580 nm波长处测定各组大鼠的吸光度值。
2.7蛋白含量的测定 取150 mg胃组织浸泡在150 mL PBS中,匀浆,以3 000 r·min-1低温离心10 min,收集上清液,测定酶活力。匀浆后的组织裂解参照说明书操作,最后用核酸蛋白分析仪测定胃组织匀浆中的蛋白质含量。
2.8氧化酶的活性以及前列腺素E2 (PGE-2)的水平 取2.7项下的组织匀浆上清液,按照试剂盒说明书测量NO、PGE-2、TBARS、SOD、CAT和GSH的水平。
2.9大鼠胃组织病理学评价和免疫组化分析 取大鼠胃组织,用4%多聚甲醛固定,石蜡包埋,切成5 μm薄片。切片用HE染色后观察大鼠胃组织病理学形态。取上述石蜡切片进行免疫组化检测,过氧化氢室温孵育10 min后用PBS冲洗,BCA封闭30 min,用稀释的一抗Nrf2(1∶100)和HO-1(1∶100)4 ℃孵育过夜,室温孵育辣根过氧化物酶标记的二抗30 min,SABC显色。切片使用光学显微镜观察。
2.10数据处理及分析 实验数据使用Graphpad Prism软件5.01版进行统计分析。GWM、胃内容物pH值、PGE-2、NO、GSH、SOD、TBARS、CAT、Nrf2及HO-1均通过单因素方差分析(One-way ANOVA)对组间的差异进行比较,P<0.05表示差异有统计学意义。UI采用非参数秩和Kruskal-Wallis方差分析法分析以及Mann-Whitney U检验进行组间比较,P<0.05表示差异有统计学意义。
3 结果
3.1飞扬肠胃炎胶囊对乙醇诱发的GU的保护作用 见表2。由表2可知,与模型组相比,兰索拉唑组和飞扬肠胃炎胶囊中、高剂量组均可明显降低UI评分,差异有统计学意义(P<0.05);兰索拉唑组以及飞扬肠胃炎低、中和高剂量组的GU抑制率分别为59.13%、23.94%、58.05%、59.72%。
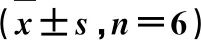
表2 各组UI及GU抑制率的比较
3.2飞扬肠胃炎胶囊对胃内容物pH值及GWM的影响 见表3。由表3可知,与正常组比较,模型组大鼠胃内容物pH值明显降低(P<0.001);兰索拉唑组和飞扬肠胃炎胶囊低、中、高剂量组均能显著升高大鼠胃内容物pH值(P<0.001),兰索拉唑组与飞扬肠胃炎胶囊低剂量组比较差异有统计学意义,而与飞扬肠胃炎胶囊中、高剂量组比较差异无统计学意义。与模型组比较,兰索拉唑和飞扬肠胃炎胶囊低、中、高剂量组预处理均可显著增加GWM水平(P<0.001),兰索拉唑组与飞扬肠胃炎胶囊低剂量组比较差异有统计学意义(P<0.001),与飞扬肠胃炎胶囊中、高剂量组比较差异无统计学意义。
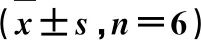
表3 飞扬肠胃炎胶囊对胃内容物pH值及GWM的影响
3.3飞扬肠胃炎胶囊对PGE-2和NO水平的影响 见表4。由表4可知,与正常组比较,模型组大鼠胃组织中PGE-2和NO水平显著降低(P<0.001);兰索拉唑和飞扬肠胃炎胶囊低、中、高剂量组预处理均可显著增加大鼠胃组织中PGE-2和NO的水平(P<0.001)。在改善PEG-2和NO水平方面,飞扬肠胃炎胶囊低剂量组与兰索拉唑组之间差异有统计学意义,而飞扬肠胃炎胶囊中、高剂量组与兰索拉唑组之间差异无统计学意义。
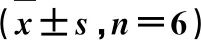
表4 飞扬肠胃炎胶囊对PGE-2和NO的影响
3.4飞扬肠胃炎胶囊对氧化应激的影响 见表5。由表5可知,脂质过氧化物的水平通过检测TBARS和GSH的水平来表达,抗氧化应激能力通过检测SOD和CAT的水平来评判。与正常组比较,模型组大鼠胃组织中TBARS的水平明显升高(P<0.001),GSH、SOD和CAT水平显著降低(P<0.001);兰索拉唑组和飞扬肠胃炎胶囊低、中、高剂量组预处理均可显著升高胃组织中CAT、SOD和GSH的水平(P<0.05或P<0.001),降低胃组织中TBARS水平(P<0.05或P<0.001)。且在改善各氧化指标方面,兰索拉唑组与飞扬肠胃炎胶囊低剂量组之间差异有统计学意义,与飞扬肠胃炎胶囊中、高剂量组之间差异无统计学意义。
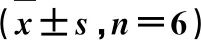
表5 飞扬肠胃炎胶囊对氧化应激的影响
3.5飞扬肠胃炎胶囊保护大鼠胃组织病理损伤 见图1。由图1可知,正常组大鼠胃组织病理学检查显示胃黏膜结构完整,上皮和胃腺排列整齐,形状规则。与正常组相比,模型组大鼠胃黏膜几乎所有部位均出现不同程度的变性、坏死和出血,如炎性细胞浸润、黏膜下水肿、胃小凹脱落等。兰索拉唑组和飞扬肠胃炎胶囊低、中、高剂量组预处理均可显著减轻胃黏膜炎症细胞浸润和黏膜下水肿,减轻胃黏膜病变,保护胃黏膜。兰索拉唑组和飞扬肠胃炎胶囊中、高剂量均能明显改善胃黏膜的病理改变,使胃黏膜结构接近正常,且改善程度相当。
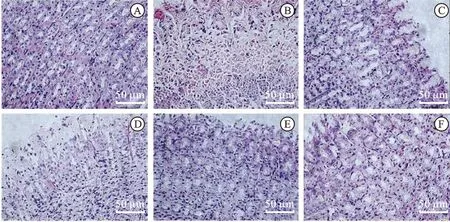
图1 胃组织HE染色
3.6飞扬肠胃炎胶囊对Nrf2和HO-1蛋白表达的影响 见图2。由图2可知,兰索拉唑组和飞扬肠胃炎胶囊低、中、高剂量组均明显上调了Nrf2和HO-1的蛋白表达。且飞扬肠胃炎胶囊中、高剂量组与兰索拉唑组改善Nrf2和HO-1蛋白表达的作用相当。

图2 Nrf2和HO-1蛋白的免疫组化表达 (200×)
4 讨论
本研究发现,飞扬肠胃炎胶囊具有明显的抗GU作用,包括减少GU面积,升高胃内容物pH值,减轻黏膜下水肿和白细胞浸润。乙醇干扰胃腺的分泌活动,改变细胞的通透性,消耗胃黏液[11]。胃酸分泌是胃黏膜损伤的主要侵袭性因素[12]。飞扬肠胃炎胶囊预处理能够显著升高模型组大鼠胃内容物pH值并抑制GWM的减少,提示没食子酸和飞扬肠胃炎胶囊的胃保护作用可通过调节胃内容物pH值和GWM来发挥。
NO和 PGE-2是保护胃黏膜的关键介质,NO可保护胃黏膜免受各种有害物质的损伤[13-15],PGE-2可防止乙醇引起的黏膜坏死和出血[16],有利于GU愈合[17-18]。在目前的研究中,飞扬肠胃炎胶囊低、中、高剂量组大鼠胃黏膜中NO和PGE-2水平增加,表明NO和PGE-2可能参与了飞扬肠胃炎胶囊对实验性GU的保护作用。
氧化应激的发生通常与活性氧(ROS)的产生相关。正常情况下,这些ROS被GSH、CAT和SOD等重要的内源性抗氧化剂所中和。然而,当氧化应激状态发生时,ROS的产生和积累超过了细胞抗氧化系统或防御系统,不能很好地中和这些氧化物[19]。研究表明,氧化应激和内源性抗氧化分子的减少与乙醇诱导的胃黏膜损伤发病机制有关[14]。丙二醛(MDA)是氧化应激的标志性产物,是不饱和脂肪酸通过ROS激活的脂质过氧化作用产生[20]。因此,MDA被认为是脂质过氧化的生物标志物,被用于量化和鉴定氧化应激[9]。本实验研究发现,飞扬肠胃炎胶囊可以提高GSH、CAT和SOD的水平,并抑制TBARS的产生,表明飞扬肠胃炎胶囊主要通过抑制氧化应激来对抗乙醇诱导的胃损伤。
Nrf2信号通路可激活内源性抗氧化酶,在保护细胞免受氧化损伤中发挥关键作用[21-22]。在生理条件下,Nrf2与负调控因子Keap1结合,并被定向固定在细胞质中。然而,在氧化应激状态下,Nrf2与Keap1分离,然后易位到细胞核,诱导HO-1的蛋白表达[23]。HO-1又称热休克蛋白32(HSP32),可直接或通过抑制ROS的产生而发挥抗炎、抗凋亡作用。而Nrf2/HO-1信号通路亦被证实与胃黏膜损伤的发生密切相关[2-3]。在本研究中,飞扬肠胃炎胶囊可显著增加Nrf2的蛋白表达并上调HO-1,提示飞扬肠胃炎胶囊可通过调控Nrf2/HO-1信号通路发挥胃保护作用。
