基于模拟胃消化对小米黄酒抗氧化活性的影响
2021-07-04郭佳垚李倩倩武佳文赵廉谦
郭佳垚,张 伟,李倩倩,武佳文,赵廉谦,郝 林
(1.山西农业大学 食品科学与工程学院,山西 晋中 030801;2.山西雁门山酒业有限公司,山西 忻州 034200)
黄酒作为世界上最古老的酒之一,始于商周时代,且不同地域的黄酒风格各不相同[1-2]。黄酒经长时间糖化发酵,原料中的大分子物质转化为易被人体吸收的小分子物质,且在发酵过程会产生一些具有特殊功能的生物活性物质,加之其酒温性顺、体丰味醇,越来越成为大众群体消费的主流[3-7]。
细胞是构成生命的基本单位,而自由基通过夺取外部电子造成了对机体细胞的损伤,加速了人体衰老。因此人体通过摄入外界的抗氧化物质来提高其免疫防御系统,以维持体内的平衡[8-9]。宋云刚[10]对香菇红曲黄酒的体外抗氧化活性进行了研究,羟自由基、超氧阴离子自由基和1,1-二苯基-2-苦基苯肼(1,1-diphenyl-2-bitterhydrazine,DPPH)自由基的清除率分别在发酵第12、14、16天达到最高,水平分别为88%、72%和92%。但一般的体外抗氧化实验与真实的生理环境有所差异,因此不能科学的体现产品在人体内消化后的抗氧化活性。模拟体外消化模型是一种更加接近真实环境的研究方法,相对于小鼠消化试验模型是一种易实施、低成本的研究手段[11-14]。近年来,越来越多的学者、研究人员增加胃消化对酒抗氧化活性的研究进展。如王静等[15]采用体外模拟胃肠消化对猕猴桃果浆和果汁消化前后抗氧化活性进行对比,其中铁还原力以及DPPH自由基、超氧阴离子自由基、羟自由基清除率在模拟胃消化后均有所提高。张灿等[16]采用模拟消化对青麦仁饼干消化前后抗氧化活性进行了研究,DPPH自由基清除率显著增加,2,2'-联氨-二-(3-乙基苯并噻唑啉-6-磺酸)(2,2'-azinobis-(3-ethylbenzothiazoline-6-sulfphonate),ABTS)自由基清除率和羟基自由基清除率先降低后增加。本试验为了研究小米黄酒在消化前后抗氧化活性的变化,尝试通过模拟胃肠消化可以快速准确的对食物中功能成分的作用有着更全面科学的评价,对小米黄酒的抗氧化作用进行更全面科学的评价。
1 材料与方法
1.1 材料与试剂
小米黄酒(酒精度15.4%vol、总糖34.4 g/L、总酸6.03 g/L、氨基酸态氮0.64 g/L):山西农业大学生物工程实验室酿造;胃蛋白酶(3 000 U/mg):上海麦克林生化科技有限公司;DPPH(分析纯):上海蓝季生物有限公司;盐酸(分析纯):成都市科隆化学品有限公司;水杨酸、邻苯三酚(均为分析纯):天津市北联精细化学品开发有限公司;维生素C(vitamin C,VC):福晨(天津)化学试剂有限公司;磷酸、铁氰化钾、三氯化铁(均为分析纯):天津市致远化学试剂有限公司;三氯乙酸、氯化钠(均为分析纯):天津市天力化学试剂有限公司。
1.2 仪器与设备
ZWY-103B恒温培养振荡器:上海智城分析仪器制造有限公司;HH-4数显电子恒温水浴锅:常州国华电器有限公司;PHS-3C酸度计:上海佑科仪器仪表有限公司;UV-5300紫外分光光度计:上海元析仪器有限公司。
1.3 方法
1.3.1 体外模拟胃消化试验
模拟胃液的配制[17-18]:采用0.1 mol/L盐酸溶液溶解166.67 mg胃蛋白酶,配制成5 000 U/mL的模拟胃液。
参考胡义东等[8,16]的方法并稍作修改,设置3组试验:
(1)模拟胃消化组:取15 mL小米黄酒,用0.1 mol/L盐酸溶液将其pH调节至2.0,再加入3 mL模拟胃液,经模拟胃消化2 h;
(2)空白对照组:为控制与试验组体系一致,取15 mL小米黄酒,用0.1 mol/L盐酸溶液将其pH调节至2.0,再加入3 mL模拟胃液,经模拟胃消化0 h;
(3)胃酸对照组:为了区分酸环境和酶环境的影响,以未加胃蛋白酶、加等体积等浓度盐酸溶液的小米黄酒经模拟胃消化2 h为胃酸对照组;
以上三组试验在37℃、140 r/min的恒温水浴摇床中振荡,取出适量消化液3 500 r/min离心15 min,-20 ℃条件下保存。
1.3.2 模拟胃消化技术路线

在A点处表示小米黄酒原液的抗氧化活性;在B点处表示空白对照组的抗氧化活性;在C点处表示模拟胃消化组、胃酸对照组的抗氧化活性。经模拟胃消化环境后,为保持与试验组体系一致,故用(C-B)值表示小米黄酒经模拟胃消化抗氧化活性的变化量。
1.3.3 抗氧化活性测定
DPPH自由基清除率参照LARRAURI J A等[19]的方法进行测定;还原能力测定参照DUAN X等[20-21]的方法进行测定;超氧阴离子自由基清除率参照HU T T等[22]的方法进行测定;羟自由基清除率参照缪冰旋[23]的方法并稍作修改,进行测定。所有指标均以同质量浓度VC溶液作为阳性对照。
1.3.4 样品处理
酒样处理:量取0.1 mL、0.2 mL、0.3 mL、0.4 mL、0.5 mL、0.6mL、0.8mL和1.0mL的小米黄酒分别用蒸馏水定容至1mL,即酒样浓度为0.1 mL/mL、0.2 mL/mL、0.3 mL/mL、0.4 mL/mL、0.5 mL/mL、0.6 mL/mL、0.8 mL/mL和1.0 mL/mL。
消化液处理:量取0.1 mL、0.2 mL、0.3 mL、0.4 mL、0.5 mL、0.6 mL、0.8 mL和1.0 mL的消化液分别用0.9%生理盐水定容至1mL,即消化液浓度为0.1mL/mL、0.2mL/mL、0.3mL/mL、0.4 mL/mL、0.5 mL/mL、0.6 mL/mL、0.8 mL/mL和1.0 mL/mL。
1.3.5 数据处理
所有指标均重复测定3次,结果以平均值±标准差(X±SD)表示。利用Excel 2016软件处理数据,用Origin 9.0软件进行数据作图。采用SPSS20.0软件分析方法中的Duncan's多重比较进行数据分析,以P<0.05表示差异显著性分析。通过SPSS 20.0软件建立回归方程,选择Probit分析,计算得出半抑制浓度(half maximal inhibitory concentration,IC50)[24]。
2 结果与分析
2.1 小米黄酒体外抗氧化活性
如图1所示,随着小米黄酒酒样浓度的提高,DPPH自由基、超氧阴离子自由基、羟自由基的清除率和还原能力呈上升趋势。当酒样浓度为0.1~0.2 mL/mL,酒样DPPH自由基清除率差异显著;当酒样浓度在0.3~0.5 mL/mL时,酒样对DPPH自由基清除率低于VC,酒样的DPPH自由基清除率最高可达93.99%。当酒样浓度为0.4~1.0 mL/mL时,酒样超氧阴离子自由基清除率差异不显著,清除率略低于VC,酒样的超氧阴离子自由基清除率最高可达78.23%。当酒样浓度为0.1~0.5 mL/mL时,酒样还原能力差异显著,酒样还原能力最高为1.015。当酒样浓度为0.1~0.2 mL/mL时,酒样羟自由基清除率差异显著,略低于VC;酒样浓度在0.3~0.5 mL/mL时,酒样对羟自由基清除率略高于VC,酒样的羟自由基清除率最高可达90.96%。结果表明,小米黄酒在清除DPPH自由基、超氧阴离子自由基、羟自由基清除率和还原能力方面与VC相当。

图1 小米黄酒的抗氧化活性Fig.1 Antioxidant activity of millet Huangjiu
2.2 模拟胃消化后小米黄酒的抗氧化活性
2.2.1 DPPH自由基清除率
如图2所示,小米黄酒经过模拟胃消化2 h后DPPH自由基清除率较强,当消化液浓度为0.1 mL/mL时,模拟胃消化组和胃酸对照组的DPPH自由基清除率分别为(58.32±1.78)%和(53.11±1.39)%,说明模拟酸环境对DPPH自由基清除率影响大于酶环境对其的影响;随着消化液浓度的升高,模拟胃消化组差异显著,消化液与DPPH自由基配对后,DPPH自由基清除率逐渐升高,当消化液浓度为0.5 mL/mL时,模拟胃消化组和胃酸对照组的DPPH自由基清除率分别为(88.90±2.47)%和(78.36±2.31)%。此浓度时,模拟胃消化组对比空白对照组的DPPH自由基清除率提高了76.87%,其IC50值为66 μL/mL。胃液中蛋白酶酶解产物由于存在疏水性氨基酸或短肽物质,有利于降低DPPH自由基清除率[25]。消化液浓度范围为0.1~0.5 mL/mL时,模拟胃消化组DPPH自由基清除率>胃酸对照组>空白对照组。
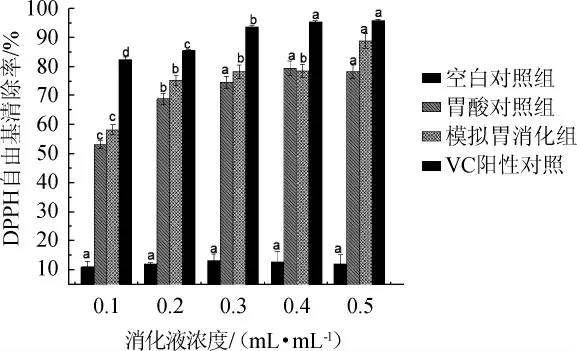
图2 小米黄酒模拟胃消化前后的DPPH自由基清除率Fig.2 DPPH free radical scavenging rate of millet Huangjiu before and after stomach digestion
2.2.2 还原能力
如图3所示,当消化液浓度为0.1 mL/mL时,空白对照组和模拟胃消化组的还原能力分别为0.052±0.001和0.094±0.001;随着消化液浓度的升高,各组别的还原能力逐渐上升差异显著,当消化液浓度为0.5 mL/mL时,模拟胃消化组和胃酸对照组的还原能力分别为0.309±0.001和0.289±0.002,说明模拟酸环境对还原能力的影响大于酶环境对其的影响,且部分供氢氨基酸可以增加样液的还原能力[26]。此时,模拟胃消化组对比空白对照组的还原能力增加了0.223,在空白对照组的基础上提高了259.30%。消化液浓度范围为0.1~0.5 mL/mL时,模拟胃消化组还原能力>胃酸对照组>空白对照组。

图3 小米黄酒模拟胃消化前后的还原能力Fig.3 Reduction ability of millet Huangjiu before and after stomach digestion
2.2.3 超氧阴离子自由基清除率
如图4所示,模拟胃消化组的超氧阴离子自由基清除率均较强,当消化液浓度为0.2 mL/mL时,模拟胃消化组的超氧阴离子自由基清除率为(71.05±8.79)%,消化液与自由基结合反应,从而阻止有色中间物质的产生,随着消化液浓度的升高,自由基清除率呈上升趋势。其中,胃酸对照组的超氧阴离子自由基清除率相对稳定。当消化液浓度为0.8 mL/mL时,模拟胃消化组和胃酸对照组的超氧阴离子自由基清除率分别为(78.91±2.82)%和(75.33±2.55)%,模拟胃消化组对比空白对照组的超氧阴离子自由基清除率提高了68.43%,模拟胃消化组的IC50值为5 μL/mL。消化液浓度范围为0.2~1.0 mL/mL时,超氧阴离子自由基清除率:模拟胃消化组>胃酸对照组>空白对照组。

图4 小米黄酒模拟胃消化前后的超氧阴离子自由基清除率Fig.4 Scavenging rate of superoxide anion radical of millet Huangjiu before and after stomach digestion
2.2.4 羟自由基清除率
如图5所示,当消化液浓度为0.1 mL/mL时,模拟胃消化组和胃酸对照组的羟自由基清除率分别为(50.79±0.33)%和(47.73±0.26)%,说明模拟酸环境对羟自由基清除率的影响大于酶环境对其的影响。随着消化液浓度的升高,羟自由基清除率呈上升趋势且差异显著。当消化液浓度为0.5 mL/mL时,模拟胃消化组的羟自由基清除率为(78.67±0.15)%,对比空白对照组的羟自由基清除率提高了57.92%,其IC50值为90 μL/mL。消化液浓度范围为0.1~0.5 mL/mL时,羟自由基清除率:模拟胃消化组>胃酸对照组>空白对照组。

图5 小米黄酒模拟胃消化前后的羟自由基清除率Fig.5 Hydroxyl radical scavenging rate of millet Huangjiu before and after stomach digestion
3 结论
通过对小米黄酒模拟胃消化前后抗氧化活性的变化规律进行研究分析,小米黄酒有着较强的还原能力和清除DPPH自由基、超氧阴离子自由基、羟自由基的能力。在模拟胃消化2 h后,小米黄酒的DPPH自由基清除率提高了76.87%,羟自由基清除率提高了57.92%,超氧阴离子自由基清除率提高了68.43%,还原能力提高了0.223。本试验证明,经过模拟胃消化后的小米黄酒在消化液浓度范围内的抗氧化活性明显提高,小米黄酒具有较强的抗氧化活性。
