华中乌蔹莓乙醇提取物成分分析及功能性研究
2021-07-04李亚婷
李亚婷,江 念
(1.长江大学,湖北 荆州 434026;2.湖北民族大学,湖北 恩施 445000;3.沙洋县长湖湿地自然保护区管理局,湖北 荆门 448000)
华中乌蔹莓[Cayratiaoligocarpa(Levl. et Vant.) Gagnep]为葡萄科乌蔹莓属草质藤本植物[1],适应性强,性喜温暖湿润,在适宜的生存环境下生长十分迅速,田间、林下、山谷中均有分布,生物量巨大。乌蔹莓属植物中富含多种有效成分,其中黄酮类物质为主要有效成分[2],黄酮类物质具有抗氧化、抗炎、降血糖等作用[3-6]。目前从传统中药中提取有效成分用于临床医学中为当前研究热点之一,黄酮类化合物作为功能成分,当前应用非常广泛。黄酮类物质在乙醇中的溶解度最高,对华中乌蔹莓的乙醇提取物进行分析,深度了解华中乌蔹莓黄酮组分,是华中乌蔹莓的开发利用过程中必不可少的。
黄酮类独特的生理结构使之有较强的清除自由基能力,许多植物黄酮均有较好的体内抗氧化活性[7-10]。以血清药理学方法为基础,以1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazy,DPPH)自由基为指标[11-14],研究在华中乌蔹莓乙醇提取物连续灌胃大鼠后,大鼠体内经消化吸收后含药血清的抗氧化作用。采取长时间灌胃的方式处理大鼠,测定大鼠血清中丙二醛(Malondialdehyde,MDA)水平和超氧化物歧化酶(Superoxide dismutase,SOD)活力,研究华中乌蔹莓醇提物对大鼠体内抗氧化作用;采取连续灌胃的方式处理数天后对大鼠进行游泳试验、闭气生存试验、抗饥饿试验研究乌蔹莓对大鼠的抗疲劳效果和生存能力的影响,旨在为华中乌蔹莓的开发利用提供理论依据。
1 材料与仪器
1.1 仪器
主要试验仪器见表1。

表1 主要仪器Table 1 Main instruments
1.2 试剂
芦丁标准品、槲皮素标准品、绿原酸标准品、甲醇、无水乙醇、丙酮、石油醚均为分析纯,乙腈、乙酸为色谱纯。超氧化物歧化酶(SOD)试剂盒、丙二醛(MDA)试剂盒购于南京建成生物工程研究所。
1.3 材料
1.3.1 成分测定材料制备
取华中乌蔹莓全草,用自来水将根、茎和叶上的附着物清洗干净,再以超纯水冲洗3次,烘干粉碎,标号备用。准确称取华中乌蔹莓粉末2.0 g,加入25 mL 80%的乙醇溶液,于80℃的恒温水浴索氏提取,提取时间为2.5 h,提取结束后,滤渣抽滤过滤并用少量80%乙醇溶液冲洗,提取3次将提取液合并,用乙醇定容至100 mL,得华中乌蔹莓醇提物样品液[10,15]。
1.3.2 大鼠灌胃材料材料制备
将华中乌蔹莓全草烘干并粉碎,用石油醚浸泡7天进行脱脂和脱脂溶性蛋白处理,浸泡后滤掉石油醚并烘干。用溶剂提取法进行提取,将提取液合并减压浓缩。用三倍体积的碱性高浓度乙醇(pH9,浓度95%)溶解,过滤掉沉淀物取上清液,减压浓缩,60℃烘干至恒重得华中乌蔹苺黄酮粗纯物。以芦丁为标准品经亚硝酸钠—硝酸铝—氢氧化钠法测定黄酮粗纯物得黄酮含量为84.35%。
1.3.3 试验动物
健康昆明种雄性大鼠(SPF级SD大鼠),购于三峡大学动物实验中心,合格证号:SCXK(鄂)2011-0012。
2 试验方法
2.1 光谱扫描
取华中乌蔹莓醇提物样品液,以80%的乙醇溶液为对照,在190~700 nm波长范围内对其进行紫外扫描。
2.2 成分分析
以液相色谱分析华中乌蔹莓乙醇提取物,流动相A为乙腈(流动相B为1.0%醋酸),按0~20 min (18~60%),20~30 min(60~100%),柱温25℃,进样量20 μL,流速1.0 mL/min,检测波长280 nm。质谱条件:电离源(EI);电离电压:70 V;电子轰击能量:70.0 eV;气体:N2;温度:350℃;扫描范围100~1 000 m/z[15]。
2.3 大鼠抗氧化试验
2.3.1 短期试验
2.3.1.1 含药血清的制备 40只6周健康昆明种雄性鼠,体重(120±5) g,随机分成8组,每组5只,灌服华中乌蔹莓黄酮样品,灌胃剂量分别为10 ~250 mg/kg,对照组灌服5 mL蒸馏水,试验前只给适量清水,禁食24 h,连续7次灌胃。每次给药1.5 h后再次给药,末次给药后2 h断头取血,常温静置后,在转速3 500 r/min的离心机中离心20 min,取血清置于-20℃冰箱保存备用[7]。
2.3.1.2 含药血清对 DPPH清除率的测定 取经华中乌蔹莓黄酮粗提物处理后的大鼠血清0.5 mL,加入无水乙醇补足至2 mL,将2 mL血清—乙醇溶液和2 mL DPPH乙醇溶液(浓度为0.032 mg/mL)摇匀、震荡至充分反应,充分摇匀后避光放置30 min,在转速4 000 r/min的离心机中离心25 min,吸取上清液在波长517 nm下测定吸光度值。
清除率计算方式:清除率/%=[(A0-A1)/A0]×100,式中A0为DPPH—乙醇溶液的吸光度值,A1为样品溶液的吸光度值[7]。
2.3.2 长期喂养试验
40只昆明种大鼠随机分为5组:正常对照组(灌胃4 mL蒸馏水)、维生素C阳性对照组(灌胃剂量50 mg/kg)、华中乌蔹莓黄酮处理低剂量组(灌胃剂量 50 mg/kg)、华中乌蔹莓黄酮处理中剂量组(灌胃剂量100 mg/kg)和华中乌蔹莓黄酮处理高剂量组(灌胃剂量200 mg/kg),每组8只。每天上午9时灌胃,连续给药7 周,试验期间正常饮食。试验进行7周后结束,禁食12 h,断头取血。按照试剂盒测定方法测定SOD与MDA。
2.4 大鼠抗疲劳试验
24只昆明种大鼠随机分为4组:正常对照组(灌胃4 mL蒸馏水)、华中乌蔹莓黄酮处理低剂量组(灌胃剂量50 mg/kg)、华中乌蔹莓黄酮处理中剂量组(灌胃剂量100 mg/kg)和华中乌蔹莓黄酮处理高剂量组(灌胃剂量200 mg/kg),每组6只大鼠。每天上午9点灌胃,连续给药7周,每周测体重一次,试验期间正常饮食,注意观测,7周后试验结束[16]。
连续给药7周后,每组取6只大鼠,让大鼠在恒温水槽(温度37℃)中进行游泳,水槽深度为50 cm,长度60 cm,宽度50 cm,水槽中无障碍物。记录大鼠开始游泳到沉底溺亡的时间,此时间即为游泳力竭时间。
2.5 大鼠生存能力试验
48只昆明种大鼠随机分为4组,每组12只大鼠。
2.5.1 大鼠抗缺氧试验
连续给药7周后,每组取6只大鼠,让每只大鼠在2 L的密封性容器中,记录大鼠窒息死亡时间[17]。
2.5.2 大鼠抗饥饿试验
连续给药7周后,每组取6只大鼠,正常饮水,禁止进食,观察开始绝食开至大鼠因饥饿而死的时间。
2.6 数据分析
采用SPSS 17.0统计软件进行数据分析。
3 结果与分析
3.1 紫外-可见分光分析
由图1可得,华中乌蔹莓乙醇提取物在280 nm处有最大紫外吸收。
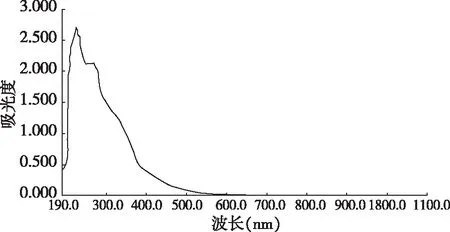
图1 华中乌蔹莓乙醇提取物紫外-可见光图谱Fig. 1 UV-vis spectrum of ethanol extract from C. oligocarpa
3.2 成分分析
3.2.1 HPLC检测
华中乌蔹莓黄酮粗提物由高效液相色谱(High performance liquid chromatography,HPLC)分离后,如图2所示,检测出华中乌蔹莓乙醇提取物成分主要有3种,出峰时间分别为8.34、14.64、19.14 min,由出峰时间以及和标准品相比对,初步判定三种成分为绿原酸、芦丁和槲皮素[18]。
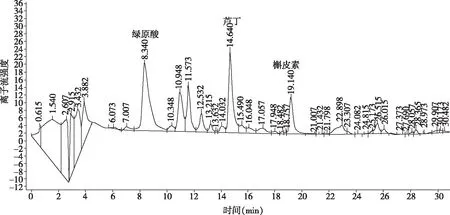
图2 华中乌蔹莓乙醇提取物HPLC检测Fig.2 Determination of ethanol extract in crude extracts by HPLC
3.2.2 质谱分析
由图3可知,出峰时间为8.34 min的物质,其负离子量为353.1,正离子量为355.2。负离子图中产生的两个主要碎片质量为191.2和135.1,正离子图中产生的两个主要碎片质量为163.2和151.1。通过其碎片质量和正负离子量及绿原酸相对分子质量,确定为绿原酸。
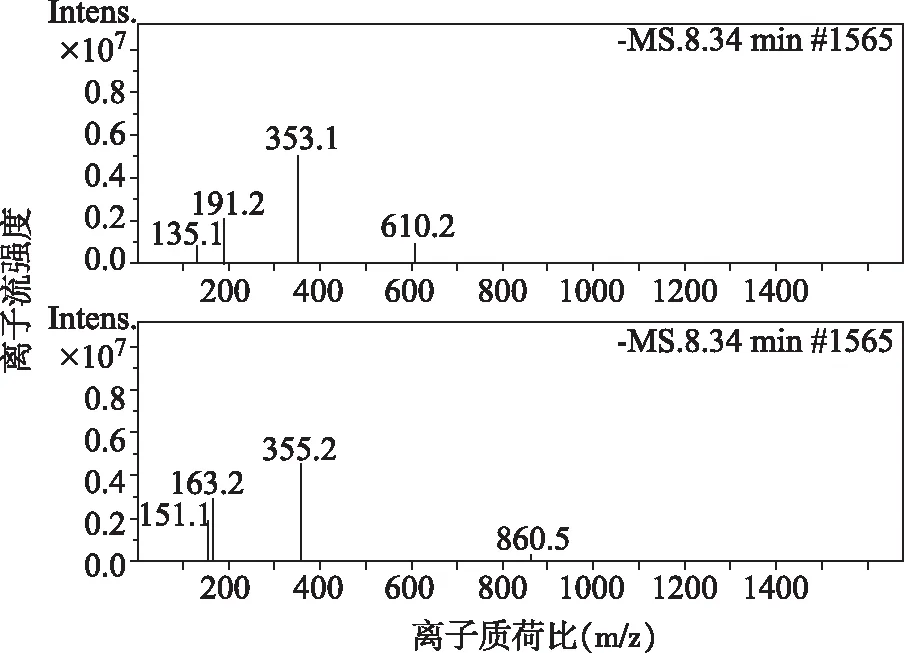
图3 绿原酸质谱图Fig.3 Mass spectrum of the chlorogenic acid
由图4可知,出峰时间为14.64 min的物质,负离子量为609.1,正离子量为611.2。负离子图中产生的两个主要碎片质量为301.1和273.1,正离子图中产生的主要碎片质量为465.2。通过其碎片质量和正负离子量及芦丁相对分子质量,确定为芦丁。
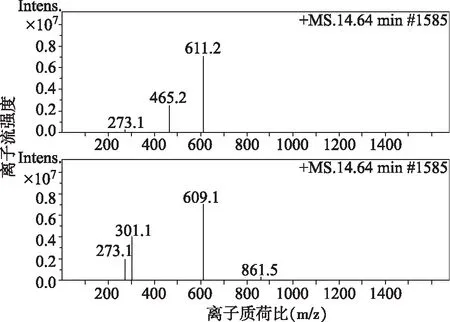
图4 芦丁质谱图Fig.4 Mass spectra of rutin
由图5可知,出峰时间为19.14 min的物质,负离子量为301.2,正离子量为303.2。负离子图中产生的两个主要碎片质量为273.2和257.3,正离子图中产生的主要碎片质量为275.1和257.1。通过其碎片质量和正负离子量及槲皮素相对分子质量,确定为槲皮素。

图5 槲皮素质谱图Fig.5 Mass spectrum of quercetin
3.3 含药血清对DPPH清除率
图6为不同灌胃剂量大鼠血清对DPPH的清除率,在给药剂量0~150 mg/kg范围内,随着剂量的加大。大鼠血清对DPPH自由基的清除作用逐渐增加,剂量达到150 mg/kg后,随着剂量的加大清除率呈现递减趋势。推测导致这一现象的原因为剂量过大对大鼠造成一定的毒害作用使其对黄酮的吸收能力减低;在剂量低于50 mg/kg范围内随着剂量的增加,大鼠血清对DPPH的清除率显著增加(P<0.05),剂量达到50 mg/kg后清除率增加不明显,并在剂量150 mg/kg达到最大清除率。
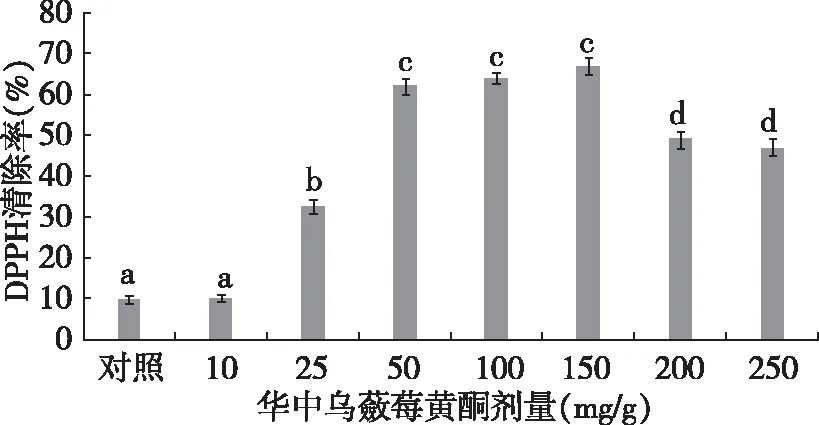
图6 剂量对DPPH清除率的影响Fig.6 The impacts of different gavage dose on DPPH scavenging rate注:不同小写字母代表在p<0.05水平有显著性差异,下同。
3.4 华中乌蔹莓醇提物对大鼠血清中SOD活性影响
表2为不同给药剂量大鼠血清中的SOD活性,通过7周的给药处理后,阳性对照(50 mg/kg VC处理)和华中乌蔹莓醇提物提高了大鼠血液中SOD活性;在给药剂量范围内,随着剂量的加大大鼠血液中SOD活性逐渐增加,呈现出递增趋势,给药剂量低、中、高三个浓度范围内高浓度(200 mg/kg)SOD活性最高,且和其它组达到显著性差异(P<0.05),说明华中乌蔹莓醇提物能显著提高大鼠血液中SOD活性。
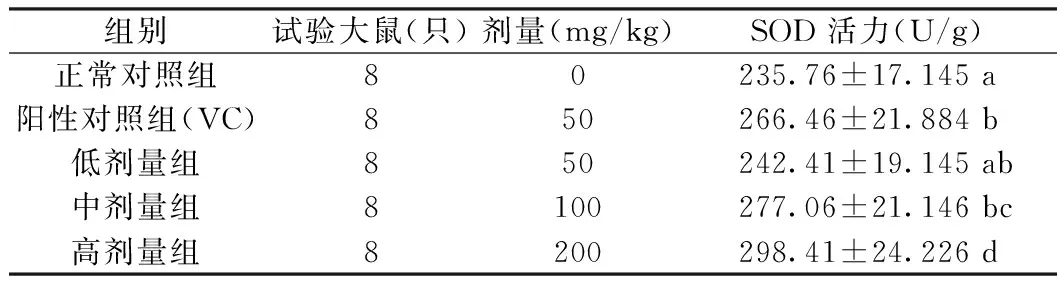
表2 大鼠血清中SOD活性Table 2 Activities of SOD in serum of rats
3.5 华中乌蔹莓醇提物对大鼠血液中MDA含量影响
表3为不同给药剂量大鼠血清中MAD含量,通过7周的给药处理后,阳性对照(50 mg/kg VC处理)和华中乌蔹莓醇提物显著降低了大鼠血液中的MDA值(P<0.05);在给药剂量范围内,随着剂量的加大大鼠血液中MDA值逐渐降低,并呈现出良好的线性,给药剂量低、中、高三个浓度范围内高浓度(200 mg/kg)MDA值最低,说明华中乌蔹莓醇提物能显著降低大鼠血液中的MDA。
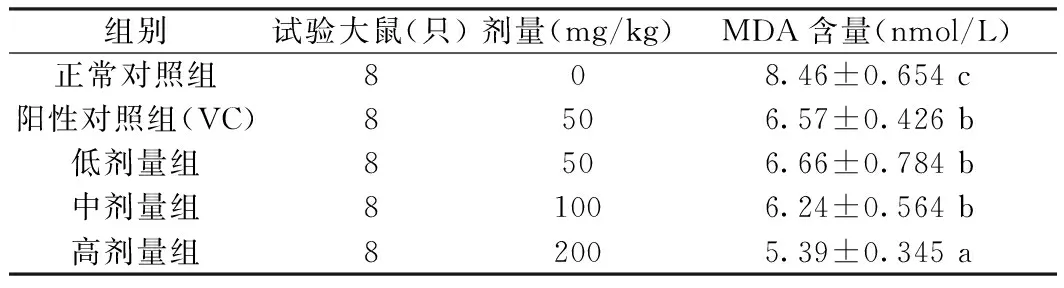
表3 大鼠血清中MDA含量Table 3 Contents of MDA in serum of rats
3.6 华中乌蔹莓醇提物对大鼠体重的影响
表4为大鼠体重,在7周的给药处理中,华中乌蔹莓醇提物低剂量组和正常对照组各个时期体重基本一样,有细微偏差;中剂量和高剂量组在试验中期(中剂量组第4周开始,高剂量组第3周开始)大鼠在体重上略高于正常对照组,但效果不显著(P<0.05),说明华中乌蔹莓醇提物对大鼠体重有一定的增加效果,但效果不明显。
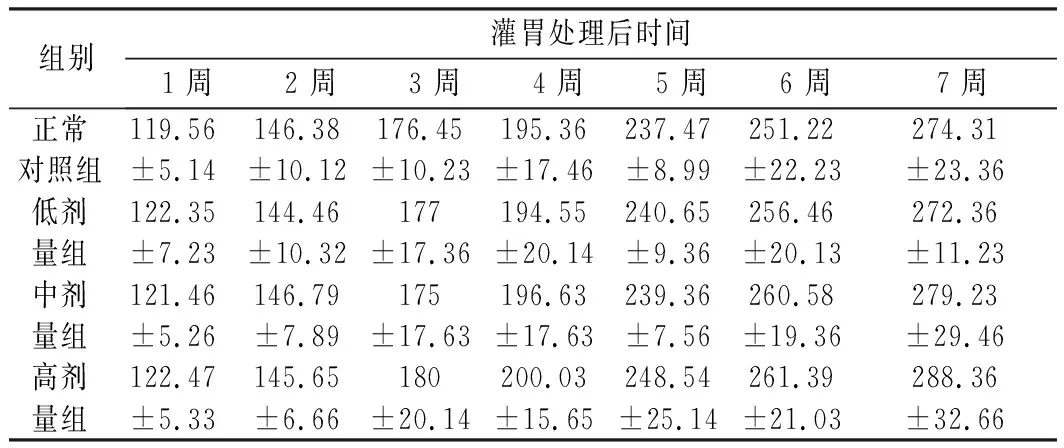
表4 大鼠体重Table 4 Rat weights
3.7 华中乌蔹莓醇提物对大鼠游泳时间的影响
由表5可得,在给药处理7周后,给药低剂量组和中剂量组均能提高大鼠游泳时间,且中剂量组和其它组对比达到显著水平(P<0.05);高剂量组降低大鼠游泳时间,且和对照达到显著水平(P<0.05),可能是:大鼠在高剂量给药处理7周后,体重增加造成游泳时间降低,或者是高剂量华中乌蔹莓醇提物长期处理对大鼠造成一定的生理毒害,造成体力有所下降[19]。

表5 华中乌蔹莓醇提物对大鼠游泳时间Table 5 Rat swimming time
3.8 华中乌蔹莓醇提物对大鼠抗窒息时间的影响
表6为不同给药剂量大鼠窒息死亡时间,在给药处理7周后,华中乌蔹莓醇提物三个剂量组均能提高大鼠在密封环境中的存活时间,且中剂量组效果最好,但和对照没有显著性差异。

表6 华中乌蔹莓醇提物对大鼠窒息死亡时间Table 6 Death time of rat asphyxia
3.9 华中乌蔹莓醇提物对大鼠饥饿时间的影响
由表7可得,在给药处理7周后,华中乌蔹莓醇提物低剂量组合、中剂量组合和对照存活时间基本一致,中剂量组存活时间最长,高剂量处理组明显低于对照。华中乌蔹莓黄酮处理大鼠后对其抗饥饿时间有一定影响,主要表现为中剂量延长饥饿致死时间,但效果不显著,高剂量明显缩短饥饿致死时间。分析原因为,高剂量组对大鼠有一定的毒害作用,或者高剂量组大鼠体重较大导致耗能较快以至于抗饥饿能力差。

表7 华中乌蔹莓醇提物处理后大鼠抗饥饿时间Table 7 Starvation leads to death
4 结论与讨论
经液相色谱和质谱分析,华中乌蔹苺醇提物主要成分为芦丁、绿原酸、和槲皮素。从试验结果来看,灌服华中乌蔹莓醇提物能显著增强小鼠的抗氧化能力,给药剂量低于150 mg/kg范围时,药量与药效呈现正相关趋势,随着剂量的增加,抗氧化效果越强,但达到150 mg/kg后,随着剂量增加药效反而下降,试验说明短时间连续服用华中乌蔹莓黄酮时应注意剂量低于150 mg/kg。在试验范围内,华中乌蔹莓醇提物随着剂量的增加对大鼠血液中SOD活性呈现出递增的趋势,在中、高剂量组中SOD活性高于阳性对照VC;随着给药剂量的加大,大鼠血液中MDA值逐渐降低,并呈现出良好的线性关系,在中、高剂量组中MDA值低于阳性对照VC。试验说明在长期给药试验中,华中乌蔹莓醇提物对大鼠有很好的抗氧化效果[20]。在试验范围内,低剂量和中剂量的华中乌蔹莓醇提物对大鼠的抗疲劳有增效作用,中剂量组达到显著水平;高剂量组对其抗疲劳效果以及抗饥饿能力有显著性下降作用,目前分析为高剂量组体重增加造成游泳能力和抗饥饿能力下降或长时间高剂量给药造成一定的毒害作用[19-21]。
