一线和二线免疫治疗对非小细胞肺癌患者外周血免疫抑制细胞的影响
2021-07-03冯九星陈淑靖郑添琪李双琦李佳旻蒋进军
冯九星, 陈淑靖, 郑添琪, 李双琦, 李佳旻, 蒋进军*
1. 复旦大学附属中山医院呼吸与危重症医学科,上海 200032 2. 复旦大学生物医学研究院,医学表观遗传与代谢重点实验室,上海 200032
肺癌是最为常见的恶性肿瘤之一,非小细胞肺癌(non-small cell lung cancer,NSCLC)约占肺癌的80%[1]。尽管治疗方法不断出现,但是以NSCLC为主的肺癌仍是主要的致死癌种[2]。临床上,化疗和放疗被认为是无靶向基因突变NSCLC的主要治疗方案[3-4]。
近年来,免疫检查点抑制剂,如PD-1抑制剂,已经被国内外批准用于多种癌症的治疗,包括晚期NSCLC患者,但是获益人群比例仍不高[5]。晚期NSCLC患者通常已经历多周期的化疗和放疗疗法,且大部分患者出现不同程度的转移[6]。而进一步恶化的病情可能导致假阴性免疫治疗不应答,从而影响免疫治疗疗效。
肿瘤免疫微环境(tumor immune microenvironment, TIME)中的免疫抑制细胞包括髓系来源抑制性细胞(myeloid-derived suppressor cells, MDSCs)、肿瘤相关性巨噬细胞和调节性T细胞(regulatory T cells,Tregs)[7]。MDSCs一般分为单核细胞-髓系来源抑制性细胞(monocytic myeloid-derived suppressor cells,M-MDSCs)和粒细胞-髓系来源抑制性细胞(granulocytic myeloid-derived suppressor cells,G-MDSCs)。目前一线或二线免疫治疗对这些免疫抑制细胞产生的影响尚不清楚。因此,为探讨一线和二线免疫治疗对机体内TIME的影响,本研究检测一线和二线免疫治疗患者PD-1抑制剂第1次治疗前后外周血中上述3种主要免疫抑制细胞的变化,为其临床应用提供参考。
1 资料与方法
1.1 研究对象 选择2018年1月至2019年10月复旦大学附属中山医院收治的NSCLC患者27例,在PD-1抑制剂治疗前后采集患者外周血。根据患者接受PD-1抑制剂治疗前是否曾接受化疗,分为PD-1抑制剂一线免疫治疗组(一线组,n=7)和PD-1抑制剂二线免疫治疗组(二线组,n=20)。纳入标准:(1)年龄>18岁;(2)无靶向基因突变;(3)NSCLC晚期。本研究获得复旦大学附属中山医院伦理委员会批准(B2019-204R),所有患者均签署知情同意书。
1.2 治疗方案 一线组和二线组在接受PD-1抑制剂治疗阶段均使用帕博利珠单抗,化疗频率和剂量均为3周/次,每次200 mg。本研究细胞数量数据均为患者完成第1次PD-1抑制剂治疗后的检测结果。
1.3 随访方案 随访期即患者使用PD-1抑制剂治疗期,平均随访时间为16.9(3.6~38.9)周。随访方式为每次来院进行注射PD-1抑制剂,治疗前后均采集外周血留待分析,并使用计算机化X线体层照相术(CT)记录肿瘤体积变化情况。患者采用PD-1治疗2个周期后,若符合临床评估标准后,便后续只观察细胞免疫的变化。本研究主要终点事件为随访终止,次要终点事件为患者选择停止用药。
1.4 肿瘤大小测量及临床效果评估标准 PD-1抑制剂治疗前后,采用CT记录肿瘤体积变化情况。根据RECIST v1.1指导准则[8],将患者分为部分缓解(partial response,PR)、疾病稳定(stable disease,SD)、疾病进展(progressive disease,PD)。PR: 靶病灶最大径之和减少≥30%,至少维持4周。SD:靶病灶最大径之和缩小未达PR,或增大未达PD。PD: 靶病灶最大径之和至少增加≥20%或出现新病灶。
1.5 外周血流式分析 分别取100 μL新鲜外周血液于1.5 mL的EP管中,每管加入1 μL Fc阻断剂,4℃封闭10 min,加入目的Marker染色组合,M-MDSCs: CD33+CD11B+HLA-DR-CD15-CD14+、G-MDSCs:CD33+CD11B+CD14-CD15+、Tregs: CD4+CD25+CD127-。加入抗体后,轻轻涡旋混匀,4℃条件下闭光染色30 min。每管中加入1 mL的红细胞裂解液,闭光裂解4 min。4℃,350×g离心5 min,吸去上清液,加入1 mL预冷的PBS清洗,4℃,350×g离心5 min,重复清洗1次。加入350 μL预冷的含有1%多聚甲醛的PBS重悬细胞,将重悬液转移到流式管中。采用BD Fortessa进行目标细胞群的检测,并用Flow Jo软件进行数据分析。

2 结 果
2.1 临床效果评价 27例NSCLC患者中,接受一线免疫治疗7例(25.9%),接受二线免疫治疗20例(74.1%)。一线组中,PR比例为57.1%(4/7),SD比例为28.6%(2/7),PD比例为14.3%(1/7)。二线组中,PR比例为15%(3/20),SD比例为55%(11/20),PD比例为30%(6/20)。7例(25.9%)PD患者由于疾病进展而停止使用PD-1抑制剂治疗。
2.2 治疗前免疫抑制细胞水平 流式细胞分析结果(图1)显示:治疗前,一线组和二线组外周血中M-MDSCs、G-MDSCs和Tregs水平差异无统计学意义(P=0.87、0.12、0.56)。
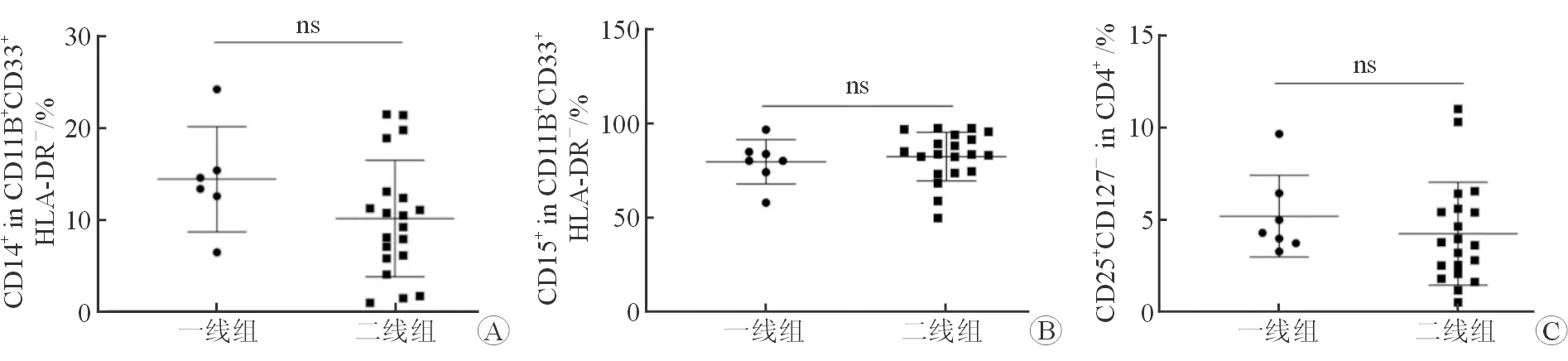
图1 免疫治疗前2组间M-MDSCs、G-MDSCs和Tregs水平差异
2.3 治疗前后外周血中M-MDSCs水平变化 流式细胞分析结果(图2)显示:与治疗前相比,治疗后一线组M-MDSCs在外周血中的水平下降(P<0.05)。与治疗前相比,二线组在治疗后M-MDSCs水平差异无统计学意义。
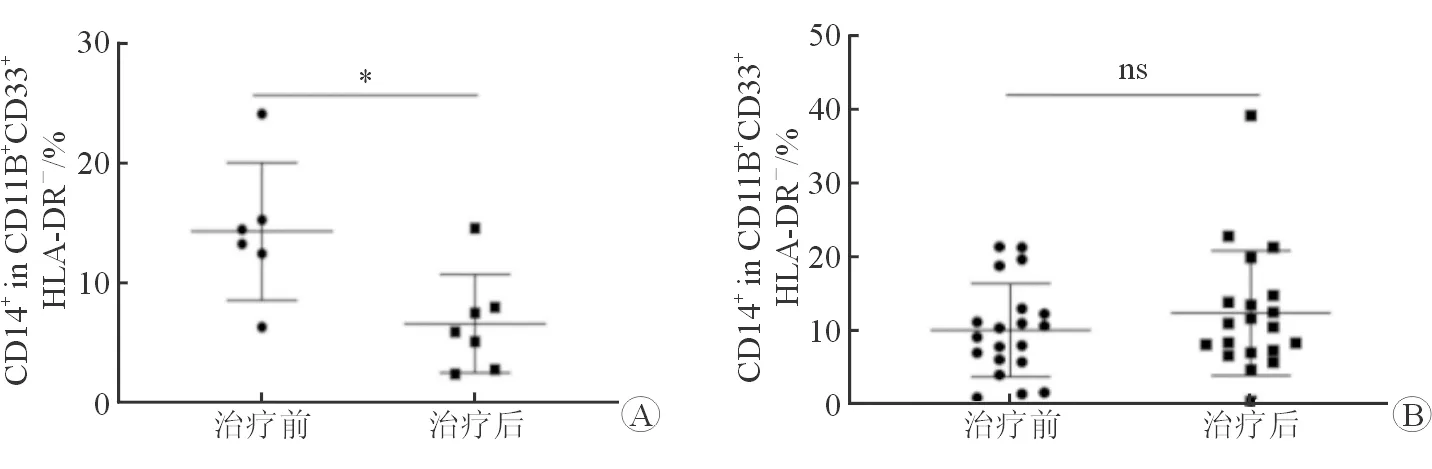
图2 2组患者免疫治疗前后外周血M-MDSCs水平变化
2.4 治疗前后外周血中G-MDSCs水平变化 结果(图3)显示:治疗前后,一线组和二线组患者G-MDSCs差异均无统计学意义。
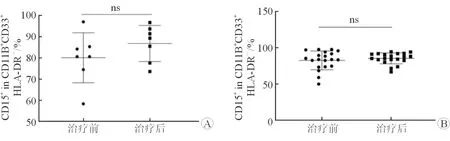
图3 免疫治疗前后2组外周血中G-MDSCs水平变化
2.5 治疗前后外周血中Tregs水平变化 结果(图4)显示:与治疗前相比,治疗后Tregs在一线组和二线组中均显著上升(P<0.05,P<0.01)。

图4 免疫治疗前后2组外周血Tregs水平变化
2.6 治疗后外周血免疫抑制细胞水平 结果(图5)显示:第1次免疫治疗后,二线组比一线组外周血中M-MDSCs细胞群水平更高(P<0.05)。G-MDSCs和Tregs在2组间差异无统计学意义(P=0.71、0.47)。

图5 免疫治疗后2组外周血M-MDSCs、G-MDSCs和Tregs水平比较
2.7 相关性分析 结果(图6)显示:Tregs变化量和疗效不相关(P=0.19),M-MDSCs比例下降值和疗效相关(r=-0.04,P=0.001 3),即变化值为负数且其绝对值越大,疗效越好(疗效等级为2)。
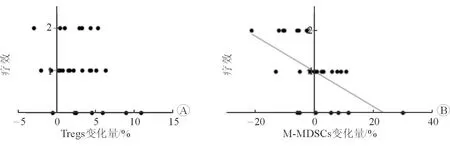
图6 Tregs和M-MDSCs治疗前后比例变化值和疗效的相关性分析
3 讨 论
本研究通过招募NSCLC患者初步探究一线免疫治疗和二线免疫治疗在肿瘤控制过程中效果的差异,并分析了2组患者在接受PD-1抑制剂治疗后外周血M-MDSCs、G-MDSCs和Tregs水平的变化。本研究初步证实,晚期基因突变阴性NSCLC患者接受一线免疫治疗较二线免疫治疗具有更好的临床疗效,而且第1次免疫治疗后,一线免疫治疗组有更低水平的M-MDSCs,预示着在前者中更低的由M-MDSCs造成的免疫抑制活性,但是G-MDSCs没有相应变化。相比之下,Tregs水平在2组中均显著上升,但二线PD-1抑制剂治疗组中上升的趋势更加明显。外周血M-MDSCs显著下降与疗效相关;Tregs显著增加,但与疗效无关。
TIME中主要的免疫细胞成分是MDSCs,这是一类起源于肿瘤患者骨髓,移行到外周血和肿瘤组织中的不成熟的髓系细胞。MDSCs可通过一氧化氮代谢通路和增加PD-L1的表达等机制抑制T细胞和自然杀伤细胞的抗肿瘤活性,MDSCs活性的维持不但与肿瘤生长相关,也与肿瘤转移相关[9]。作为TIME中重要的免疫抑制细胞,Tregs细胞与肿瘤的发生和进展密切相关,是免疫治疗有效的主要因素之一,当患者外周血中Tregs数量减少或者消失时,肿瘤也就容易被控制[10]。黑素瘤的研究[11]表明,使用PD-1抑制剂治疗有效的患者外周血中Tregs细胞的数量和肿瘤抑制活性明显降低。外周血中MDSCs比肿瘤组织中MDSCs的变化更能反映PD-1抑制剂的疗效,因此只检测外周血中免疫抑制细胞也具有参考意义[9]。
本研究表明,一线免疫治疗的效果明显优于二线免疫治疗,与KEYNOTE-001研究[12]的5年随访结果一致。本研究通过流式细胞仪分析探究了一线和二线免疫治疗后3种肿瘤免疫细胞的变化情况。本课题组在前期研究[13]中发现,NSCLC患者外周血中M-MDSCs的下降能显著增强PD-1抑制剂治疗的效果。在确定M-MDSCs、G-MDSCs和Tregs的基线水平在3组中差异无统计学意义的条件下,发现一线组中M-MDSCs在第1次免疫治疗后显著下降,而二线免疫治疗组没有明显变化。更重要的是,第1次免疫治疗后,一线组的M-MDSCs水平较二线组更低,预示着在前者中更低的M-MDSCs导致的低免疫抑制活性及更好的抗癌疗效。
同时,G-MDSCs在一线和二线组中差异无统计学意义。与M-MDSCs仅在一线组有变化相比,Tregs的水平在2组中均显著上升,且二线组中上升趋势更加明显。在患者体内,PD-1抑制剂往往会引起机体的免疫增强,此时免疫系统为了保护正常细胞免于过度免疫的影响,往往会增强微环境中的免疫抑制活性。根据临床效果和Tregs的相应变化情况,推测在PD-1抑制剂使用后外周血中上调的Tregs水平可能是机体对于免疫增强后启动免疫平衡保护机体免受过度免疫的伤害[12]。另一方面,在二线组中更高水平的Tregs细胞抑制了PD-1抑制剂的肿瘤免疫治疗效果。因此,M-MDSCs和Tregs变化引起的免疫微环境的免疫抑制活性的动态变化可能有效增强或限制PD-1抑制剂的免疫治疗效果。本研究表明,一线和二线免疫治疗引起的肿瘤免疫细胞的变化不同。一线免疫治疗的临床疗效更好可能与TIME不同相关,其中TIME的主要免疫抑制细胞M-MDSCs降低和Tregs轻微升高可能是具体机制。这也说明,对于NSCLC,一线免疫治疗可能比二线免疫治疗获益更多。当然这需要更进一步的基础研究验证。
本研究存在一定的局限性:(1)患者群体仅有27例,样本量偏小,而且分到各组中的人数也较少。(2)检测患者外周血中3种细胞的变化,而未检测肿瘤组织中的比例差异,也未检测外周血中肿瘤相关性巨噬细胞。
综上所述,晚期NSCLC患者接受一线免疫治疗较二线免疫治疗具有更好的临床疗效, 一线免疫治疗组外周血M-MDSCs显著下降与疗效相关;G-MDSCs无变化,但二线免疫治疗组Tregs显著增加,但与疗效无关。
