不同基因型及培养基在燕麦花药组织培养中的应用
2021-07-01田娟张曼孙墨可董玉迪王春龙郭来春魏黎明任长忠
田娟 张曼 孙墨可 董玉迪 王春龙 郭来春 魏黎明 任长忠
摘要:以JA3、M44、19A647燕麦资源为试验材料,采用花药离体培养方法,将3种材料的花药接种于C17、W14培养基上,研究3种基因型在2种培养基上反应率、出愈率、转移率和再生率的差异,以期筛选出适合燕麦花药培养的基因型和诱导培养基。结果表明,在3个基因型中,JA3的反应率、出愈率、转移率都是最高的,分别达到36.29%、2695%、86.93%,只有JA3获得了再生植株,其绿苗率为0.10%,可见JA3适合用于花药组织培养,可以作为燕麦花药培养的桥梁材料;C17培养基中的愈伤组织比较紧凑,质量较好,W14培养基中的愈伤组织不易聚集长大,质量较差,从W14培養基中共获得6株白化苗,从C17培养基中获得2株白化苗、2株绿苗。由研究结果可以看出,燕麦花药愈伤组织诱导和再分化在基因型之间的差异显著,JA3适合作为燕麦花药培养的桥梁品种,相较于W14培养基,C17为燕麦花药培养的最佳培养基。
关键词:燕麦;基因型;培养基;花药组织培养;愈伤组织
中图分类号: S339.4+1;S512.604.3 文献标志码: A 文章编号:1002-1302(2021)09-0049-04
燕麦(Avena sativa L.)是禾本科燕麦属一年生草本植物,是世界上主要的粮食作物之一[1],它抗旱[2]、耐寒[3]、耐盐碱[4-5]。燕麦蛋白的氨基酸种类齐全,配比合理[6],具有极高的营养、饲用价值和保健功效[7]。燕麦新品种主要采用引进选育、系统育种、品种间杂交等方式育成[8]。花药培养育种是将花粉培育成单倍体植株,再经染色体自然或人工加倍得到纯合二倍体的一种育种方法,这种由染色体加倍产生的纯合二倍体,在遗传上非常稳定,不发生性状分离,因此,花培育种能够缩短育种年限[9]。但是在实际育种中,燕麦花培育种方法应用得很少,主要是因为花药组织培养的诱导率不高。诱导率不高的原因,主要是材料的基因型、培养基的种类和成分、预处理和培养条件等因素在不同程度上制约了燕麦花药培养的效果[10]。由于燕麦选育受资源与技术的双重制约,使得燕麦育种效率低下,品种更新换代较慢,产业化发展滞后[11]。为了解决我国燕麦育种面临的育种技术单一、方法陈旧、周期长、优良品种少等问题,攻克燕麦花药单倍体育种技术屏障势在必行。关于燕麦花药组织培养的报道已经有很多[12-24],本试验选用JA3、M44、19A647燕麦品种(系)作为试验材料,比较C17、W14这2种诱导培养基在燕麦花药培养过程中的反应率、出愈率、转移率和再生率差异,以期筛选出适合燕麦花药培养的基因型和诱导培养基,为提高燕麦花药培养育种效率提供理论依据。
1 材料与方法
1.1 试验材料
以编号为JA3、M44、19A647的燕麦品种(系)作为试验对象,于2019年4月1日播种于吉林省白城市农业科学院内。在孕穗期采集幼穗后置于4 ℃冰箱中进行暗、冷处理7 d后取出,用75%乙醇消毒,选取小孢子为单核中晚期的小穗(小孢子时期通过醋酸杨红染色镜检来确定),剥离出花药放在直径为3.5 cm的培养皿中,每个培养皿中放置30个花药,于32 ℃处理5 d后转移到28 ℃条件下进行暗培养。
1.2 愈伤组织的诱导
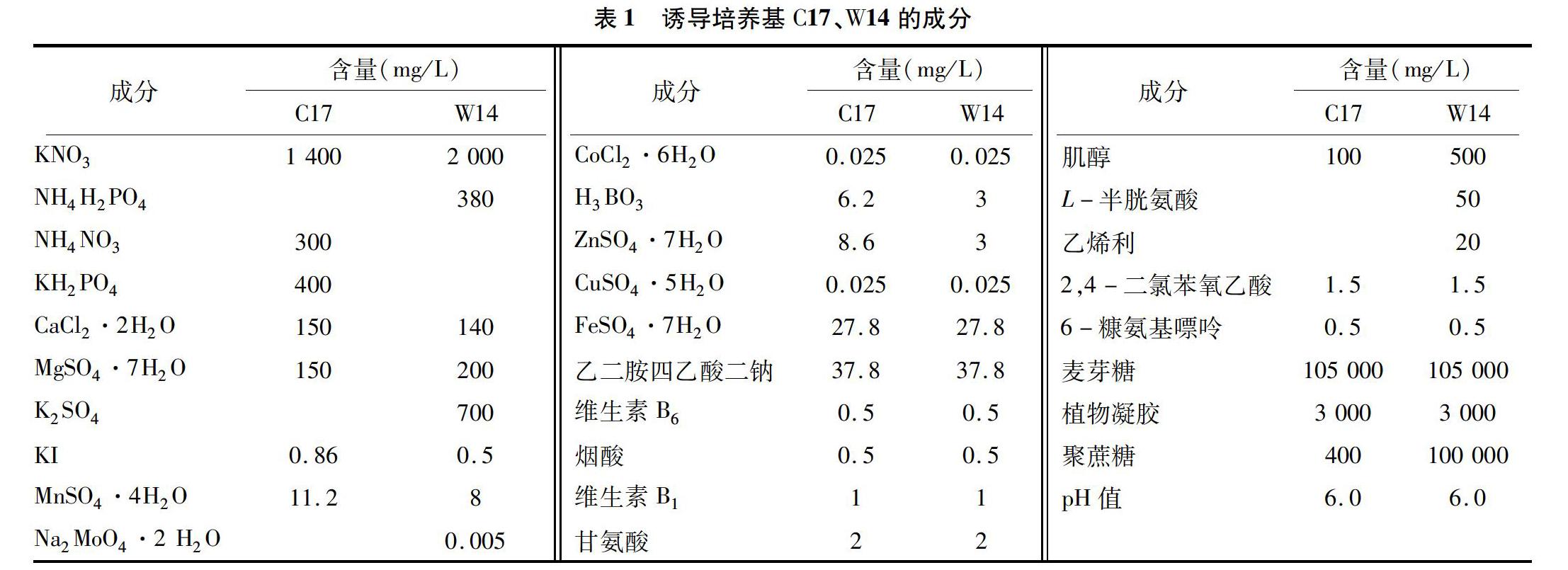
脱分化使用C17、W14这2种培养基,其中C17为固体培养基,W14为固液双层培养基。W14上层是液体培养基,加入100 g/L聚蔗糖400、105 g/L麦芽糖等,培养基的具体成分见表1。
1.3 分化和生根培养
将诱导的愈伤组织转移到再生培养基上,再生培养基是固体W14,另加2%蔗糖、0.3%植物凝胶,定容后调节pH值为6.0,于121 ℃灭菌20 min。将植物激素2 mg/L NAA、0.5 mg/L KT过滤消毒后加入再生培养基中。再生温度设为22 ℃,采用16 h/d弱光光照。生根采用MS培养基[21],辅以0.2 mg/L NAA、2%蔗糖和0.3%植物凝胶。生根温度为 25 ℃,光照时间为16 h/d。
1.4 数据统计与分析
使用WPS 2019软件对试验数据进行整理和统计分析,用IBM SPSS Statistics 19.0软件进行单因素方差分析。
反应时间指从花药接种到培养基中至花药表面出现小泡的时间,出愈时间指从花药接种到培养基中至出现愈伤组织的时间,其他计算公式如下:
反应率=反应的花药数/接种的花药数×100%;
出愈率=出现愈伤组织的花药数/接种的花药数×100%;
转移率=能够转移的愈伤数/出现愈伤组织的花药数×100%;
绿苗率=出现的绿苗数/接种的花药数×100%;
白化苗率=出现的白化苗数/接种的花药数×100%。
2 结果与分析
2.1 基因型对燕麦花药愈伤组织诱导和再分化的影响
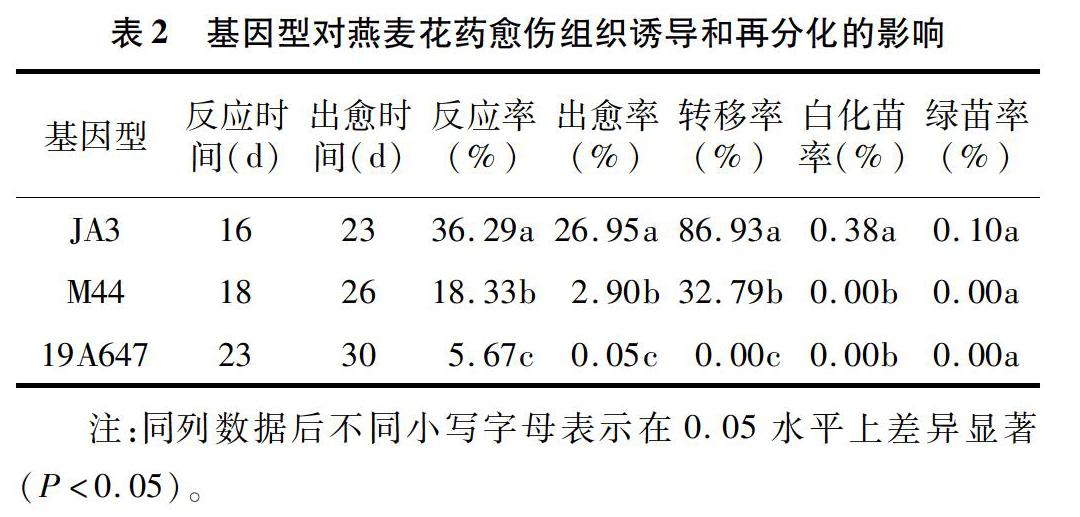
以JA3、M44、19A647燕麦品种(系)为材料,研究不同基因型对燕麦花药愈伤组织诱导和再分化的影响。由表2可以看出,不同基因型燕麦的反应时间和出愈时间有所不同,但是3种基因型燕麦从反应到出愈约用1周时间,出愈时间为23~30 d不等。在相同培养条件下,燕麦花药愈伤组织诱导和再分化在不同基因型之间的差异显著。在供试的3个材料中,JA3的反应率、出愈率均最高,分别能达到36.29%、26.95%,而且JA3的转移率能达到8693%,说明其愈伤组织活力较高,增殖速度快。在3个燕麦基因型中,只有JA3获得了再生植株,其绿苗率为0.10%。以上结果说明,JA3适合用于花药组织培养,可以作为燕麦花药培养的桥梁材料。19A647的反应率、出愈率都较低,没有能够转移的愈伤组织,说明19A647不适合用于花药培养。
2.2 培养基对燕麦花药愈伤组织诱导和再分化的影响
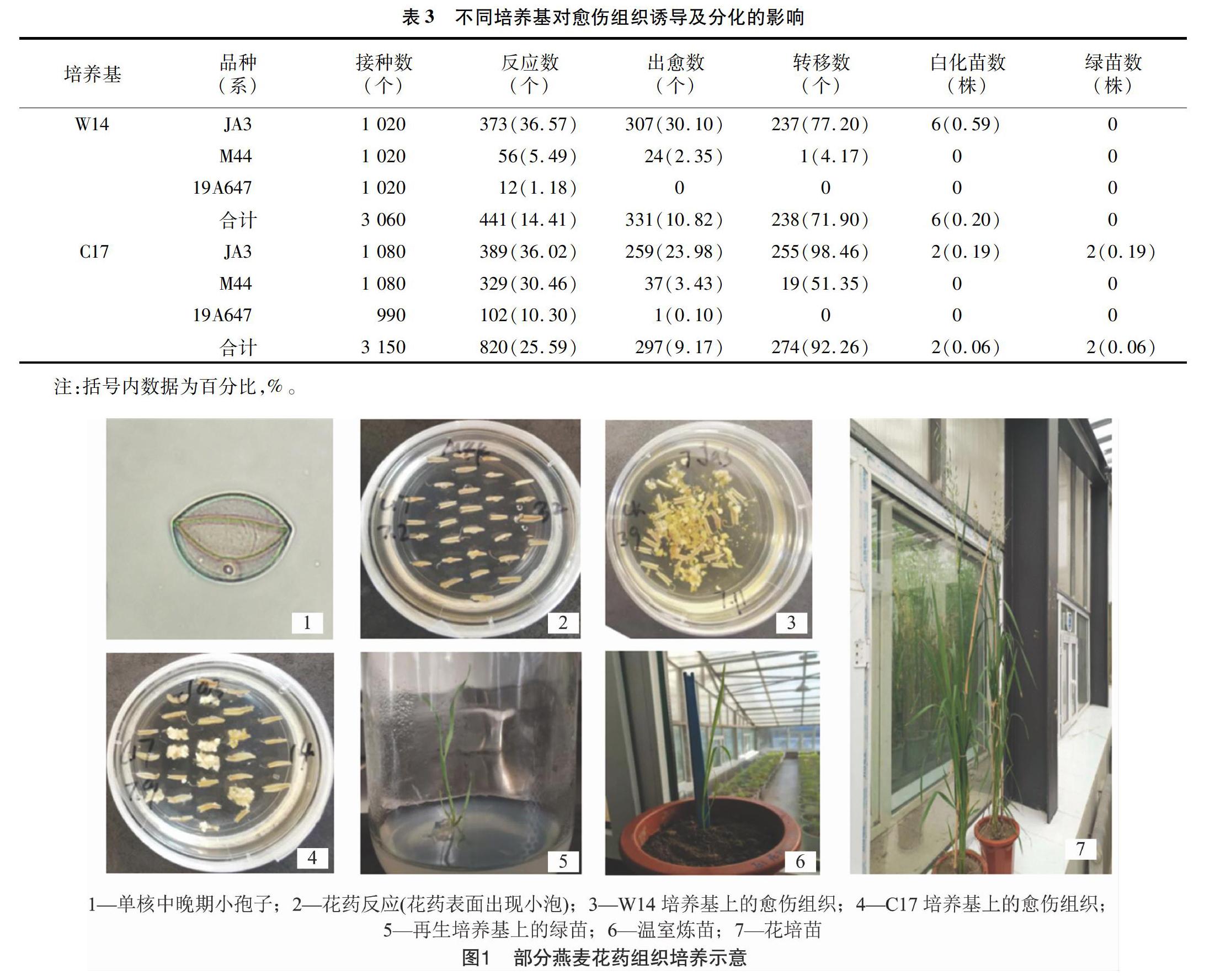
由表3可以看出,C17培养基中的花药反应数较W14培养基高,并且每个基因型中反应数均超过10%。在出愈数方面,虽然W14培养基比C17培养基高,但是在转移数方面,W14培养基不如C17培养基。由图1可以看出,W14培养基出现的愈伤组织比较分散,不能达到转移所需的大小。而C17培养基中的愈伤组织比较紧凑,容易长大,质量比较好。从W14培养基中获得了6株白化苗,从C17培养基中获得了2株白化苗和2株绿苗,且每100个花药的绿苗数达到0.06株。综合愈伤组织质量和获得的绿苗数,在本研究选用JA3、M44、19A647这3个燕麦材料进行花药组织培养的过程中,C17培养基优于W14培养基。
2.3 诱导培养基C17、W14成分的比较
培养基各成分的配比与优化直接影响了燕麦花药培养的出愈率。从表1可以看出,在C17、W14的培养基成分中,铁盐、有机成分、植物激素等含量完全相同。C17、W14中大量元素的种类不同,C17中的大量元素由KNO3、NH4NO3、KH2PO4、CaCl2·2H2O、MgSO4·7H2O提供,W14中的大量元素由KNO3、NH4H2PO4、CaCl2·2H2O、MgSO4·7H2O、K2SO4提供,相较于C17,W14中的微量元素(由KI、MnSO4·4H2O、H3BO3、ZnSO4·7H2O等化合物提供)含量都有不同程度的减少。C17是固体培养基,碳源只来自蔗糖,W14是固液双层培养基,碳源来自蔗糖、麦芽糖,W14培养基中增加了L-半胱氨酸、乙烯利等。
3 讨论与结论
3.1 基因型
诱导花粉形成愈伤组织是诱导花粉植株的第一步,在同样的培养条件下,不同品种或杂种燕麦花药产生花粉愈伤组织的频率差异极大,有的高达48.5%,但有的则不产生花粉愈伤组织[22]。这种差异显然是由花药与花粉内部的因素引起的,供体植株的基因型是影响花药、花粉培养的关键因素,不同基因型的植株对培养的反应不同。本试验结果表明,在相同培养条件下,燕麦花药愈伤组织诱导和再分化在基因型之间的差异显著,主要表现为出现愈伤组织的时间不同以及出愈率、绿苗分化率和白化苗分化率不同等方面。本研究结果与Kiviharju等的相关研究结果[23-25]一致。本研究所选的JA3燕麦在W14培养基上的出愈率达到30.10%,适合作为燕麦花药培养的桥梁品种。
3.2 培养基
培养基的组成在胚胎发生中起着主要作用。燕麦花药培养效率的提高,在某些程度上依赖于培养基成分、激素配比等。C17、W14培养基是广泛用于燕麦花药培养的2种培养基[13,26-29],这2种培养基的成分与激素含量存在一定差异。本研究对比了2种培养基誘导愈伤组织和绿苗分化的能力,并综合愈伤组织的质量、获得的绿苗数得出,C17为最佳培养基,与Ponitka等的研究结果[30]一致,但是与Warchol等的研究结果[31]不一致。
本试验中培养基差异很大,大量元素来源不同,微量元素含量不同,并且与C17相比,W14中添加了L-半胱氨酸、乙烯利等激素,分为固液2层,在液体层中加入了麦芽糖而不是蔗糖。这些成分的改变并没有提高燕麦花药愈伤组织的诱导率和质量,但是可以看出,双层培养基的优点是花药在培养早期可以从活性高的液体培养基中汲取营养,从而提高花粉反应率,但是并没有提高愈伤组织诱导率,而且由于花药直接放在液体培养基上,出现的愈伤组织在培养基上来回游动,不能聚集长大,反而降低了愈伤组织质量。由于本研究的培养基差异很大,究竟是大量元素、微量元素、糖源还是 L-半胱氨酸和乙烯利等激素对愈伤组织的影响,还有待进一步探讨。
本试验从多种角度发现,在相同培养条件下,不同基因型植株的再生情况差异明显。这种差异在很大程度上由基因型自身的再生能力决定,优化再生体系仅能在一定程度上提高某些基因型的培养力,但并不能从根本上改变这种差距。对于不同培养基而言,相同基因型植株的出愈率差别不大。
参考文献:
[1]郑殿升.中国燕麦的多样性[J]. 植物遗传资源学报,2010,11(3):249-252.
[2]李 威. PEG胁迫下6种裸燕麦品种种子萌发期的抗旱性研究[J]. 种子,2014,33(5):38-41.
[3]柏晓玲,周青平,陈有军,等. 燕麦幼苗对低温胁迫的响应[J]. 草业科学,2016,33(7):1375-1382.
[4]姜 瑛,周 萌,吴 越,等. 不同燕麦品种耐盐性差异及其生理机制[J]. 草业科学,2018,35(12):2903-2914.
[5]付鸾鸿,于 崧,于立河,等. 不同基因型燕麦萌发期耐盐碱性分析及其鉴定指标的筛选[J]. 作物杂志,2018(6):27-35,174.
[6]许英一,王 宇,林 巍. 燕麦蛋白理化性质研究[J]. 安徽农业大学学报,2018,45(3):385-388.
[7]石振兴,朱莹莹,任贵兴. 燕麦中减肥降脂的功能成分研究进展[J]. 食品安全质量检测学报,2018,9(7):1567-1571.
[8]任长忠,崔 林,杨 才,等. 我国燕麦高效育种技术体系创建与应用[J]. 中国农业科技导报,2016,18(1):1-6.
[9]王 炜,叶春雷,杨随庄,等. 花药培养技术在小麦种质资源创制及育种中的应用[J]. 中国种业,2018(11):25-29.
[10]田 娟,张 曼,董玉迪,等. 燕麦花药组织培养影响因子研究进展[J]. 安徽农业科学,2018,46(35):11-13.
[11]王 娟,李荫藩,梁秀芝,等. 北方主栽燕麦品种种质资源形态多样性分析[J]. 作物杂志,2017(4):27-32.
[12]Rines H W. Oat anther culture:genotype effect on callus initiation and the production of a haploid plant[J]. Crop Science,1983,23(2):268-272.
[13]Kiviharju E,Puolimatka M,Pehu E. Regeneration of anther-derived plants of Avena sterilis[J]. Plant Cell,Tissue & Organ Culture,1997,48(2):147-152.
[14]Warchol M,Skrzypek E,Nowakowska A,et al. The effect of auxin and genotype on the production of Avena sativa L. doubled haploid lines[J]. Plant Growth Regulation,2016,78(2):155-165.
[15]Kiviharju E,Pehu E. The effect of cold and heat pretreatments on anther culture response of Avena sativa and A. sterilis[J]. Plant Cell,Tissue and Organ Culture,1998,54(2):97-104.
[16]Kiviharju E M,Tauriainen A A. 2,4-dichlorophenoxyacetic acid and kinetin in anther culture of cultivated and wild oats and their interspecific crosses:plant regeneration from A. sativa L.[J]. Plant Cell Reports,1999,18(7):582-588.
[17]Rines H W, Rieralizarazu O, Nunez V M, et al. Oat haploids from anther culture and from wide hybridizations[M]//Jain S M, Sopory S K, Veilleux R E, et al. In vitro haploid production in higher plants. Dordrecht:Kluwer, 1997,4:205-221.
[18]Jingsan S,Tiegang L,Sōndahl M R,et al. Anther culture of naked oat and the establishment of its haploid suspension cell[J]. Journal of Integrative Plant Biology,1991,33(6):417-420.
[19]Rines H W. Oat haploids from wide hybridization[J]. Doubled Haploid Production in Crop Plants,2003:155-159.doi:10.1007/978-94-017-1293-4_24.
[20]Kiviharju E,Moisander S,Laurila J,et al. Improved green plant regeneration rates from oat anther culture and the agronomic performance of some DH lines[J]. Plant Cell,Tissue and Organ Culture,2005,81(1):1-9.
[21]Murashige T,Skoog F. A revised medium for rapid growth and bio assays with tobacco tissue cultures[J]. Physiologia Plantarum,1962,15(3):473-497.
[22]楊 才,王秀英. 采用花药单倍体育种方法育成花中21号莜麦新品种[J]. 河北北方学院学报(自然科学版),2005,21(3):39-42.
[23]Kiviharju E,Puolimatka M,Saastamoinen M,et al. Extension of anther culture to several genotypes of cultivated oats[J]. Plant Cell Reports,2000,19(7):674-679.
[24]S'lusarkiewicz-Jarzina A,Ponitka A. The effect of physical medium state on anther culture response in Polish cultivated oat (Avena sativa L.)[J]. Acta Biologica Cracoviensia(Series Botanica),2007,49(2):27-31.
[25]Noga A,Skrzypek E,Warchol M,et al. Conversion of oat (Avena sativa L.) haploid embryos into plants in relation to embryo developmental stage and regeneration media[J]. In Vitro Cellular & Developmental Biology-Plant,2016,52(6):590-597.
[26]Kiviharju E,Puolimatka M,Saastamoinen M,et al. The effect of genotype on anther culture response of cultivated and wild oats[J]. Agricultural and Food Science in Finland,1998,7(3):409-422.
[27]Kiviharju E,Moisander S,Tanhuanpaa P,et al. Oat anther culture and use of DH-lines for genetic mapping[J]. Methods of Molecular Biology,2017,1536:71-93.
[28]Sidhu P K,Davies P A. Regeneration of fertile green plants from oat isolated microspore culture[J]. Plant Cell Reports,2009,28(4):571-577.
[29]Ferrie A M R,Irmen K I,Beattie A D,et al. Isolated microspore culture of oat (Avena sativa L.) for the production of doubled haploids:effect of pre-culture and post-culture conditions[J]. Plant Cell,Tissue and Organ Culture,2014,116(1):89-96.
[30]Ponitka A,S'lusarkiewicz-Jarzina A. Regeneration of oat androgenic plants in relation to induction media and culture conditions of embry-like structures[J]. Acta Societatis Botanicorum Poloniae,2009,78(3):209-213.
[31]Warchol M,Czyczylo-Mysza I,Marcińska I,et al. Factors inducing regeneration response in oat (Avena sativa L.) anther culture[J]. In Vitro Cellular & Developmental Biology-Plant,2019,55(5):595-604.
