禾谷镰刀菌拮抗菌ZQT-31的分离与鉴定
2021-07-01张强张艳茹霍云凤郎剑锋陆宁海
张强 张艳茹 霍云凤 郎剑锋 陆宁海


摘要:从小麦植株残体中分离筛选对禾谷镰刀菌有拮抗作用的菌株,并对抑菌活性进行初步研究,从而为禾谷镰刀菌所致病害的生物防治提供参考依据。采用平板稀释法和皿内对峙法分离获得一株禾谷镰刀菌拮抗菌株 ZQT-31,根据形态、生理生化特征以及16S rDNA和gyrA序列分析将其鉴定为贝莱斯芽孢杆菌。菌株ZQT-31无菌发酵液对禾谷镰刀菌的菌丝生长具有明显抑制作用。在稳定性方面,无菌发酵液中的活性物质对温度和酸碱度均具有一定的耐受性。通过PCR检测发现,菌株ZQT-31可能具有芽孢杆菌溶素及丰原素B合成相关基因。此外,菌株 ZQT-31 对链格孢菌等6种植物病原真菌均具有明显的抑制作用。综上所述,贝莱斯芽孢杆菌ZQT-31对禾谷镰刀菌所致病害具有一定的生防潜力。
关键词:禾谷镰刀菌;贝莱斯芽孢杆菌;生物防治;抑菌活性
中图分类号: S435.1 文献标志码: A 文章编号:1002-1302(2021)09-0080-06
禾谷镰刀菌(Fusarium graminearum)作为一种重要的植物病原真菌,能够在小麦的不同生育阶段进行侵染,引起小麦赤霉病、茎基腐病等病害的发生[1-2]。在气候和耕作制度等多种因素的综合影响下,小麦赤霉病在我国的流行频率显著增加,并呈现北扩西移的趋势,我国年均发病面积超过小麦种植面积的20%[3-5]。小麦茎基腐病在我国黄淮小麦主产区普遍发生,而且出现加重和蔓延的趋势[6]。此外,禾谷镰刀菌还可以侵染玉米,导致玉米穗腐病和玉米茎基腐病的发生[7-8]。禾谷镰刀菌不仅会使作物出现产量损失和品质下降,而且能够分泌脱氧血腐镰刀菌烯醇(deoxynivalenol,DON)等多种真菌毒素,致使人畜健康受到威胁[9]。
生物防治技术在植物病害综合治理中具有重要作用,不仅能够有效保障食品和环境安全,而且对农业的可持续绿色发展具有重大意义[10]。研究表明,芽孢杆菌已经成为禾谷镰刀菌生物防治中研究最为广泛的菌株。例如,枯草芽孢杆菌(Bacillus subtilis) AF0907及Zl-2对禾谷镰刀菌的菌丝生长和孢子萌发都具有抑制作用[11-12]。解淀粉芽孢杆菌(B. amyloliquefacien) WPS4-1及CPLK1314不仅可以抑制禾谷镰刀菌的菌丝生长和孢子萌发,而且具有良好的DON毒素降解能力[13-14]。巨大芽孢杆菌(B. megaterium) BM1、贝莱斯芽孢杆菌(B. velezensis) RC218都可以有效降低小麦赤霉病的发生率,并且减少病原菌毒素的合成[15-16]。本研究从田间小麦植株残体上分离到1株对禾谷镰刀菌具有明显拮抗作用的芽孢杆菌ZQT-31,通过对该菌株的鉴定及拮抗特性等方面进行研究,以期为禾谷镰刀菌的生物防治提供微生物资源,并为后续生防机理的研究奠定理论基础。
1 材料与方法
1.1 试验菌株
禾谷镰刀菌(F. graminearum) PH-1,由西北农林科技大学普度大学联合研究中心提供。链格孢菌(Alternaria alternata)、胶孢炭疽菌(Colletotrichum gloeosporioides)、甜樱间座壳菌(Diaporthe eres)、嘴突脐孢(Exserohilum rostratum)、尖孢镰刀菌(F. oxysporum)、层出镰刀菌(F. proliferatum)均为实验室分离保存菌株。贝莱斯芽孢杆菌(B. velezensis)ZQT-31,分离于田间小麦植株残体。
1.2 培养基
PDA培养基:马铃薯200 g、葡萄糖20 g、琼脂15 g、H2O 1 L。牛肉膏蛋白胨培养基:蛋白胨10 g、NaCl 5 g、牛肉膏3 g、琼脂15 g、H2O 1 L,pH值为7.4~7.6。YEPD培养基:酵母提取物3 g、葡萄糖20 g、蛋白胨10 g、H2O 1 L。
1.3 细菌的分离
2019年6月于河南科技学院东区试验田采集小麦植株残体,并带回资源与环境学院植物病理学实验室进行细菌分离及后续试验。将样品剪成 2 cm 左右小段,用无菌水冲洗干净,放入75%乙醇浸泡3 min,之后用无菌水冲洗3遍。在无菌研钵中,放入消毒后的样品、适量石英砂10 mL无菌水進行研磨。将研磨液置于80 ℃条件下,处理30 min,以杀死绝大部分非芽孢细菌。取100 μL研磨液涂布于牛肉膏蛋白胨平板,30 ℃下培养2~3 d。根据菌落特征挑取不同单菌落,划线纯化后保存。
1.4 禾谷镰刀菌拮抗细菌的筛选
采用皿内对峙法,将直径5 mm大小的禾谷镰刀菌菌饼置于PDA平板中央,挑取待测细菌菌株接种于4点(距平板中心25 mm处),25 ℃下培养 3 d,计算抑菌率。抑菌率=(对照组菌落直径-试验组菌落直径)/对照菌落直径×100%。
1.5 菌株ZQT-31分类鉴定
1.5.1 形态及生理生化鉴定 具体方法参照《常见细菌系统鉴定手册》进行[17]。
1.5.2 分子生物学鉴定 以菌株ZQT-31基因组DNA为模板,利用通用引物(表1)分别对16S rDNA和gyrA基因进行PCR扩增。扩增产物由生工生物工程(上海)股份有限公司进行纯化测序。根据测序结果,在GenBank网站下载相关菌株的16S rDNA序列,用ClustalX 1.83软件进行比对,之后利用Mega 7.0软件采用邻接法构建系统发育树。
1.6 菌株ZQT-31无菌发酵液的获得
挑取ZQT-31单菌落于10 mL牛肉膏蛋白胨液体培养基中,30 ℃、180 r/min培养24 h,之后按照10%接种量转接至新的牛肉膏蛋白胨液体培养基中,30 ℃、180 r/min培养72 h,从而获得ZQT-31发酵液。将发酵液12000 r/min离心15min,取上清液,并用0.22 μm微孔滤膜过滤,进而获得无菌发酵液。
1.7 菌株ZQT-31无菌发酵液对禾谷镰刀菌的抑制作用
1.7.1 对菌落生长的抑制作用 将菌株ZQT-31无菌发酵液与融化好的PDA培养基按照体积比为 1 ∶ 9 混合倒板,于平板中心位置接种5 mm大小禾谷镰刀菌菌饼,25 ℃培养3 d,计算抑菌率。对照组以牛肉膏蛋白胨液体培养基代替无菌发酵液,每个处理重复3次。
1.7.2 对菌丝形态的抑制作用 将1 mL禾谷镰刀菌孢子悬浮液加入到9 mL酵母浸出粉胨葡萄糖液体培养基(YEPD)中,25 ℃、150 r/min摇培12 h,以获得菌丝体。之后按照10%终浓度加入菌株 ZQT-31 无菌发酵液,25 ℃、150 r/min 摇培24 h后观察菌丝的形态特征。对照组以牛肉膏蛋白胨液体培养基代替无菌发酵液,每个处理重复3次。
1.8 菌株ZQT-31无菌发酵液的稳定性
1.8.1 热稳定性 将菌株ZQT-31无菌发酵液分别置于30、50、70、90、110 ℃下处理30 min,计算不同温度处理后的无菌发酵液抑菌率,每个处理重复3次。
1.8.2 pH值稳定性 将菌株ZQT-31无菌发酵液的pH值分别调至3.0、5.0、7.0、9.0、11.0,室温静置4 h后,重新将pH值调至中性,计算不同pH值处理后的无菌发酵液抑菌率,每个处理重复3次。
1.9 菌株ZQT-31抗菌物质的PCR检测
菌株ZQT-31抗菌物质的种类采用已报道抗菌物质合成相关基因的PCR扩增进行检测[18],引物序列见表2。
1.10 菌株ZQT-31对不同植物病原真菌的拮抗作用
采用皿内对峙法,将5 mm直径的不同病原真菌菌饼置于PDA平板中央,挑取菌株ZQT-31接种于4点(距平板中心25 mm处),25 ℃下培养5 d,沿细菌菌落与平板中心方向,测量细菌菌落边缘至真菌菌落边缘的距离,即抑菌带宽度。每个处理重复3次。
2 结果与分析
2.1 拮抗菌株的分离与筛选
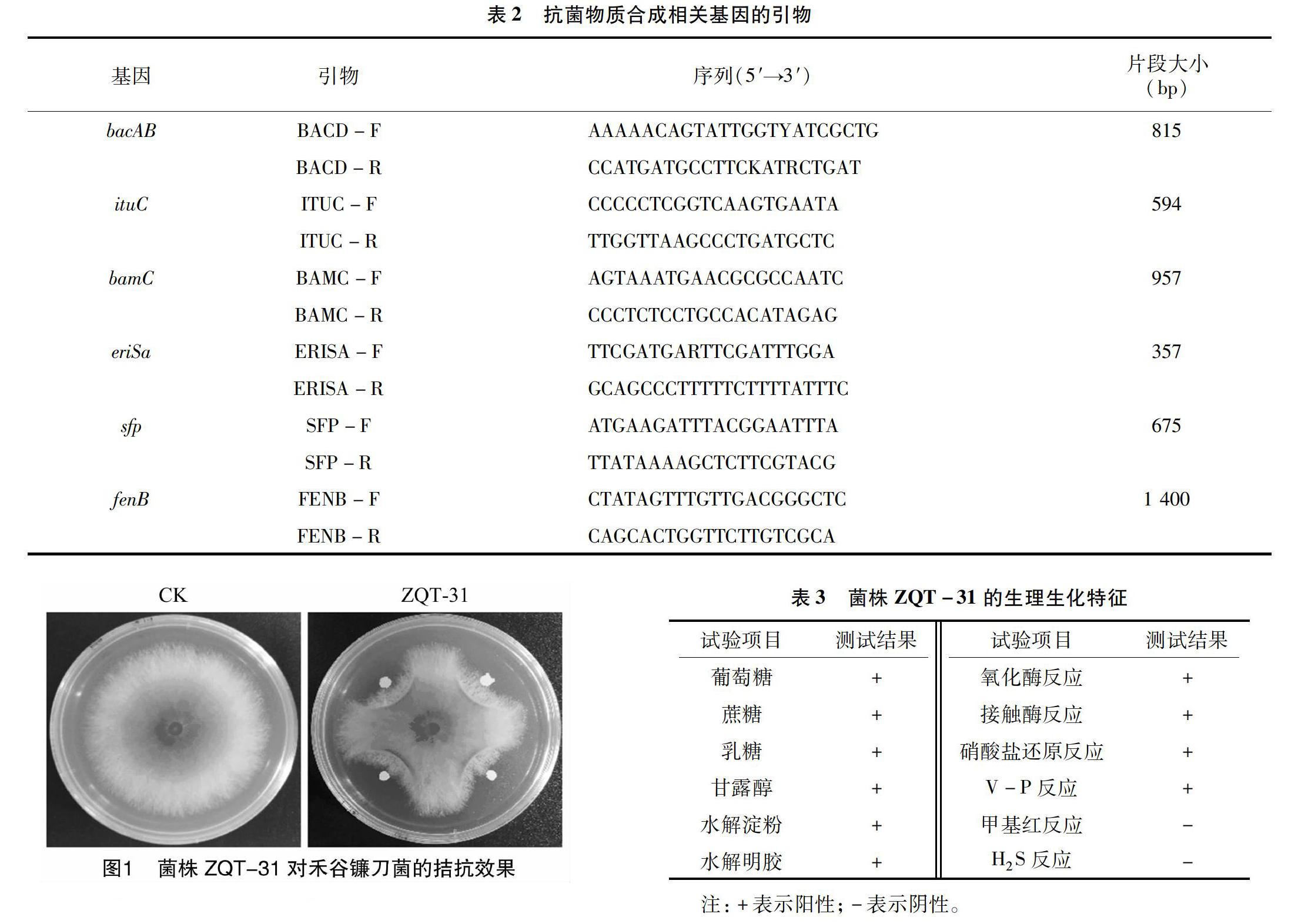
从小麦植株残体中分离筛选出7株对禾谷镰刀菌具有拮抗作用的菌株,其中ZQT-31的拮抗作用较为明显。皿内对峙结果表明,菌株ZQT-31对禾谷镰刀菌的抑菌率为(55.6±0.5)%(图1)。
2.2 菌株ZQT-31的分类鉴定
2.2.1 形态特征及生理生化特征 菌株ZQT-31在PDA培养基上形成的菌落不透明,颜色为乳白色,表面有褶皱,边缘不规则。菌体杆状、革兰氏染色阳性。生理生化分析结果表明,菌株ZQT-31可以利用葡萄糖、蔗糖、乳糖、甘露醇,能够水解淀粉和明胶,氧化酶反应、接触酶反应、硝酸盐还原反应及V-P(Voges-Proskauer)反应都呈阳性,甲基红反应和H2S反应呈阴性(表3)。
2.2.2 16S rDNA及gyrA基因序列分析及系统进化树的构建 以菌株ZQT-31基因组DNA为模板,对16S rDNA进行PCR扩增,经测序得到 1 500 bp 左右的序列。GenBank数据库比对结果表明,拮抗菌株ZQT-31的16S rDNA核酸序列与芽孢杆菌属的解淀粉芽孢杆菌(B. amyloliquefaciens) TPS17(MK130898)、贝莱斯芽孢杆菌(B. velezensis) YEBBR6(MT372157)以及枯草芽孢杆菌(B. subtilis)ZD-16(KF863785)等多个菌株的同源性达到100%,由此能够将ZQT-31初步鉴定为Bacillus sp.。
进一步对gyrA基因进行PCR扩增与测序,GenBank数据库比对结果表明,ZQT-31的gyrA序列与贝莱斯芽孢杆菌多个菌株的序列同源性达99%以上。采用邻接法构建gyrA序列系统发育树,结果表明,菌株ZQT-31与贝莱斯芽孢杆菌DSYZ、CGMCC聚类在一起,形成1个分支(图2)。结合形态特征和生理生化特征,将菌株ZQT-31鉴定为贝莱斯芽孢杆菌。
2.3 菌株ZQT-31无菌发酵液对禾谷镰刀菌的抑菌作用
在PDA培养基中加入菌株ZQT-31无菌发酵液后,禾谷镰刀菌的菌落生长受到明显的抑制,气生菌丝的形成减少,并且菌落色素加深。经计算抑菌率为(56.1±2.4)%(图3-A)。用10%终浓度的菌株ZQT-31无菌发酵液处理禾谷镰刀菌的菌丝24 h,导致菌丝生长出现畸形,顶端囊泡化。對照组的菌丝生长正常,且粗细均匀(图3-B)。结果表明,ZQT-31无菌发酵液可以明显抑制禾谷镰刀菌的菌丝生长。
2.4 菌株ZQT-31无菌发酵液的稳定性
菌株ZQT-31无菌发酵液经30~110 ℃的5个不同温度处理30 min后,对禾谷镰刀菌的菌落生长都具有一定的抑制作用。30 ℃下,无菌发酵液的抑菌率最高。随着温度升高,无菌发酵液的抑菌率与30 ℃相比均有所降低,但仍保持在40%以上(图4-A)。菌株ZQT-31无菌发酵液经5个pH值条件处理后,都具有抑菌活性。其中pH值为7.0时,抑菌率最高。过酸或过碱条件下,无菌发酵液的抑菌率有所降低,但都保持在40%左右(图4-B)。由此说明,菌株ZQT-31无菌发酵液中的活性物质对温度及酸碱度都具有一定的耐受性。
2.5 菌株ZQT-31拮抗物质基因的鉴定
利用6对拮抗物质基因的引物对菌株ZQT-31的基因组DNA进行PCR扩增,电泳结果(图5)显示,bacAB及fenB基因能够被成功扩增。由此推测,菌株ZQT-31基因组中可能存在芽孢杆菌溶素及丰原素B合成基因,并产生相应的抗菌物质。
2.6 菌株ZQT-31对不同植物病原真菌的拮抗作用
皿内对峙结果(图6、表4)表明,菌株ZQT-31对6种植物病原真菌都具有明显的抑制作用。其中对胶孢炭疽菌及链格孢菌的抑制作用最为明显,抑菌带分别为9.1、8.4 mm左右;其次为链格孢菌,抑菌带为(8.4±0.5) mm;对嘴突脐孢、尖孢镰刀菌及层出镰刀菌的抑菌带均在5~6 mm之间,而对甜樱间座壳菌的抑菌带小于4 mm。由此说明,菌株 ZQT-31 具有一定的抑菌谱。
3 讨论与结论
利用微生物及其代谢产物对植物病害进行生物防治具有重要意义,拮抗微生物作为一种主要的生防因子被广泛使用,其种类十分丰富,主要分为真菌、细菌、放线菌、病毒等[10]。本研究从小麦植株残体上分离到1株对禾谷镰刀菌具有明显抑制作用的拮抗菌株ZQT-31,通过生理生化特性和系统进化分析将其鉴定为贝莱斯芽孢杆菌。该菌株的无菌发酵液能够影响禾谷镰刀菌菌落的正常生长,并且导致菌絲出现畸形。并且无菌发酵液对温度和酸碱度具有一定耐受性,从而能够为禾谷镰刀菌所致病害的生物防治提供微生物资源和理论基础。此外,菌株ZQT-31对胶孢炭疽菌等6种植物病原真菌均有较好的抑制效果,说明ZQT-31具有防治多种真菌病害的潜力。
研究表明,贝莱斯芽孢杆菌不仅能够抵御病原微生物,而且可以促进植物生长[19]。例如贝莱斯芽孢杆菌G341对灰霉菌等多种病原真菌都具有较强的抑制作用[20]。孙平平等研究发现贝莱斯芽孢杆菌L-1对梨灰霉和青霉菌均具有较强的抑制作用,可以导致病原菌菌丝膨大畸形[21]。水稻内生菌贝莱斯芽孢杆菌E69可以抑制稻瘟菌分生孢子的萌发及附着胞的形成,而且在水稻茎部具有较好的定殖能力[22]。本研究发现,贝莱斯芽孢杆菌 ZQT-31 能够抑制禾谷镰刀菌的菌落生长,而且无菌发酵液对禾谷镰刀菌菌丝生长的抑制作用也很明显,从而说明该菌株可能具有防治禾谷镰刀菌所致病害的潜力,但须要进一步的生防试验的证实。
芽孢杆菌可以产生多种抗菌活性物质,如脂肽类、聚酮类及抗菌蛋白等。其中,脂肽类抗生素最为常见,包括丰原素、伊枯草菌素、表面活性素等,而且可以在抑制真菌病害的过程中起到重要作用[23-24]。从贝莱斯芽孢杆菌P9发酵上清液中提取的脂肽类粗提物在0~50 ℃条件下具有良好的稳定性。虽然随着温度的升高,其稳定性逐渐降低,但是仍然对尖孢镰刀菌具有一定的抑制能力[25]。贝莱斯芽孢杆菌504具有丰原素A等多个基因簇,可用于编码脂肽和聚酮糖类化合物。在稳定性方面,该菌株无菌发酵液能够耐受高温和蛋白酶的降解[26]。刘雪娇等研究发现,贝莱斯芽孢杆菌3A3-15具有伊枯草菌素C等多个抑菌基因,并且可以产生 C14~C15 Surfactin A这一抑菌物质[27]。本研究选用6种抗菌合成基因的引物对菌株ZQT-31的基因组DNA进行PCR扩增,最终检测到芽孢杆菌溶素及丰原素B合成相关基因。此外,菌株ZQT-31的无菌发酵液中的活性物质能够耐受高温的处理,具有一定的热稳定性,由此可以推测该菌株的抗菌活性物质可能为脂肽类物质,但是具体物质的种类有待进一步分析。
参考文献:
[1]程顺和,张 勇,别同德,等. 中国小麦赤霉病的危害及抗性遗传改良[J]. 江苏农业学报,2012,28(5):938-942.
[2]张向向,孙海燕,李 伟,等. 我国冬小麦主产省小麦茎基腐镰孢菌的组成及其致病力[J]. 麦类作物学报,2014,34(2):272-278.
[3]刘万才,刘振东,黄 冲,等. 近10年农作物主要病虫害发生危害情况的统计和分析[J]. 植物保护,2016,42(5):1-9,46.
[4]陈 云,王建强,杨荣明,等. 小麦赤霉病发生危害形势及防控对策[J]. 植物保护,2017,43(5):11-17.
[5]黄 冲,姜玉英,吴佳文,等. 2018年我国小麦赤霉病重发特点及原因分析[J]. 植物保护,2019,45(2):160-163.
[6]周海峰,杨 云,牛亚娟,等. 小麦茎基腐病的发生动态与防治技术[J]. 河南农业科学,2014,43(5):114-117.
[7]袁虹霞,闵营辉,张丹丹,等. 河南省玉米茎腐病病原菌分离和致病性测定[J]. 玉米科学,2011,19(6):122-124.
[8]秦子惠,任 旭,江 凯,等. 我国玉米穗腐病致病镰孢种群及禾谷镰孢复合种的鉴定[J]. 植物保护学报,2014,41(5):589-596.
[9]Audenaert K,Vanheule A,Hfte M,et al. Deoxynivalenol:a major player in the multifaceted response of Fusarium to its environment[J]. Toxins,2013,6(1):1-19.
[10]邱德文.我国植物病害生物防治的现状及发展策略[J]. 植物保护,2010,36(4):15-18,35.
[11]徐剑宏,王建伟,胡晓丹,等. 小麦赤霉病菌拮抗菌AF0907的分离鉴定及其拮抗特性[J]. 江苏农业学报,2013,29(3):517-522.
[12]郑小亮,董 超,牛瑞艳,等. 枯草芽孢杆菌Zl-2抗菌蛋白特性及对小麦赤霉病菌的抑制作用[J]. 黑龙江大学自然科学学报,2018,35(2):206-211.
[13]史翠娟. 防治脱氧雪腐镰刀烯醇毒素污染的脂肽类抗菌物质的研究[D]. 哈尔滨:哈尔滨工业大学,2014.
[14]曹 坤,管 明,陈 康,等. 一株拮抗禾谷镰刀菌和降解呕吐毒素解淀粉芽孢杆菌的筛选及在饲料贮存中的应用[J]. 江苏农业科学,2019,47(8):179-183,190.
[15]Pan D,Mionetto A,Tiscornia S,et al. Endophytic bacteria from wheat grain as biocontrol agents of Fusarium graminearum and deoxynivalenol production in wheat[J]. Mycotoxin Research,2015,31(3):137-143.
[16]Palazzini J,Roncallo P,Cantoro R,et al. Biocontrol of Fusarium graminearum sensu stricto,reduction of deoxynivalenol accumulation and phytohormone induction by two selected antagonists[J]. Toxins,2018,10(2):88.
[17]東秀珠,蔡妙英. 常见细菌系统鉴定手册[M]. 北京:科学出版社,2001.
[18]Chung S,Kong H,Buyer J S,et al. Isolation and partial characterization of Bacillus subtilis ME488 for suppression of soilborne pathogens of cucumber and pepper[J]. Applied Microbiology and Biotechnology,2008,80(1):115-123.
[19]蔡高磊,张 凡,欧阳友香,等. 贝莱斯芽孢杆菌(Bacillus velezensis)研究进展[J]. 北方园艺,2018(12):162-167.
[20]Lim S M,Yoon M Y,Gj C,et al. Diffusible and volatile antifungal compounds produced by an antagonistic Bacillus velezensis G341 against various phytopathogenic fungi[J]. Plant Pathology Journal,2017,33(5):488-498.
[21]孙平平,崔建潮,贾晓辉,等. 贝莱斯芽孢杆菌L-1对梨灰霉和青霉病菌的抑制作用评价及全基因组分析[J]. 微生物学报,2018,58(9):1637-1646.
[22]沙月霞,隋书婷,曾庆超,等. 贝莱斯芽孢杆菌E69预防稻瘟病等多种真菌病害的潜力[J]. 中国农业科学,2019,52(11):1908-1917.
[23]Yang H,Li X,Li X,et al. Identification of lipopeptide isoforms by MALDI-TOF-MS/MS based on the simultaneous purification of iturin,fengycin,and surfactin by RP-HPLC[J]. Analytical and Bioanalytical Chemistry,2015,407(9):2529-2542.
[24]张 猛,王 琼,冯发运,等. 稻壳生物炭搭载特基拉芽孢杆菌防治西瓜枯萎病[J]. 江苏农业学报,2019,35(6):1308-1315.
[25]刘 安,赵 华,张朝正. 贝莱斯芽孢杆菌抑菌物质的分析及提取优化[J]. 中国酿造,2019,38(12):63-68.
[26]李生樟,陈 颖,杨瑞环,等. 一株拮抗黄单胞菌的贝莱斯芽孢杆菌的分离和鉴定[J]. 微生物学报,2019,59(10):1969-1983.
[27]刘雪娇,李红亚,李术娜,等. 贝莱斯芽孢杆菌3A3-15生防和促生机制[J]. 河北大学学报(自然科学版),2019,39(3):302-310.
