miR-497抑制人结肠癌细胞血管生成及迁移侵袭能力的研究
2021-07-01刘少平胡亚华章国星卫银芝
刘少平,胡亚华,张 海,章国星,卫银芝
1.鄂东医疗集团黄石市中心医院(湖北理工学院附属医院)全科医学科,湖北 黄石 435000;2.武汉科技大学职业危害识别与控制湖北省重点实验室;3.鄂东医疗集团黄石市中心医院(湖北理工学院附属医院)消化内科
结直肠癌(colorectal cancer,CRC)是新生血管丰富的实体肿瘤,活跃的血管生成能力和转移能力是其两大重要特征。新生血管不仅供给肿瘤快速生长所需的充足养分,而且成为其转移的重要通道[1-4]。近年研究发现,miR-497在肿瘤发生发展过程中发挥抑癌基因的作用,其表达水平的改变能够调节肿瘤发生发展相关的重要生物学事件,包括细胞增殖、分化、周期、凋亡、上皮-间充质转化(epithelial-mesenchymal transition,EMT)、血管生成、迁移、侵袭等[2-7]。近年研究显示,miR-497通过作用VEGF-A/ERK/MMP-9信号通路中关键分子、靶向作用胰岛素受体底物1、抑制EMT等途径,在CRC血管生成中发挥了重要作用[3-5]。本实验探讨miR-497对人结肠癌细胞血管生成和迁移侵袭能力的作用影响。
1 材料与方法
1.1 细胞及主要试剂人结肠癌细胞株HT-29、人脐静脉内皮细胞(HUVEC)由武汉大学中南医院肿瘤实验中心馈赠。脂质体LipofectamineTM2000购自Invitrogen公司;化学合成的miRNA mimic micrONTMhsa-miR-497 mimic及其阴性对照miR-NC购自广州市锐博生物科技有限公司;DMEM高糖培养基和胎牛血清购自Gibco公司;孔径8 μm的24孔和96孔Transwell板购自美国Corning公司。Matrigel基质胶购自美国BD公司。VEGFA ELISA检测试剂盒购自福州迈新生物技术开发有限公司;抗-VEGFA抗体购自Proteintech公司;抗-GAPD抗体购自上海联迈生物工程有限公司。其他生化试剂均为国产分析纯试剂。
1.2 细胞培养细胞复苏后置于质量浓度为100 g/L的灭活胎牛血清的RPMI 1640培养液、100 U/ml青霉素、100 U/ml链霉素的培养基中,并于37 ℃、体积分数为5%的CO2加湿细胞培养箱内培养,用0.02% EDTA/0.25%胰酶消化传代,取对数增殖期的细胞用于实验。
1.3 血管内皮细胞募集实验24孔板中接种HT-29细胞,待其贴壁后转染相应miR-497 mimic及其对照miR-NC,24 h后更换为无血清培养基,每孔600 μl;以无血清培养基重悬HUVEC细胞,调整细胞密度为5×105个/ml,吸取100 μl接种于8 μm孔径的Transwell小室的上室,常规培养24 h后,固定细胞,以0.1%结晶紫染色,400倍显微镜下随机计数5个视野细胞数。
1.4 血管内皮细胞小管形成实验Matrigel与无血清培养基以1∶1比例稀释,50 μl/孔加入96孔板中,37 ℃细胞培养箱中放置60 min。0.25%胰酶消化HUVEC细胞,计数后用特定的条件培养液重悬细胞并调整细胞密度为3×105个/ml。HT-29细胞转染miR-497 mimic及其对照miR-NC后,用收集到条件培养基重悬HUVEC并接种于包被了基质胶的96孔板中,常规培养6 h,200倍显微镜下随机5个视野观察计数血管内皮细胞小管分支。
1.5 人结肠癌细胞Transwell迁移实验24孔板下室加入600 μl含20% FBS的培养液,放入Transwell小室,将其放进培养板;吸取100 μl细胞密度为5×105个/ml的细胞悬液加入Transwell小室;常规培养36 h后,固定细胞,以0.1%结晶紫染色,400倍显微镜下随机计数5个视野细胞数。
1.6 人结肠癌细胞Transwell侵袭实验Transwell上室加入200 μl PBS,放入细胞培养箱中水化基底膜1 h,以Matrigel 1∶8稀释后每孔50 μl包被Transwell小室底部膜的上室面;24孔板下室加入600 μl含20% FBS的培养液,放入Transwell小室,将其放进培养板。吸取100 μl细胞密度为5×105个/ml的细胞悬液加入Transwell小室;常规培养48 h后,固定细胞,以0.1%结晶紫染色,400倍显微镜下随机计数5个视野细胞数。
1.7 ELISA和Western blotting法检测VEGFA蛋白表达人结肠癌HT-29细胞转染miR-497 mimic及对照miR-NC 48 h后,收集细胞上清,采用ELISA法测定游离VEGFA含量,操作步骤严格按试剂盒说明书进行;同时收集细胞上清并抽提细胞总蛋白,采用Western blotting法检测HT-29细胞内VEGFA蛋白表达,通过光密度值定量分析和内参蛋白GAPDH校正。
2 结果
2.1 上调人结肠癌细胞miR-497表达对HUVEC募集的影响转染miR-497 mimic及其对照miR-NC的人结肠癌HT-29细胞接种于Transwell下室并观察其对上室接种的HUVEC细胞的趋化募集能力影响。结果显示,转染了miR-497的HT-29细胞对血管内皮细胞的趋化能力明显减弱,跨过小室膜的HUVEC细胞数目明显减少(见图1)。
2.2 上调人结肠癌细胞miR-497表达对血管内皮细胞小管形成能力的影响人结肠癌HT-29细胞转染miR-497 mimic及其对照miR-NC后,用收集到条件培养基重悬HUVEC并接种于包被了基质胶的96孔板中,6 h后观察血管内皮细胞形成小管的差异。结果显示,转染了miR-NC的条件性培养基所形成的小管管型分支更多也更完整,说明miR-497可抑制HT-29细胞对血管内皮细胞小管形成的促进作用(见图2)。
2.3 miR-497对人结肠癌细胞的迁移与侵袭能力的影响Transwell迁移及侵袭实验可用来评价细胞的运动能力,并进一步反应细胞的转移能力。实验结果显示:HT-29细胞转染miR-497后,无论有无基质胶的存在,HT-29细胞向小室膜外表面的移动均明显减少,表明miR-497抑制HT-29细胞的迁移与侵袭能力(见图3)。
2.4 miR-497对VEGFA蛋白表达的影响HT-29细胞转染miR-497 mimic及对照miR-NC 48 h后,收集细胞上清;采用ELISA法测定细胞上清中游离VEGFA的产生水平,结果显示,转染miR-497 mimic的HT-29细胞的上清中VEGFA分泌量明显降低(见图4A);Western blotting法检测HT-29细胞内VEGFA蛋白的表达水平,结果显示,转染miR-497后HT-29细胞内VEGFA的表达水平明显下降(见图4B)。
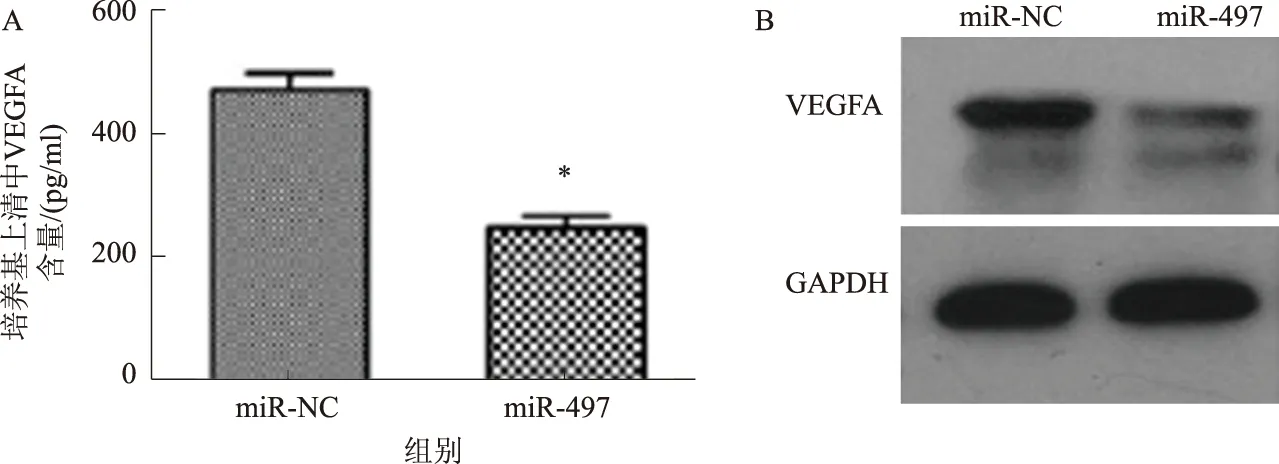
注:与miR-NC比较,*P<0.05。图4 miR-497对VEGFA蛋白表达的影响Fig 4 The effect of miR-497 on the expression of VEGFA
3 讨论
CRC是血管富集的实体瘤,血管生成在其发生发展中发挥重要作用;新生血管不仅供给CRC快速生长所需的充足养分,而且成为其转移的重要通道,与其进展和预后密切相关。近年研究显示,作为肿瘤抑制因子的miR-497在肿瘤血管生成及侵袭转移中起着重要作用[1-5]。有研究表明,EMT与肿瘤血管生成、肿瘤细胞转移能力的获得密切相关[4,8]。Zhang等[4]发现,miR-497通过作用于fos相关抗原-1,其高表达抑制CRC细胞EMT,从而抑制其转移及侵袭。Ruan等[9]研究证实,在人骨肉瘤细胞中miR-497通过抑制血管抑素结合蛋白基因表达的作用,来抑制肿瘤血管生成、从而抑制肿瘤细胞的增殖、侵袭和转移。Qiu等[3]研究证实,VEGF-A是miR-497的作用靶点,其过度表达可改变VEGF-A/ERK/MMP-9信号通路中关键分子的表达,从而抑制CRC血管生成、侵袭和转移。Wu等[10]研究显示,过度表达的miR-497可减少VEGF和HIF-1α蛋白水平,发挥抑制肿瘤生长和减少血管生成的作用。Tu等[11]研究显示,过度表达的miR-497通过Raf/MEK/ERK信号通路,抑制VEGFR2的激活,从而起到抑制肿瘤血管生成和肿瘤生长的作用。过表达的miR-497亦通过DNA甲基化、MAPK/ERK信号通路及作用于VEGF,抑制胃癌细胞、多发性骨髓瘤细胞、视网膜母细胞瘤细胞的增殖、迁移和侵袭能力[12-14]。本实验探讨miR-497对人结肠癌细胞血管生成、迁移和侵袭能力的作用影响及其机制。
运用化学方法合成的miRNA mimic能模拟细胞中内源性成熟miRNA的高水平表达,以增强其调控作用,是miRNA功能研究的高效工具;miR-497 mimic可稳定上调细胞中miR-497的表达水平[3-4]。本研究通过人结肠癌HT-29细胞转染miR-497 mimic及其对照miR-NC后进行血管内皮细胞募集实验和血管内皮细胞小管形成实验,结果发现,转染了miR-497的HT-29细胞对血管内皮细胞的趋化能力明显减弱,跨膜的HUVEC细胞数目明显减少,说明上调miR-497表达可抑制HT-29细胞对血管内皮细胞小管形成的促进作用;同时,HT-29细胞的Transwell迁移和侵袭实验显示,上调人结肠癌HT-29细胞中miR-497的表达可明显抑制其迁移、侵袭能力。
为探讨miR-497抑制HT-29细胞对于血管生成促进作用的机制,本实验采用ELISA和Western blotting两种方法检测了VEGFA蛋白水平变化。VEGFA是VEGF家族中作用最强的成员,VEGF在血管生成过程中起着关键作用,其通过与表达于血管内皮细胞上的受体VEGFR1和VEGFR2偶联进而激活多种信号通路,促进血管内皮细胞增殖、迁移、侵袭,诱导新生血管生成[3,9-10]。实验结果显示,转染miR-497 mimic的HT-29细胞的上清中游离VEGFA的分泌量明显降低,同时,HT-29细胞内VEGFA的表达水平亦明显下降,这表明miR-497可降低HT-29细胞中VEGFA蛋白的表达水平,并降低其分泌作用,这与Qiu等[3]研究结果相似。
综上,本实验在细胞水平上证实了miR-497可显著抑制人结肠癌的血管生成、侵袭和迁移,其机制为miR-497降低人结肠癌细胞中VEGFA蛋白的表达水平,并降低VEGFA的分泌作用,亦显示miR-497可成为人结肠癌治疗的潜在靶点。
