肉瘤样肾癌34例临床病理特征及预后分析
2021-07-01肖若陶徐楚潇马潞林
肖若陶,徐楚潇,陆 敏,刘 承,马潞林
(北京大学第三医院:1.泌尿外科;2.病理科,北京 100191)
肾细胞癌占成人恶性肿瘤的3%左右,是第3常见的泌尿系肿瘤,发病率逐年递增[1]。总体而言,局限性肾癌经手术治疗后预后较好,5年生存率达85.8%~90.1%[2]。肉瘤样分化是肾癌的一种罕见的病理特征,在所有肾癌中占5%左右[3],合并肉瘤样分化的肾癌通常称为肉瘤样肾癌(sarcomatoid renal cell carcinoma,sRCC)。与普通肾癌病理类型不同,sRCC的预后极差,多数患者在1年内出现肿瘤转移而死亡[4]。然而,目前国内关于sRCC的报道仍然少见。为进一步加强对此类疾病的认识,本研究回顾性分析2015年1月至2020年7月于北京大学第三医院手术治疗的34例sRCC患者的临床病理及预后资料,以指导临床诊疗决策。
1 资料与方法
1.1 临床资料本组患者共34例。男性26例,女性8例。年龄为33~82岁,平均年龄为(56.32±9.93)岁。平均身体质量指数(body mass index,BMI)为(23.09±3.16),范围16.44~29.41。初诊时7例为无症状体检发现,有症状者27例,其中首发症状为血尿者13例、腰痛者8例、腹部肿块者1例、乏力纳差等非特异性症状者5例。美国麻醉医师协会(American society of anesthesiologists,ASA)分级1级者6例、2级者24例、3级者4例。
1.2 治疗方法术前所有患者行胸片、腹部超声及泌尿系增强计算机断层扫描(computed tomography,CT)检查,依据影像学结果对合并瘤栓的患者参照Mayo分级标准进行分级[5],对怀疑远处转移的患者行正电子发射断层显像(positron emission tomography,PET-CT)明确。本组患者均成功接受手术治疗。17例接受腹腔镜手术,17例接受开放手术。所有患者均行根治性肾切除术(伴或不伴瘤栓取出术),手术时间为73~561 min,平均手术时间为(309.38±116.21)min。中位术中出血量为650(10~4 700)mL。
术后所有标本使用甲醛进行固定。病理标本由1位病理医师负责检查及报告,另1位高年资病理医师负责审核。病理组织学分型采用2016年世界卫生组织(world health organization,WHO)肾细胞癌病理分类标准,细胞核分级采用2016年WHO/ISUP核分级标准(4例患者因确诊于2015年,病理报告采用2004版本WHO分类标准及Fuhrman核分级标准)[6]。
1.3 术后随访对所有患者进行门诊或电话随访。推荐患者术后1年内每3个月复诊1次,此后每6个月复诊1次。每次复诊常规行实验室和影像学[胸部X片、泌尿系超声、CT或磁共振成像(magnetic resonance imaging,MRI)]检查,对未在门诊复诊的患者进行电话随访。对术前合并转移或术后发生复发转移的患者使用舒尼替尼或索拉菲尼进行靶向治疗。
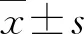
2 结 果
2.1 影像学结果肿瘤位于左侧13例(38.2%)、右侧21例(61.8%),肿瘤直径为3.8~20.0 cm,平均直径为(9.71±3.50)cm。泌尿系增强CT肿物影像学特点:①平扫呈软组织密度,形态不规则,与正常肾脏界限不清,少部分肿物内部含钙化灶(6/34);②增强后肿物呈富血供表现,动脉期肿物呈明显不均匀强化,部分中间可见无强化坏死区域(18/34);③静脉期之后强化程度较前减低(图1)。29例(85.3%)患者影像学发现肾静脉或下腔静脉瘤栓,其中0级瘤栓7例(20.6%)、Ⅰ级瘤栓12例(35.3%)、Ⅱ级瘤栓6例(17.6%)、Ⅲ级瘤栓1例(2.9%)、Ⅳ级瘤栓3例(8.8%)。此外3例(8.8%)患者术前经PET-CT检查证实远处转移,其中1例合并双肺及肝脏多发转移,2例合并骨转移。
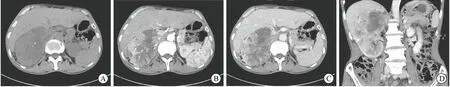
A:平扫可见右肾巨大肿物(11 cm×9 cm×10 cm),呈软组织密度影,内部可见点状钙化灶,平均CT值约31.9 Hu;B:动脉期肿物呈明显不均匀强化,内部可见无强化坏死区域,平均CT值61.9 Hu;C:静脉期肿物强化较动脉期减弱,平均CT值为55.7 Hu;D:冠状位可见肿物与正常肾组织界限不清,呈侵袭性生长。图1 sRCC患者泌尿系增强CT图像
2.2 病理学结果病理切片经HE染色,镜下见肿瘤组织可呈双相分布,包含肾细胞癌成分和肉瘤成分各占一定比例。肉瘤成分在镜下表现为多形性梭形细胞和巨细胞,排列紧密且不规则,可呈漩涡样或巢状排列(图2)。本组患者组织学类型为透明性细胞癌31例(91.2%)、乳头状细胞癌2例(5.9%)、未分类癌1例(2.9%)。镜下主要成分的核分级为2级者7例(20.6%),3级者2例(5.9%),4级者24例(70.6%)。可见坏死者25例(73.5%)、肾窦侵犯者30例(88.2%)、肾周脂肪囊侵犯者9例(26.5%)、肾上腺侵犯者5例(14.7%)、淋巴结转移者12例(35.3%)。
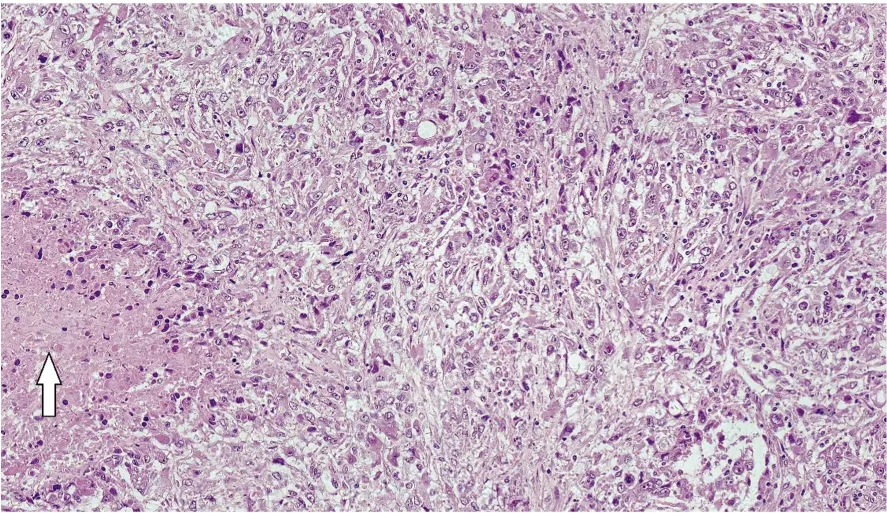
白色箭头所指为坏死区域。图2 sRCC患者病理镜下观(HE,×200)
2.3 预后情况28例(82.4%)患者获得随访资料,随访时间为1~50个月,中位随访时间为10个月。本组患者生存情况如图3所示,16例(47.1%)患者随访过程中出现死亡,中位总体生存时间为14个月,1年和2年总体生存率为57.1%和32.1%。20例(58.8%)患者随访过程中出现肿瘤转移,单发转移10例(肺转移6例、骨转移2例、脑转移2例),全身多发转移8例,另2例转移部位不明确。中位无进展生存时间为14个月,1年和2年无进展生存率为50.7%和27.1%。
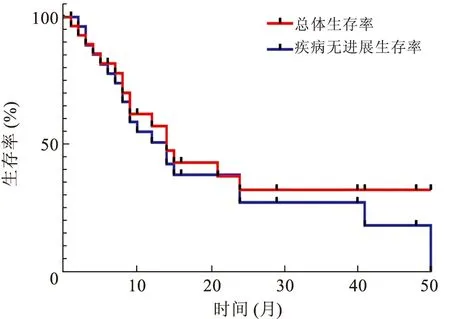
图3 sRCC患者生存曲线
3 讨 论
1968年FARROW等[7]学者发现一种肾癌在镜下表现为多形性梭形细胞和巨细胞的混合成分,与肉瘤表现类似,将此类肾癌命名为“肉瘤样肾癌”,随后sRCC也被归为独立的组织学类型。而后研究发现,在肾癌传统组织学类型中均可出现肉瘤样成分,因此1997年美国癌症联合会(American Joint Committee on Cancer,AJCC)将sRCC从肾癌组织学类型中移除,视为肾癌的一种特殊病理学特征,sRCC占总体肾癌的5%左右[3,8]。
据文献报道90%以上的sRCC患者初诊时会伴随临床症状,其中以腰痛(51.0%)、血尿(22.0%~34.7%)及体重减轻(18.0%~22.6%)等症状为主[3-4,9-10],与本组患者表现类似。约有20%的患者在初诊时已发生远处转移,常见的转移部位包括肺(34.6%~71.0%)、骨(13.0%~44.0%)、淋巴结(25%)等[3-4,10]。影像学上,一项回顾性研究对比了20例sRCC和25例肾脏透明细胞癌(clear cell renal cell carcinoma,ccRCC)患者术前CT资料,发现sRCC相比ccRCC患者肿瘤的平均体积更大(7.7vs.5.0 cm,P=0.003)[11],sRCC的瘤体周围伴随更多新生粗大的血管(P<0.001),瘤体强化也更加不均匀(P<0.001)[11]。然而,sRCC在临床表现及影像学上无特异性表现,其诊断依赖于术后病理学结果。
sRCC在光镜下通常可见肾细胞癌来源的上皮成分及肉瘤成分,2种成分各占一部分比例。肉瘤成分在光镜下表现为排列致密的多形性梭形细胞或巨细胞团块,呈巢状或漩涡状分布,细胞核染色明显,具有极高的核分裂象。约有90%的sRCC镜下可见坏死成分,约30%可见血管侵犯,其中15%可见伴有横纹肌样分化[3-4,12]。本组患者出现坏死的比例为73.5%,与文献报道相近,此外出现肾上腺侵犯和淋巴结转移的概率高达14.7%和35.3%,提示sRCC具有极高的侵袭性。部分sRCC在镜下可完全呈肉瘤样表现,难以同尿路上皮肿瘤肉瘤样分化、肾上腺肿瘤肉瘤样分化及未分化脂肪肉瘤等疾病相鉴别,此时可通过PAX2、PAX8等肾癌免疫组化标记物染色进行鉴别[13]。随着二代测序技术的发展,sRCC的突变特征也逐步被发现。2016年BI等[14]学者针对21例伴有肉瘤样分化的肾透明细胞癌的上皮成分、肉瘤成分及癌旁组织进行全外显子测序,发现上皮成分与肉瘤成分共享41.7%的突变位点,其中最高的突变位点为WH、PBRM1、PTEN和SETD2。随后该研究也揭示了TP53是肉瘤成分最常见的基因突变类型,占总体成分的31.6%,而在配对的肾癌上皮成分中并未发现类似结果[14]。此外,肉瘤成分在BAP1(10.5%)和ARID1A(15.7%)等肿瘤驱动基因上表达也增加[14]。后续相关实验也进一步揭示了sRCC在VHL、C10orf113、BAP1、TMEM97、CALML3、IL15、PTEN及TP53、NF2、RELN等位点的突变特点[15],给sRCC的分子生物学诊断提供了相应理论依据。
即使是局限性肾癌,如合并肉瘤样分化在术后5~26个月内仍有近80%患者出现肿瘤复发[4,16]。当sRCC术前合并转移时,行减瘤术后1、3、5年肿瘤特异性生存率仅为33.7%、10.8%、6.2%[17]。本组患者术后1年内存活率和无进展生存率分别仅有57.1%和50.7%,术后2年降至32.1%和27.1%。无论是在细胞因子时代还是靶向治疗时代,sRCC的辅助治疗一直未取得重大突破。直至如今免疫治疗时代,研究发现sRCC无论在PD1和PDL1的表达上,亦或是肿瘤相关淋巴细胞的浸润上,均较普通病理类型肾癌高[18-19]。随后进行了相应临床试验:一项CheckMate214临床试验结果显示,74例伊匹单抗联合纳武单抗相较于65例舒尼替尼单药,高危sRCC的中位无进展生存率(26.5个月vs.5.1个月,P=0.009 3)、完全缓解率(18.9%vs.3.1%)、局部缓解率(41.9%vs.20.0%)及中位生存时间(未达vs.14个月)均有显著提高[20];另一项Keynote-426前期临床试验针对105例sRCC的研究,结果显示sRCC患者使用帕博利珠单抗联合阿西替尼相较于舒尼替尼单药,客观缓解率(58.8%vs.31.5%)、完全缓解率(11.8%vs.0%)及1年肿瘤无进展生存率(57.0%vs.26.0%)均有提高[21]。研究者对目前临床试验结果进行荟萃分析显示,sRCC使用免疫治疗相较于舒尼替尼单药,客观缓解率(50.0%vs.20.0%,RR=2.15,P<0.001)显著提高,并且能够降低40%的肿瘤进展率(HR=0.56,P<0.001)和总体死亡率(HR=0.56,P=0.001)[22]。然而目前临床试验纳入的研究对象为转移性肾癌,各项试验结果数据仍存在一定差异,对局限性sRCC是否进行免疫治疗目前证据不充分,因此需要更多循证医学证据来挖掘免疫治疗在sRCC中的运用价值。
综上所述,sRCC是一种较为罕见的肾癌类型,此类患者在临床表现及影像学上并无明显特异性表现,疾病的诊断主要依据病理学检查。sRCC的预后极差,中位无进展生存时间及总体生存时间仅1年左右。目前免疫治疗有望给sRCC患者带来生存获益,但仍需要更多证据证实其治疗价值。
