活性橙染料脱色菌株的筛选、鉴定及脱色研究
2021-07-01朱进风彭其安
朱进风,赵 晖,彭其安
活性橙染料脱色菌株的筛选、鉴定及脱色研究
朱进风1,赵 晖*2,3,彭其安2,3
(1. 宜昌市环境保护监测站,湖北 宜昌 443000;2. 武汉纺织大学 环境工程学院,湖北 武汉 430200;3. 纺织印染清洁生产教育部工程研究中心,湖北 武汉 430200)
从活性污泥中分离出一株活性橙脱色菌株S-3,经16S rRNA基因测序初步鉴定为,同时,研究了该菌株对活性橙的优化脱色条件。结果表明,菌株脱色的培养基优化配方为:葡萄糖20.00g/L、酵母提取物0.50g/L、NaCl 0.10g/L、KH2PO42.00g/L、K2HPO42.00g/L、(NH4)2·SO40.20g/L、脲0.50g/L、MgSO4·7H2O 0.20g/L;优化处理条件为30℃时,摇床转速40 r/min,脱色时间24h,浓度为 100mg/L 的活性橙染液的脱色率高达92%。结果表明本研究筛选的菌株对活性橙染液具有较好的脱色性能。
活性橙;筛选;鉴定;生物脱色
印染废水和染料废水中含有大量的未被使用的染料。染料生产过程中,约有2%的产品随废水流失;印染过程中,约有10%的所用染料被损失。这不仅造成极大经济损失,也造成了严重的环境污染。当前,传统的物化处理技术存在着处理成本高、易引起二次污染等问题,在工程应用中受到了制约。而利用微生物技术处理色度高、难降解的染料废水具有反应条件温和、运行费用低、无二次污染等特点,符合可持续性发展的需要,具有较好的应用前景,近年来受到了学者们的密切关注[1~2]。
本研究以活性橙染料为菌株筛选底物,从活性污泥中筛选出针对该染料的高效脱色菌株,并探讨合适的脱色条件,为进一步扩展染料降解菌株基础研究提供参考。
1 材料与方法
1.1 材料
(1)基础培养基(LB培养基):胰蛋白胨10.0g/L,酵母提取物5.0 g/L,NaCl 10.0 g/L,pH 7.0;
(2)固体培养基:在LB培养基中加入3%琼脂;
(3)染料培养基:在LB培养基中加入活性橙染液(浓度500mg/L);
(4)菌株来源:取自于武汉纺织大学污水处理站曝气池的活性污泥,并添加一定浓度的染料进行富集培养。
1.2 脱色效果的表征
用脱色率作为处理效果的表征。采用分光光度计在染料最大吸收波长(λmax)500nm处测试染液和残液的吸光度,并按公式进行计算。
取反应后的溶液10 ml,离心(8000 r/min)5 min,上清液过滤,在500 nm下测吸光度,记为At。以不接菌的含相同浓度染料培养基的吸光度A0为对照,根据公式计算脱色率DE,即:

1.3 实验方法
1.3.1 菌株筛选与鉴定
(1)菌株筛选:取2ml活性污泥4份(序号:1-1、1-2、1-3、1-4),分别加入到4个125ml活性橙染料培养基三角烧瓶中(染料浓度500mg/L),30℃培养24h,进行初次筛选。选取初次筛选中褪色明细的菌种进行二次筛选(序号:2-1、2-2、2-3、2-4)。
(2)纯种分离:取二次筛选褪色最为明显的菌株进行纯种分离。
菌株提取:取上述染料培养液于离心管中进行离心分离(转速800r/min,时间10min),并将分离的菌体用无菌水洗涤三次后悬浮于无菌生理盐水中。
初次挑菌:配制500mg/L 活性橙染料培养基500mL均匀倒入培养皿中。在培养皿凝固后,使用接种环,运用平板分离划线法接种经过离心洗涤的菌体,进行纯种分离操作,然后放入培养箱中培养(30℃,24h)。观察细菌在固体培养基生长情况,以进行下一步菌种复筛。
配制活性橙染料培养基200ml(染料浓度500mg/L)分装于9个试管(序号:3-1、3-2、3-3、3-4、3-5、3-6、3-7、3-8、3-9)中,从固体培养基中挑选出单菌落,使用接种环将单菌落挑至试管染料液体培养基中,然后放入培养箱中培养(30℃,24h)。
选出褪色效果最为明显的,进行二次纯种分离(序号:4-1、4-2、4-3、4-4、4-5、4-6、4-7、4-8、4-9),选取最强脱色能力的菌株保存备用。
(3)菌株鉴定
筛选出的菌株送往上海派森诺生物科技有限公司,采用16S rDNA测序技术进行菌株鉴定。用NCBI Blast 软件将拼接后的序列文件与 NCBI ribosomal RNA sequence(Bacteria and Archaea)数据库中的数据进行比对,得到与待测物种序列相似性最大的物种信息,判定为该菌株的初步鉴定结果。
1.3.2 脱色效果优化
(1)培养基条件优化
活化菌株:配制LB培养液200mL,分装于10支试管,在灭菌锅108℃条件下灭菌30min。在无菌台中,使用接种环将冷藏保存的活性橙单菌落挑至试管中,在培养箱30℃下培养24h。

表1 培养基成分一览表
培养基条件的筛选优化:通过改变培养基中的葡萄糖用量和酵母用量等条件,优化筛选较为适合的菌株生长的处理活性橙染料废水的培养基。
首先,按照表1的成分组成配制17种培养基各100mL于锥形瓶中,并在灭菌锅108℃条件下灭菌30min;其次,在17种培养基中分别接入2mL活化菌液;然后,在37℃、120r/min的摇床中,培养24h。
(2)废水处理条件优化
在优化培养条件下,选取温度、摇床转速等影响因素进行单因素实验,优化染料废水的处理条件。
摇床转速的影响:将纯化得到的单菌落接种至6个100mg/L的染料培养基中,30℃条件下,振荡培养24小时,转速分别设定为0 r/min、40 r/min、60 r/min、80 r/min、100 r/min、120 r/min。取样测吸光度。将脱色率最佳的转速设定为测定温度影响时的固定变量。
温度的影响:将纯化得到的单菌落接种至5个100mg/L的染料培养基中,分别在20℃、25℃、30℃、35℃、40℃振荡培养24小时,取样测吸光度。
2 结果与讨论
2.1 菌株的筛选与鉴定
2.1.1 菌种筛选
初次筛选的4个培养基中,1-3号培养基中褪色较为明显(图1),故将1-3号培养基的菌种进行二次筛选。二次筛选的4个培养基中,2-2号培养基褪色最为明显(图1),故将2-2号培养基的菌种进行分离。
2.1.2 纯种分离
图2可知,初次挑菌后,培养基3-8号的去除效果最为明显,在3-8的基础上进行二次挑菌。二次挑菌后,培养基4-2号的去除效果最为明显,将4-2号培养基中菌体进行保存,一部分平板划线保存,用于活性橙染料废水的处理实验,另一部分进行甘油冷冻保存。
2.1.3 菌株鉴定
测序得到的序列在 NCBI ribosomal RNA sequence(Bacteria and Archaea)数据库中比对,选择相似度最大的序列作为菌株初步鉴定结果。普遍研究认为,当16S rDNA序列同源性高于97%时,可以认为是属内的同种[3]。脱色菌株与strain JCM10343的序列相似度为99%,该脱色菌株初步鉴定为。
2.2 脱色条件优化
2.2.1 培养基条件优化
培养基是影响菌株生长的重要因素,也直接影响菌株对染料的脱色性能[4]。研究发现,在无外加碳源的情况下,菌株不能以活性橙为唯一碳源进行代谢,菌株生长困难,染料的脱色与菌株的代谢相关。在培养基的碳源、氮源不变的情况下,调整培养基中葡萄糖和酵母提取物的用量,图3的实验数据表明:
(1)在培养基成分发生改变时,脱色效果发生显著变化,有机培养基脱色效果优于无机培养基。有机培养基的脱色率基本达到80%以上,无机培养基的脱色率在50%~60%之间,说明有机培养基更适于该筛选菌株的生长。
(2)在有机培养基中,培养基Y-B的脱色率最高,达到89.10%。故而,培养基的优化配方为有机培养基Y-B,即酵母提取物0.50g/L、葡萄糖20.00g/L、NaCl 0.10g/L、KH2PO42.00g/L、K2HPO42.00g/L、(NH4)2·SO40.20g/L、脲0.50g/L、MgSO4·7H2O 0.20g/L,并将此作为后续实验的固定培养基。
2.2.2 废水处理条件优化
(1)转速对去除效果的影响
由图4可知,震荡培养和静置培养对菌株脱色效果具有显著影响,震荡培养的脱色效果明显高于静置培养。在摇床转速40r/min的条件下,染液的脱色率更高,达到91.57%左右。
随着摇床转速的提高,染料脱色率逐步下降,分析认为,可能是因为摇床转速的提高影响了菌株的絮凝效果,从而导致染料脱色效率的降低。
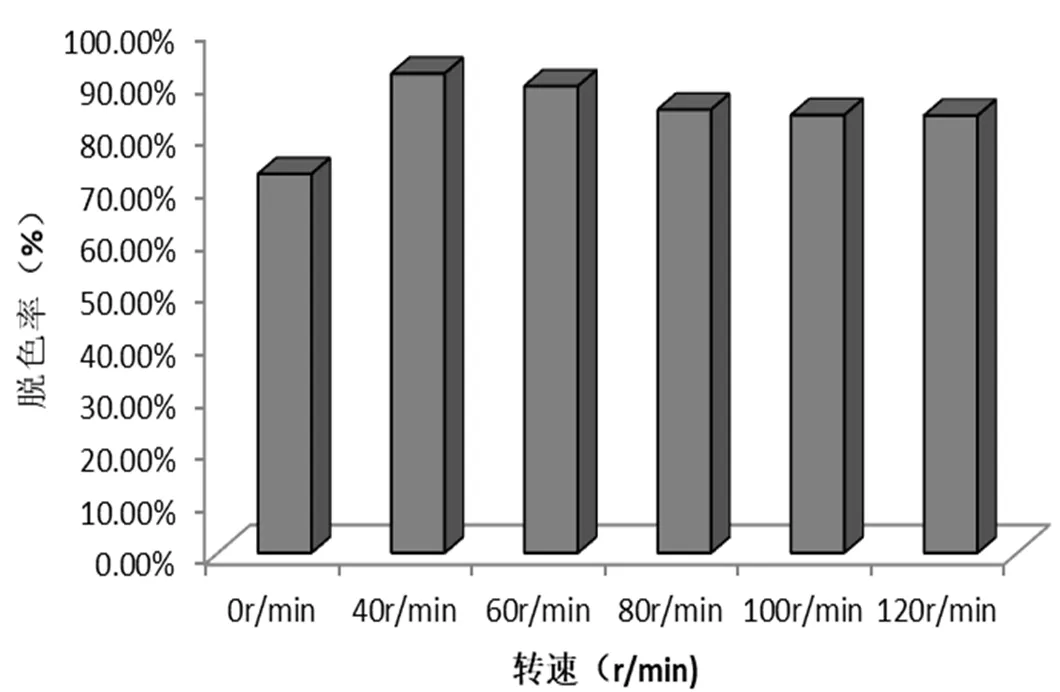
图4 转速对脱色效果的影响
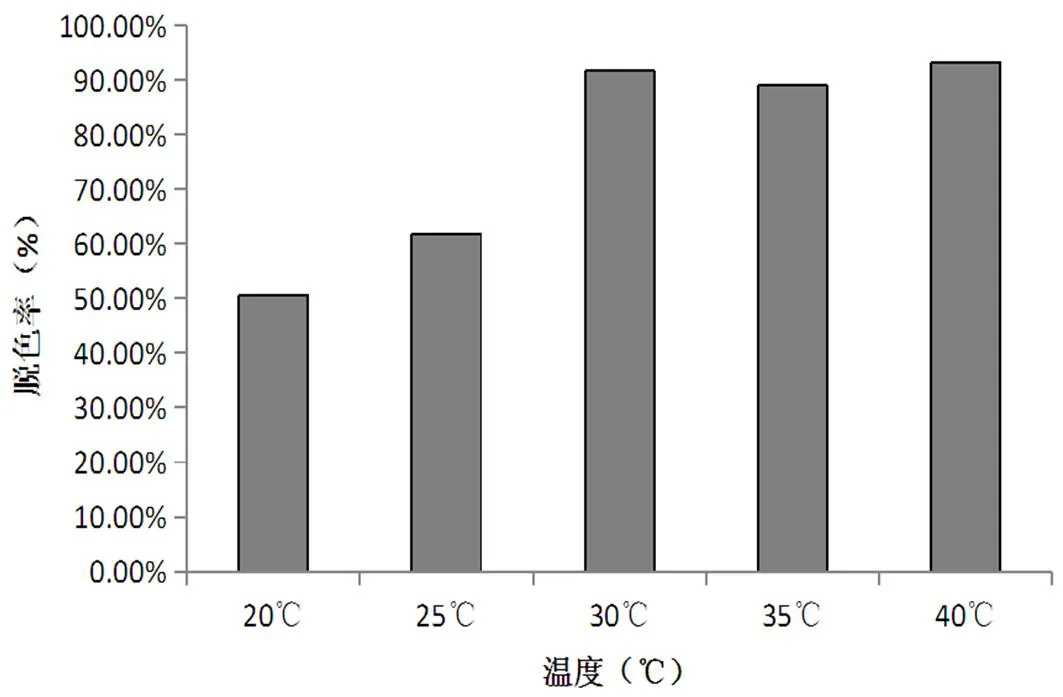
图5 温度对去除效果的影响
(2)温度对脱色效果的影响
由图5可知,在摇床转速为40r/min时,脱色效果随着温度升高而增加,30℃时,脱色率达91.57%,随后,温度继续升高,脱色效果没有明显的变化,40℃时,脱色率为93.10%。
温度是影响染料脱色效果的关键因素之一[5]。适合的温度有助于微生物生长和代谢,但温度过高却会抑制细菌生长,抑制了脱色菌活性,影响脱色效果[6]。
3 结论
利用条件温和的微生物技术处理染料废水是水处理技术的发展趋势和研究重点[7]。研究表明,微生物脱色效率与营养物浓度、pH、温度、溶氧、染料浓度等因素有关[8]。
本实验研究了微生物菌种对活性橙染料废水的处理效果,结论如下:
(1)筛选出了适合于降解活性橙染料的菌种,并对菌株进行了鉴定,初步鉴定该菌株为。
(2)探索了该菌株对活性橙染液脱色的培养基优化条件,培养基的优化配方为有机培养基Y-B,即酵母提取物0.50g/L、葡萄糖20.00g/L、NaCl 0.10g/L、KH2PO42.00g/L、K2HPO42.00g/L、(NH4)2·SO40.20g/L、脲0.50g/L和MgSO4·7H2O 0.20g/L。
(3)本实验优化了该菌株对活性橙染液脱色条件:染液浓度100mg/L、温度30℃、摇床转速40r/min、脱色24h,该染料脱色稳定在92%左右。
[1] Deng D, Guo J, Zeng G, et al. Decolorization of anthraquinone, triphenylmethane and azo dyes by a new isolated Bacillus cereus strain DC1[J]. International Biodeterioration & Biodegradation, 2008, 62: 263-269.
[2] 廖欢,严滨,黄国和,等. 一株酸性大红3R 脱色菌的分离,鉴定及其脱色性能研究[J]. 环境科学学报,2013,33(3):691-699.
[3] 张湾,孙璐璐,赵晓祥,等. 一株颜料红23脱色菌的分离、鉴定及脱色性能[J]. 江苏农业科学,2016,44(1):357-361.
[4] 李慧,曲媛媛,时胜男,等. 一株高效广谱染料降解细菌的分离鉴定及其脱色特性初探[J]. 微生物学通报,2011,8(4):523-530.
[5] 廖欢,严滨,黄国和,等. 一株高效广谱染料脱色菌脱色条件的优化[J]. 环境工程学报,2013,7(9):3649-3656.
[6] 赵鸭美,谢柳,周俊利,等. 一株广谱高效脱色菌的分离及其脱色鉴定特性[J]. 基因组学与应用生物学,2016,35(1):130-136.
[7] 王静,陆万祥. 蒽醌染料废水处理技术综述[J]. 河南科技,2017, (9):130-131.
[8] 周春晓,范雪荣,王强. 氧化还原酶及其在印染中的应用(二)[J]. 印染,2014, (7):46-51.
Screening, Identification and Decolorization on Reactive Orange of a Decolorizing Bacteria
ZHU Jin-Feng1,ZHAO Hui2,3,PENG Qi-An2,3
(1. Yichang Environmental Monitoring Station;Yichang Hubei 443000 China;2. College of Environment Engineering, Wuhan Textile University, Wuhan Hubei 430200, China;3. Engineering Research Center for Clean Production of Textile Dyeing and Printing, Ministry of Education, Wuhan Hubei 430200, China)
A strain of Reactive Orange decolorization strain S-3 was isolated from activated sludge. According to 16s rRNA gene sequence analysis, the facultative anaerobes strain was identified as. The optimum decolorization conditions for Reactive Orange were studied. The results showed that the optimum medium for decolorization of the strain was Glucose 20.00g/L, Yeast extract 0.50g/L, NaCl 0.10g/L, KH2PO42.00g/L, K2HPO42.00g/L, (NH4)2·SO40.20g/L, Carbamide 0.50g/L, MgSO4·7H2O 0.20g/L. The optimum culture medium was used at 40℃ and Shaker speed 40rpm for 24 hours. The decolorization rate of Reactive Orange dye solution of 100mg/L reached 82%. The selected strain has good decolorization performance for Reactive Orange solution and has a good prospect in dye industrial water treatment.
Reactive Orange; Screening; Identification; Biodecolorization
赵晖(1968-),女,副教授,硕士,研究方向:工业污水的处理与回用技术.
湖北省教育厅科学研究计划项目(B20111609)和(B2018061);湖北省高校省级教学团队项目(2019-109).
X784.03
A
2095-414X(2021)03-0025-05
