CYP2C19、ABCB1和PON1基因多态性对ACS病人PCI术后氯吡格雷治疗的影响
2021-07-01后世翔方存明栾家杰
后世翔,方存明,栾家杰,王 敏
急性冠状动脉综合征(ACS)是一组严重威胁人类生命健康的临床综合征,具有高致残性和死亡性,而其中血小板的聚集在疾病的演变过程中发挥关键作用。ACS病人行经皮冠状动脉介入(percutaneouscoronary intervention,PCI)术是挽救病人的常规方法,术后需要使用双联抗血小板(阿司匹林+氯吡格雷)治疗[1]。然而,由于氯吡格雷对血小板抑制作用存在较大的个体差异,抗血小板治疗仍存在一定风险,导致部分病人按照标准剂量规律服用氯吡格雷,仍出现抗栓治疗效果欠佳,不仅增加药物的不良反应风险,而且增加病人的主要心血管不良事件的发生率。目前认为氯吡格雷抵抗是导致病人出现心血管不良事件的主要原因。这种抵抗机制可能与病人依从性差、药物剂量不足、基因多态性、血小板激活替代途径有关。最新研究[2]也证实,基因多态性影响了氯吡格雷的抗血小板作用。
氯吡格雷为无活性的前体药物,其在肠道中转运受到三磷酸腺苷黏合转运体B1(adenosine triphosphate bindingcassette B1,ABCB1)调控,在生物转化过程中,细胞色素P4502C19和对氧磷酶1(paraoxonase-1,PON1)起关键作用。CYP2C19、ABCB1、PON1基因上的重要位点突变是引起氯吡格雷疗效差异的重要因素[3-4]。CYP2C19*2和*3为功能缺陷基因,若发生突变,氯吡格雷在体内活化速率将会减慢、活性代谢产物减少,降低其抗血小板作用[5]。研究[6]发现,ABCB1(3435C>T)基因多态性与ACS病人PCI术后死亡、心肌梗死、急性脑梗塞等相关心脑血管风险紧密相关。PON1 AA野生纯合型较GG突变纯合型病人对氧磷酶活性较低,产生支架内血栓风险高[7]。然而目前有关CYP2C19、ABCB1、PON1基因多态性与氯吡格雷抵抗的关系探讨研究较少,缺乏大样本、多中心的临床研究。基于此,本研究从实验室检查、基因多态性分布、血小板聚集率以及主要临床终点事件发生情况四个方面来探讨ACS病人氯吡格雷抗血小板疗效与其基因多态性之间的相关性。现作报道。
1 对象与方法
1.1 研究对象 选择2018年1月至2019年1月宣城市人民医院心内科招募的行PCI术的ACS病人196例。根据基因检测结果,分为正常组172例和慢代谢24例组。其中正常组为未携带风险基因,即CYP2C19*1*1、ABCB1(3435C>T)CC/CT、PON1 GG。中度风险,即携带风险基因的杂合子型CYP2C19*2或*3杂合子,或PON1 GA,或ABCB1(3435C>T)TT;慢代谢组为携带风险基因的纯合子型,CYP2C19*2或*3纯合子,或CYP2C19*2/*3或PON1576 AA及ABCB1(3435C>T)TT。
纳入标准:(1)年龄>18岁;(2)明确诊断为ACS,包括急性ST/非ST段抬高型心肌梗死和不稳定性心绞痛;(3)手术前给予病人负荷剂量阿司匹林(300 mg)和氯吡格雷(300 mg),术后按照标准剂量阿司匹林100 mg/d和氯吡格雷75 mg/d抗血小板治疗。
排除标准:(1)既往有过药物过敏史(阿司匹林或氯吡格雷);(2)患有血液系统疾病(出血性疾病或存在出血倾向);(3)严重肝肾功能障碍病人;(4)正在使用抗凝药的病人;(5)病人拟近期行外科手术或者有抗血小板治疗的相关禁忌证;(6)严重心力衰竭(NYHA Ⅳ级)或重度贫血(血红蛋白<60 g/L)的病人;(7)妊娠期和哺乳期妇女。本研究方案经医院伦理委员会批准,并取得病人或家属书面知情同意。
1.2 方法
1.2.1 治疗方法 正常组病人采用氯吡格雷75 mg/d+阿司匹林100 mg/d维持剂量,慢代谢组病人采用替格瑞洛180 mg/d+阿司匹林100 mg/d维持剂量。2组病人均依据自身并发疾病及具体临床症状,按照临床诊疗指南给予病人他汀类药物、硝酸酯类、β受体阻滞剂等以及高血压、糖尿病等其他对症治疗。比较2组病人服药>5 d后二磷酸腺苷(ADP)诱导的血小板聚集率,以及病人术后随访1年的主要心血管不良事件和出血事件的发生概率。
1.2.2 CYP2C19、ABCB1和PON1基因型检测 取病人静脉血2 mL置于抗凝管中,使用荧光检测仪(西安天隆科技有限公司,TL998A型)进行基因型检测。氯化铵溶液与灭菌注射用水按照1∶9比例稀释成1X氯化铵稀释液;取200 μL混匀的血液标本加入1 000 μL氯化铵稀释液中,上下颠倒,室温静置15 min;样本放入离心机,3 000 r/min离心5 min;吸除离心管中淡黄色上清液,离心管底部得到绿豆大小的富集;加入20 μL耀金保反复吹打白细胞沉淀,使其充分混匀,室温静置30 min,得到白细胞检测样品;吸取2.0 μL检测样品加入相应耀金分中,快速离心使样品充分混匀,置入荧光检测仪;采用荧光检测系统自动判读荧光信号值,获取荧光曲线图,进行CYP2C19、ABCB1、PON1基因分型。本实验室在上海临检中心做室间以及室内质控,每批次试剂均做阳性质控。
1.2.3 血小板聚集率测定 病人入院后接受负荷剂量阿司匹林和氯吡格雷,连续服用药物≥5 d,采用血小板聚集分析仪(北京世帝科学仪器公司,LG-PABER-Ⅰ型)测定血小板聚集率,按照产品说明书进行。采集静脉血,混匀充分。在800 r/min条件下离心5 min,制备富含血小板的血浆,将已经吸取富含血小板后的血浆再经5 000 r/min离心10 min,制备贫血小板血浆。以贫血小板血浆为空白参照,将ADP诱导剂加入富含血小板的血浆,测定经ADP诱导的血小板聚集率。
1.2.4 临床随访及观察终点 于病人出院后12个月,通过门诊、住院以及电话方式对病人进行随访。随访主要临床终点事件为主要心血管不良反应和出血事件。主要心血管不良反应包括急性脑梗塞、复发心绞痛导致住院、急性心肌梗死、和心血管相关死亡。出血主要包括皮肤及黏膜出血、消化系统出血、脑出血等。
1.3 统计学方法 采用t检验、方差分析、q检验和χ2检验。
2 结果
2.1 2组病人一般资料比较 2组病人年龄、性别、吸烟、饮酒、合并症(高血压、脑梗死、高血脂症、糖尿病)、生化指标(血小板计数、血红蛋白、总胆固醇、三酰甘油、低密度脂蛋白、肌酐、空腹血糖、纤维蛋白原)差异均无统计学意义(P>0.05),合并用药(他汀类、ACEI/ARB、硝酸酯类)差异均有统计学意义(P<0.05~P<0.01)(见表1)。
表1 2组病人一般临床资料比较
2.2 不同基因型病人血小板聚集率比较 PON1、CYP2C19、ABCBl不同分型病人血小板聚集率间差异均有统计学意义(P<0.01)(见表2)。

表2 不同基因型血小板聚集率比较
2.3 不同基因型病人临床终点事件比较 196例病人随访期间内,发生心脑血管缺血事件共16例。但不同基因分型病人心脑血管缺血事件发生率间差异均无统计学意义(P>0.05)(见表3)。
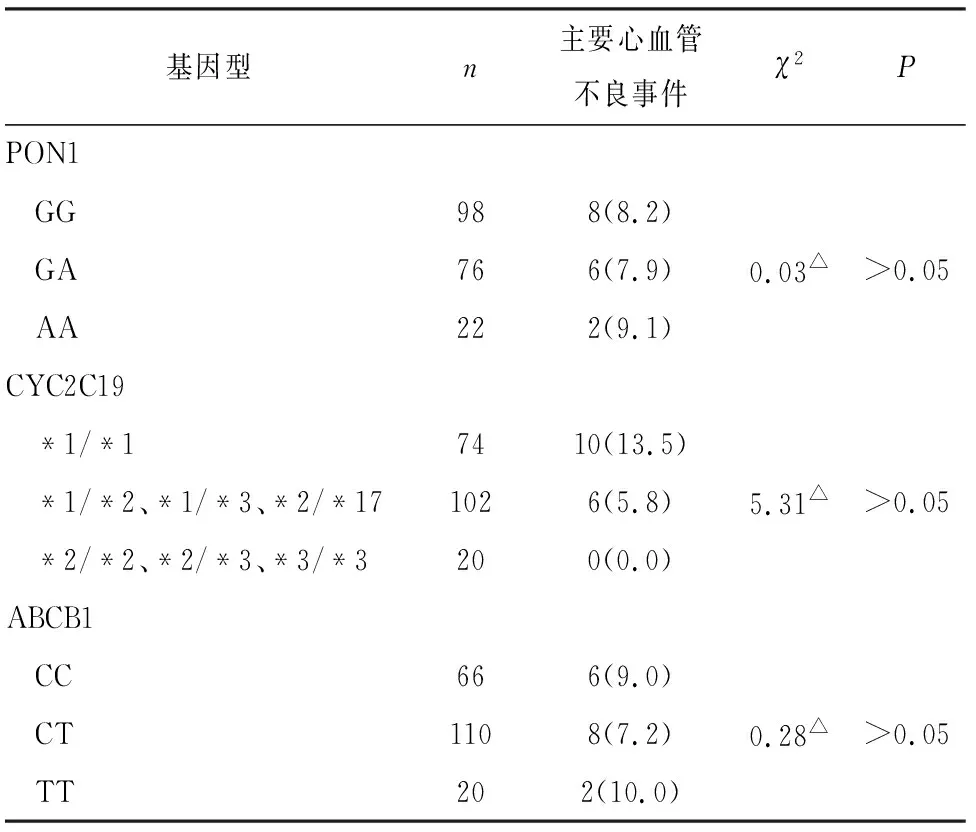
表3 不同基因分型病人临床终点事件比较[n;百分率(%)]
2.4 2组病人主要心血管不良事件比较 196例病人共发生主要心血管不良事件16例,严重出血4例,其中慢代谢组均无心血管不良事件及严重出血事件发生,但2组病人主要心血管不良事件及严重出血发生率差异均无统计学意义(P>0.05)(见表4)。
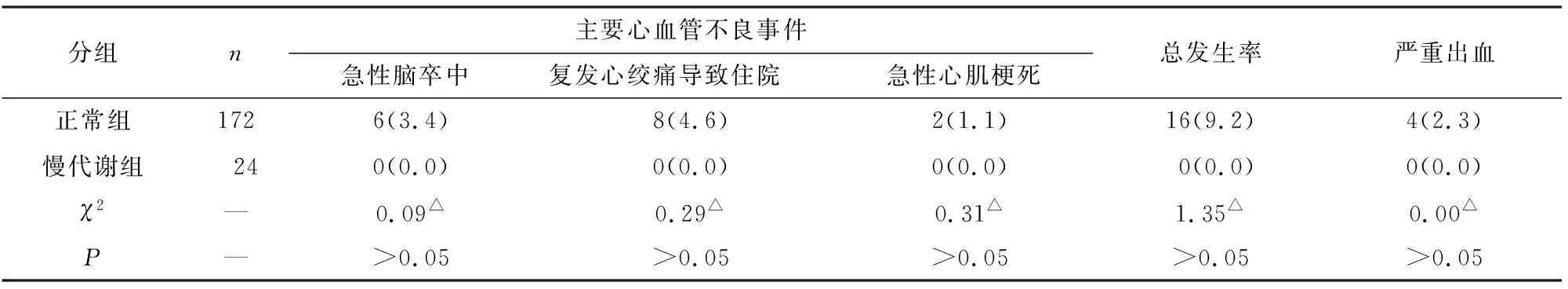
表4 主要心血管不良事件比较[n;百分率(%)]
3 讨论
ACS病人PCI术后抗栓治疗是保证病人治疗效果的关键因素,而其中氯吡格雷联合阿司匹林是临床广泛应用的抗栓治疗药物。氯吡格雷通过抑制血小板聚集来预防支架内血栓形成、降低远期心血管事件的发生风险。氯吡格雷作为前体药物,需通过CYP系统经生物转化成硫醇衍生物,从而发挥抗血小板作用[8]。CYP2C19酶是氯吡格雷的重要代谢酶[9],国内外均有研究[10-11]显示CYP2C19基因多态性可能影响氯吡格雷的抗血小板作用。CYP2C19基因多态性主要有两类突变引起,一类是功能缺陷基因,可导致酶活性降低,如CYP2C19*2、CYP2C19*3等,另一类是功能增强基因,可增强酶的活性,如CYP2C19*17。研究[12]显示,CYC2C19*2和*3是中国人常见的2种突变基因型,发生率分别为30%和5%。我们的研究结果显示,196例病人中,CYP2C19*1/*1病人74例,CYP2C19*1/*2病人80例,CYP2C19*1/*3病人18例,CYP2C19*2/*2病人16例,CYP2C19*2/*3病人4例,结果基本与相关报道一致。CYP2C19*2与CYP2C19*3等位基因的缺失可使肝脏对氯吡格雷的代谢减弱,这也解释了部分病人服用标准剂量的氯吡格雷后仍发生不良临床事件的现象。有研究[13]显示,CYC2C19*2基因突变使得氯吡格雷代谢减慢,导致病人服药后出现血小板抑制减少,增加了血栓形成风险。一项大型的PLATO的遗传试验也得到类似的研究结果,即携带有CYP2C19*2或*3等位基因的病人,发生氯吡格雷抵抗的风险较大,而使用替格瑞洛抗血栓治疗,可有效避免因这种基因突变带来的风险[14]。
CYP2C19*17等位基因是一种功能获得型等位基因,CYP2C19*17基因突变频率较低,其基因变异与转录活性相关,可导致CYP2C19底物的广泛代谢,从而血小板对氯吡格雷治疗的反应增强[15]。这种反应的增强一方面使得氯吡格雷活化代谢产物水平明显升高,血小板抑制程度更高,血栓形成风险较小,另一方面血小板抑制作用带来的出血风险亦会增加。对于韩国人群的研究[16]也显示,CYP2C19*2和CYP2C19*3等位基因突变相对频繁,而CYP2C19*17的频率非常低。本研究中共8例病人CYP2C19*17位点发生杂合突变,但无一例纯合突变。
PON1是氯吡格雷在肝脏内第二步活化过程的关键酶,其中PON1 Q192R位点研究较多,但目前结果也存在较大争议[17-18]。本研究中PON1 GG野生纯合型98例(50.0%),GA杂合突变型76例(38.7%),AA突变纯合型22例(12.2%),携带A突变等位基因病人的血小板聚集率较野生纯合型病人高。ABCB1为编码P-糖蛋白的重要蛋白,一项Meta荟萃结果表明,在使用氯吡格雷高剂量(300 mg/d)病人中,ABCB1 C3435T多态性可能是发生主要不良心血管事件的危险因素,并且与ABCB1(3435C>T)CC野生纯合型相比,TT突变纯合型降低了出血的结果[19]。但是有关ABCBl研究尚无较为确定的结论,亦有研究发现携带CC型等位基因病人,其主要心血管不良事件发生率更高。本研究虽显示ABCBI(3435C>T)基因TT型血小板聚集率明显高于野生纯合型CC型,但结果未能发现ABCBI(3435C>T)基因多态性和临床终点事件的相关性。
替格瑞洛是一种新型血小板P2Y12受体的拮抗剂,其通过可逆性与P2Y12受体结合,从而抑制ADP诱导的血小板活化,发挥抗血栓作用[20]。一项10 285例ACS病人的研究[14]显示,对于任何CYP2C19基因型,替格瑞洛在减少主要心血管临床终点事件的发生率方面都优于氯吡格雷;而常规的氯吡格雷治疗组,携带了CYP2C19*2或*3等位基因突变的病人与野生型相比,随访期内的临床终点事件发生率明显增高,同时伴随出血风险的增加。本研究显示,慢代谢组使用替格瑞洛的替代治疗方案,随访1年内未发生主要临床终点事件。提示针对慢代谢型病人,使用替格瑞洛可能会取得更优的临床效果。
本研究不足之处是研究总样本量较少,临床随访时间还较短,还需要更多样本以及其他多中心临床机构来评价CYP2C19、ABCB1和PON1基因多态性和氯吡格雷抗血小板治疗的有效性和安全性。
